
4_Khmicheskoe_ravnovesie
.pdf
ЛЕКЦИЯ 4
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
ПЛАН ЛЕКЦИИ
 Основные понятия.
Основные понятия.
 Закон действующих масс.
Закон действующих масс.
 Влияние температуры на константу химического равновесия.
Влияние температуры на константу химического равновесия.
 Влияние различных факторов на состояние химического равновесия.
Влияние различных факторов на состояние химического равновесия.
Принцип Ле Шателье.
Влияние концентраций (парциальных давлений) компонентов системы.
Влияние давления.
Влияние температуры.
Влияние катализатора.
Выбор оптимального технологического режима.
 Кажущееся равновесие.
Кажущееся равновесие.
ОСНОВНЫЕ ПОНЯТИЯ
Все самопроизвольно протекающие реакции можно разделить на две группы: обратимые и необратимые.
Необратимые реакции проходят только в одном направлении до конца,
т.е. до полного превращения одного или всех исходных веществ в продукты реакции. Пример:
2KClO3 = 2KCl + 3O2.
Обратимые реакции идут в противоположных направлениях, не проходят до конца, исходные вещества полностью не расходуются. Пример:
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2 + I2  2HI.
2HI.
В ходе обратимых реакций наступает состояние химического равновесия.
Сущность этого понятия рассмотрим на конкретном примере. Представим, что в замкнутом сосуде при постоянных температуре и давлении смешали определенные количества газообразного водорода и йода, которые могут взаимодействовать с образованием йодоводорода (прямая реакция).
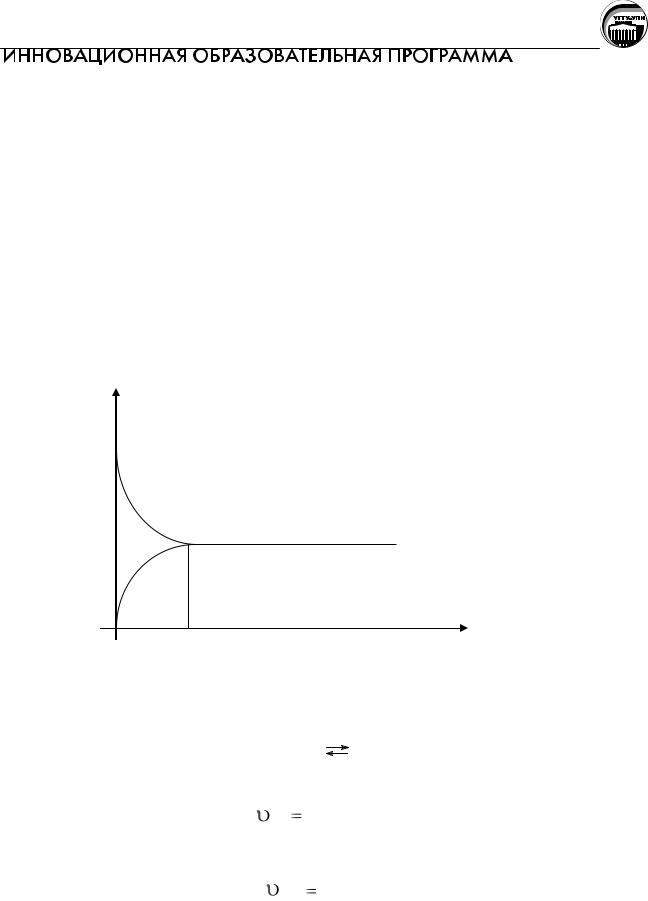
Йодоводород распадается на йод и водород (обратная реакция). График изменения скорости прямой и обратной реакции с течением времени представлен на рисунке.
υ
υпр= υобр
0 |
τравн |
|
|
τ |
Для системы |
|
|
|
|
|
H2 + I2 |
2HI |
||
кинетическое уравнение прямой реакции |
|
|
||
|
пр |
kпрСH |
CI |
, |
|
|
|
2 |
2 |
обратной реакции – |
|
|
|
|
|
обр |
kобрСHI2 |
, |
|
где k пр и k обр - константы скорости прямой и обратной реакций соответственно.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

В начальный момент времени скорость прямой реакции максимальна,
скорость обратной реакции равна нулю, так как равна нулю CHI . В ходе
прямой реакции концентрации CH2 и CI2 уменьшаются, т.е. снижается скорость прямой реакции, а концентрация йодоводорода CHI увеличивается,
следовательно, скорость обратной реакции возрастает. Наступает такой момент времени, когда скорости прямой и обратной реакций становятся равными.
Состояние системы, характеризующееся равными скоростями прямой и обратной реакций, называют состоянием химического равновесия.
Соответствующий наступлению равновесия момент времени на графике
обозначен равн .
Химическое равновесие имеет динамический характер. В условиях химического равновесия количество любого вещества, расходующегося в ходе прямой реакции, равно его количеству, образующемуся в результате обратной реакции. Концентрации (или парциальные давления в случае газов) всех веществ в системе не изменяются со временем, их называют равновесными концентрациями (или равновесными парциальными давлениями) веществ.
Равновесные концентрации, в отличие от текущих значений концентраций,
обозначают символом вещества в квадратных скобках: [H2], [I2], [HI] и т.п.
В рассматриваемой системе равенству скоростей прямой и обратной
реакций в состоянии химического равновесия
|
|
|
|
|
|
|
|
|
пр |
|
обр |
||||||||||
соответствует выражение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
k пр [H 2 ][I2 ] = k обр[HI]2 , |
||||||||||||||||||
откуда следует |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
k пр |
|
|
[HI]2 |
||||||||||||||
|
|
|
|
|
= |
|
. |
||||||||||||||
|
|
|
|
k обр |
[H2 ][I2 ] |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель: |
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Соотношение констант скоростей k пр / k обр является также константой
kпр / kобр const K .
[HI]2
K = [H2 ][I2 ] .
Константу К называют константой равновесия.
ЗАКОН ДЕЙСТВУЮЩИХ МАСС
В закрытой системе в состоянии равновесия при постоянной температуре отношение произведений концентраций продуктов реакции и исходных веществ в степенях, равных стехиометрическим коэффициентам,
является постоянной величиной.
В закрытой системе для обратимой реакции
aA + bB  cC + dD
cC + dD
уравнение
Kc |
[C]c[D]d |
const при T = const |
|
[A]a [B]b |
|||
|
|
представляет собой математическое выражение закона действующих масс. В
условиях химического равновесия закон действующих масс справедлив для любых реакций, не только для элементарных.
Для гомогенных химических равновесий в газовых смесях константа равновесия может быть выражена как через равновесные концентрации (Кс),
так и через равновесные парциальные давления (Кр).
Например, для реакции синтеза аммиака
N2(г) + 3H2(г)  2NH3(г)
2NH3(г)
математическое выражение закона действующих масс имеет вид:
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

K c = |
|
[NH3 ]2 |
|||||
[N 2 ][H 2 ]3 |
|||||||
|
|||||||
или |
|
|
|
|
|
|
|
K p |
|
p |
2NH |
3 |
, |
||
|
|
|
|||||
|
|
|
|
|
|
||
|
|
p N |
p3H |
2 |
|
||
|
|
|
2 |
|
|
||
где p - равновесные парциальные давления веществ.
Если все вещества газообразные, и их поведение подчиняется законам идеальных газов, связь между Кр и Кс можно выразить уравнением
|
|
Kp |
|
Kc (RT) Δn, |
|
|
||
где n - разность стехиометрических коэффициентов в правой и левой |
||||||||
частях уравнения: |
Δn |
(c d) |
|
(a b). Например, для реакции синтеза |
||||
аммиака Δn 2 - (1 |
3) |
-2 и K |
p |
K |
c |
(RT)-2 |
Kc |
. |
|
||||||||
|
|
|
|
|
R 2T2 |
|||
|
|
|
|
|
|
|
||
В гетерогенных системах концентрации твердых веществ считают постоянными и в уравнение для константы равновесия не включают.
Так для реакции
MgCO3(к) |
|
MgO(к) + CO2(г) |
|
K c = [CO 2 |
] , |
Kp |
pCO |
|
|
|
2 |
Константа равновесия – |
важнейшая |
характеристика обратимых |
|
химических реакций. Ее значение позволяет судить о полноте прохождения реакции: чем больше значение константы равновесия, тем больше концентрации продуктов реакции, тем с большей полнотой проходит прямая
реакция. |
|
|
|
Значение |
К → 0 |
свидетельствует о |
практически полном отсутствии |
взаимодействия. |
Если |
K 1 ( k пр > k обр ), |
принято говорить, что равновесие |
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

смещено в сторону прямой реакции или вправо, если K < 1 - равновесие смещено в сторону обратной реакции (влево).
Константа равновесия, так же как и константа скорости, зависит от природы веществ, образующих систему, и от температуры, но не зависит от
концентраций веществ.
Используя закон действующих масс, можно рассчитать равновесные
концентрации реагентов по известным исходным концентрациям.
Пример 1. Рассчитайте равновесные концентрации веществ в системе
|
|
CO(г) + H2O(г) |
CO2(г) + H2(г) |
|
|
||
при 1023 К, если Кс = 1, а исходные концентрации ССО = CH |
O = 3 моль / л . |
||||||
|
|
|
|
|
2 |
|
|
Решение. |
|
|
|
|
|
|
|
В начальный момент времени CO2 |
и H2 отсутствовали, т.е. исходные |
||||||
концентрации CCO |
2 |
= CH |
2 |
= 0. Принимаем, что концентрация |
CO2 в ходе |
||
|
|
|
|
|
|
||
реакции увеличилась на х моль/л, соответственно [CO 2 ] 0 x |
x моль/л . Из |
||||||
уравнения реакции следует, что на столько же увеличилась концентрация
водорода, т.е. [H2 ] 0 x x моль/л , и уменьшилась концентрация CO и H2O:
[CO] [H 2O] (3 - x) моль/л .
Подставим равновесные концентрации в выражение константы
равновесия |
|
|
|
|
|
|
Kc |
CO2 |
H2 |
|
x x |
|
1. |
|
H2O |
|
|
|
||
|
CO |
|
(3 x)(3 |
x) |
||
Отсюда 9 - 6x + x2 = x2 , т.е. х = 1,5 моль/л.
Соответственно значения равновесных концентраций реагентов:
[CO 2 ] [H2 ] |
x 1,5 моль/л; [CO] |
[H2O] 3 |
x |
3 |
1,5 1,5 моль/л. |
Можно |
решить и обратную |
задачу, |
т.е. |
по |
известным равновесным |
концентрациям определить константу равновесия, а затем – исходные концентрации реагирующих веществ.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Закон действующих масс позволяет при известном значении константы равновесия определить возможное направление реакции в системе определенного состава.
Пример 2. Константа равновесия реакции
2SO2(г) + O2(г)  2SO3(г)
2SO3(г)
Кс = 83,88 при температуре 950 К. Исходные концентрации веществ в газовой
смеси CSO = 0,5моль/л; |
CO |
2 |
= 0,4моль/л; |
CSO = 1моль/л. Определите |
2 |
|
|
3 |
направление возможной реакции в системе.
Решение. В ходе химической реакции система стремится достичь равновесного состояния, характеризующегося значением константы равновесия
|
|
|
K c |
= |
|
|
[SO3 ]2 |
|
= 83,88. |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
[SO2 ]2[O2 ] |
|
|
|
|
||||||||||
При этом |
значения концентраций |
стремятся |
к равновесным, а их |
|||||||||||||||||
|
|
C 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
соотношение |
|
3 |
- к значению Кс. |
Рассчитаем значение соотношения |
||||||||||||||||
CSO2 2 CO2 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
концентраций веществ в исходной газовой смеси |
|
|
|
|
||||||||||||||||
|
|
|
|
CSO2 |
3 |
12 |
|
|
|
10. |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
CSO2 |
2 CO 2 0,52 |
0,4 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
Значение |
Кс>10, т.е. |
|
в |
|
ходе достижения |
равновесия |
значение |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
C 2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
SO |
|
|
|
|
|||
соотношения концентраций |
реагентов |
|
3 |
|
будет возрастать |
за счет |
||||||||||||||
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
CSO2 2 CO2 |
|
|
||||||
увеличения концентрации CSO3 и снижения концентраций CSO2 и CO2 . Это означает, что при данном составе системы в ней возможна прямая реакция.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА КОНСТАНТУ ХИМИЧЕСКОГО РАВНОВЕСИЯ
Константа равновесия связана с энергией Гиббса уравнением
G0T -RTlnK .
или
- ΔG0T
K e RT ,
т.е. константу равновесия можно определить, используя расчетное значение
величины GT0 химической реакции. |
|
|
|
|
|
||
Как известно, GT0 |
HT0 - T ST0 , выполним подстановку в выражение |
||||||
константы равновесия |
|
|
|
|
|
|
|
K e - |
H To -T STo |
|
e- |
H To |
STo |
e- |
H To STo |
RT |
RT |
R |
RT e R . |
||||
Полученное уравнение характеризует зависимость константы равновесия от температуры. Для анализа этой зависимости используем более удобную форму записи
ln K |
- |
HT0 |
|
ST0 |
. |
|
|
||||
|
|
RT |
R |
||
Влияние температуры на величины |
HT0 и ST0 незначительно, таким |
||||
образом, зависимость ln K = f (T) |
близка к линейной. Константа равновесия |
||||
экзотермических реакций ( H 0) |
уменьшается с повышением температуры, |
||||
т.е. полнота прохождения экзотермических реакций снижается при нагревании.
Напротив, для эндотермических процессов ( H 0) рост температуры
приводит к увеличению константы равновесия, т.е. повышению полноты прохождения прямой реакции.
Пример 3. Для реакции |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
4NO(г) |
|
2N2O(г) + O2(г) |
|||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

рассчитайте |
|
при Т = 298 К стандартную энергию Гиббса |
G0298 и константу |
равновесия Кс; |
|
при Т = 1500 К стандартную энергию Гиббса |
G15000 и константу |
равновесия Кс;  температуру, при которой равновероятны оба направления реакции.
температуру, при которой равновероятны оба направления реакции.
Укажите преобладающее направление реакции при температуре 298 К и
1500 К. |
|
|
|
|
|
|
|
|
Значения стандартных энтальпий образования |
H0298 |
и энтропий S0298 веществ: |
||||||
|
|
|
|
|
|
|
|
|
|
Вещество |
NO(г) |
|
N2O(г) |
|
O2(г) |
|
|
|
|
|
|
|
|
|
|
|
|
Hобр0 |
, кДж/моль |
90,4 |
|
81,6 |
|
0 |
|
|
|
|
|
|
|
|
|
|
|
S0 , Дж/мольК |
210,6 |
|
220,0 |
|
205,0 |
|
|
|
|
|
|
|
|
|
|
|
Решение.
Стандартная энтальпия реакции
H0 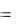 nпрод. H0обр.прод
nпрод. H0обр.прод  nисх Н0обр.исх
nисх Н0обр.исх
2 Н0N |
O |
НO0 4 Н0NO 2 82,0 4 90,4 197,6 кДж. |
2 |
|
2 |
H0 < 0 – реакция экзотермическая.
Стандартная энтропия реакции
S0 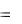 nпродS0прод
nпродS0прод  nисхS0исх
nисхS0исх
2S0N 2 О S0O 2 4S0NO 2 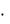 220,0 205,0 4
220,0 205,0 4 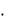 210,6
210,6 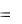
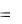 197,4 Дж/К
197,4 Дж/К  197,4 10 3 кДж/K.
197,4 10 3 кДж/K.
ΔS0 < 0 – в ходе реакции система переходит в более упорядоченное
состояние.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Стандартная энергия Гиббса реакции
G0298 |
|
H0 T |
|
S0 |
197,6 |
|
|
298 ( 197,4 10 3 ) |
138,8 кДж . |
||||||||||||||||||||||||||||
G0298 |
0 – при Т = 298 К возможна самопроизвольная прямая реакция. |
||||||||||||||||||||||||||||||||||||
Константа равновесия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
lgK 298 |
|
|
|
G0298 |
|
|
|
|
|
|
|
|
138,8 |
|
|
|
|
|
24,4; |
|
|
|
|
|
|||||||||||
|
|
|
|
2,3RT |
2,3 |
8,31 10 |
|
3 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
K298 ≈ 1024. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Если пренебречь зависимостями энтальпии и энтропии реакции от |
|||||||||||||||||||||||||||||||||||||
температуры и считать их постоянными, равными ∆H0 и ∆S0, можно |
|||||||||||||||||||||||||||||||||||||
рассчитать |
GT0 |
при нестандартной температуре Т: |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
GТ0 |
H0 |
|
|
T S0. |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Энергия Гиббса реакции при температуре 1500 К: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
G15000 |
H0 |
T S0 |
|
|
197,6 |
1500 ( |
|
197,4 10 3 ) |
98,5 кДж . |
||||||||||||||||||||||||||||
G15000 >> 0 - при Т = 1500 К возможна самопроизвольная обратная |
|||||||||||||||||||||||||||||||||||||
|
|
|
реакция. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
lgK 1500 |
|
G15000 |
|
|
|
|
|
|
|
|
|
98,5 |
|
|
|
|
|
|
|
3,44 3 |
|
|
|
|
|
||||||||||
|
|
|
2,3RT |
|
|
2,3 |
8,31 10 |
3 |
|
1500 |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
K1500 = 10-3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
На графике приведена зависимость |
|
GT0 |
f (T) : |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
GT0 , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
кДж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
200 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т, К |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
-100 |
|
|
500 |
|
1000 |
|
1500 |
|
2000 |
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
-200 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Исполнитель: |
|
|
|
|
|
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
