
2_Entropia_Energia_Gibbsa
.pdf
ЛЕКЦИЯ 2
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ЭНТРОПИЯ И ЭНЕРГИЯ ГИББСА
ПЛАН ЛЕКЦИИ
 Энтропия.
Энтропия.
Второе начало термодинамики.
 Энергия Гиббса. Термодинамическая возможность прохождения химической реакции.
Энергия Гиббса. Термодинамическая возможность прохождения химической реакции.
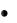 Влияние температуры на направление химической реакции. Расчет стандартной энергии Гиббса химической реакции.
Влияние температуры на направление химической реакции. Расчет стандартной энергии Гиббса химической реакции.
ЭНТРОПИЯ
Одним из основных вопросов при изучении закономерностей химических процессов является вопрос о направлении самопроизвольных реакций.
Самопроизвольные процессы совершаются в системе без вмешательства со стороны внешней среды. Эти процессы протекают за счет уменьшения внутренней энергии системы. При этом может происходить передача энергии во внешнюю среду в форме теплоты или работы.
Несамопроизвольные процессы не могут протекать без воздействия извне. Такие процессы невозможны в изолированной системе.
В ХIХ веке был сформулирован принцип Бертло, согласно которому самопроизвольные процессы сопровождаются выделением теплоты. Иначе говоря, все самопроизвольные процессы должны быть экзотермическими. Большинство известных реакций в природе – экзотермические: горение, коррозия металлов и другие.
Тем не менее, использовать величину H для оценки возможности прохождения реакции нельзя. К примеру, реакции растворения многих веществ эндотермические, а процесс идет самопроизвольно.
|
K2SO4(т) = K2SO4(р), |
H0 = 26,8 кДж. |
|||||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Самопроизвольно идет смешение газов, стоит представить, как быстро распространяются запахи летучих веществ. Этот процесс не сопровождается выделением энергии.
Движущей силой таких процессов является стремление системы достичь более неупорядоченного состояния. Мера неупорядоченности системы - энтропия. Энтропия была предложена Клаузиусом как функция, изменение которой равно отношению теплоты, поглощенной системой, к абсолютной температуре:
S QT ,
где Q – количество теплоты, получаемое системой при температуре T.
Отсюда следует, что подведенная при постоянной температуре теплота расходуется на увеличение энтропии.
Состояние системы можно характеризовать по-разному:
значениями параметров (температура, давление, объем), которые определяют макросостояние системы;
совокупностью микросостояний системы, которые определяются распределением частиц по доступным уровням энергии.
На рисунке приведены варианты распределения двух частиц по пяти уровням энергии при суммарном значении энергии системы, равном 7 условным единицам. Данное макросостояние может быть реализовано двумя различными микросостояниями.
Е
5
4
3
2
1
0
•
•
Е
5
4
3
2
1
0
•
•
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
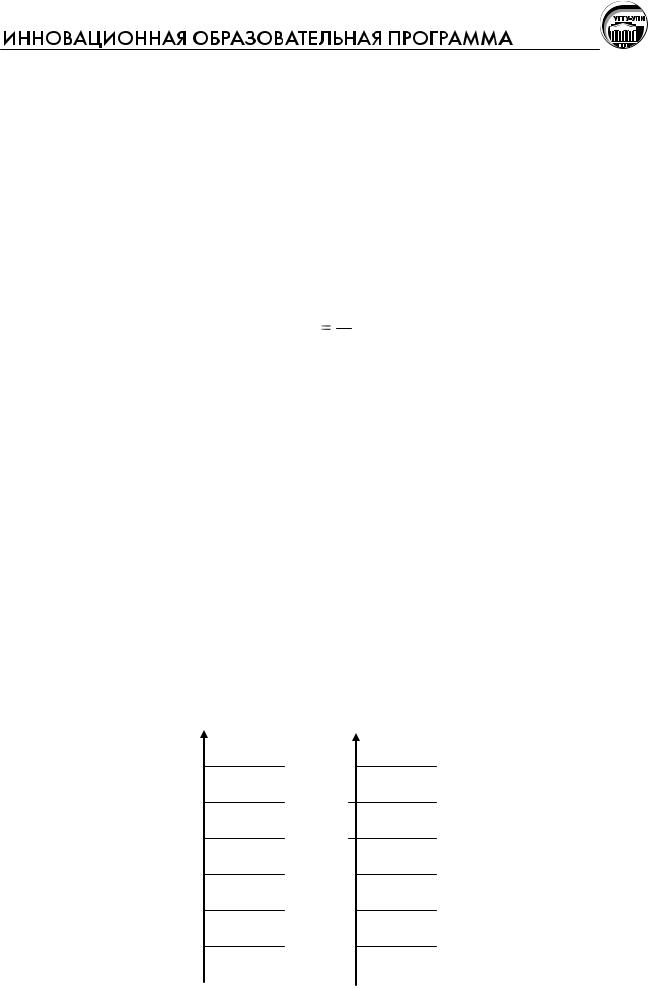
При том же суммарном значении энергии для системы, состоящей из трех частиц, количество вариантов распределения частиц по уровням энергии возрастает до четырех.
Е
5
4
3
2
1
0
•
• •
Е
5
4
3
2
1
0
•
•
•
Е
5
4
3
2
1
0
•
• •
Е
5
4
3
2
1
0
• •
•
Поскольку все тела состоят из множества частиц, имеющих множество доступных уровней энергии, каждому макросостоянию отвечает огромное количество различных микросостояний.
Число микросостояний, соответствующее данному макросостоянию системы при заданных объеме и внутренней энергии, называют
термодинамической вероятностью (W) состояния.
Энтропия служит мерой термодинамической вероятности данного состояния системы и определяется по формуле Больцмана:
S k  lnW
lnW
k |
R |
|
|
||
NA |
||
|
где k – постоянная Больцмана;
R – универсальная газовая постоянная;
NA – число Авогадро.
Энтропию измеряют в Дж/(моль∙К), так как обычно ее относят к 1 моль вещества.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Значение энтропии для любого вещества можно определить экспериментально. Энтропия зависит от природы веществ, агрегатного состояния, давления, температуры. В таблицах термодинамических величин приводят значения стандартных энтропий веществ S0298 (или S0). Стандартная энтропия простых веществ не равна нулю. Энтропия совершенного кристалла любого вещества при абсолютном нуле равна нулю.
Энтропия возрастает при нагревании, плавлении, сублимации, испарении,
реакциях с увеличением объема системы, растворении веществ и других процессах, сопровождающихся ростом неупорядоченности. Напротив,
процессы, связанные с увеличением упорядоченности, в том числе,
охлаждение, кристаллизация, конденсация, сжатие характеризуются уменьшением энтропии.
Пример справочных данных для различных агрегатных состояний воды:
|
Вещество |
|
H2O(к) |
|
H2O(ж) |
|
H2O(г) |
|
|
|
|
|
|
|
|
|
|
|
S0298, Дж/(моль.К) |
|
44,8 |
|
70,1 |
|
188,7 |
|
|
|
|
|
|
|
|
|
|
Очевидно, что по мере |
перехода твердое |
вещество |
жидкость газ |
|||||
происходит увеличение неупорядоченности в системе и соответственное возрастание энтропии.
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Представляет интерес использование энтропии для характеристики направления самопроизвольного процесса в системе. Согласно второму началу термодинамики: самопроизвольные процессы в изолированных системах сопровождаются увеличением энтропии.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
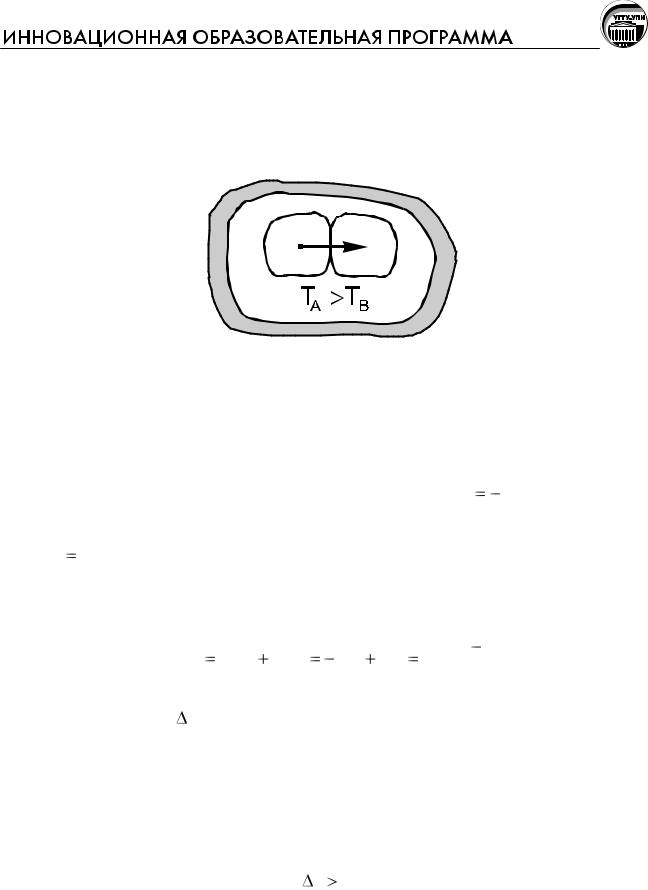
Это положение можно проиллюстрировать на частном примере – теплообмене в изолированной системе между соприкасающимися телами A и B, обладающими различной температурой (TA>TB).
Q
А В
Между веществами будет происходить необратимый процесс самопроизвольной передачи тепла от более нагретого вещества А к менее нагретому веществу В.
Для вещества А изменение энтропии составит |
SA |
|
Q |
, для вещества |
|||||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
TA |
||
В SB |
Q |
, знак минус перед величиной |
SA |
учитывает отвод тепла от |
|||||||||
|
|||||||||||||
|
TB |
|
|
|
|
|
|
|
|
|
|
|
|
вещества А. Общее изменение энтропии системы |
|
|
|
|
|
|
|||||||
|
|
S SA |
SB |
Q Q |
Q |
(TA |
TB ) |
. |
|||||
|
|
TA |
|
TB |
|
|
|
||||||
|
|
|
|
|
TATB |
||||||||
Так как TA>TB, S>0, энтропия увеличивается.
Изолированные системы не встречаются в природе. В лаборатории и промышленности большинство реакций проводят в закрытых системах, где система обменивается теплом с внешней средой. Условие самопроизвольного прохождения процесса в закрытых системах имеет вид:
T S Q .
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Изменение энтропии в ходе химической реакции в стандартных условиях
S0, может быть рассчитано, так же, как и для любой другой функции состояния, аналогично величине H0:
S0 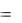 nпродS0прод
nпродS0прод  nисх.S0исх ,
nисх.S0исх ,
где S0исх, S0прод – стандартные энтропии исходных веществ и продуктов реакции; nпрод., nисх. - стехиометрические коэффициенты (коэффициенты в уравнении
химической реакции).
Энергия Гиббса. Термодинамическая возможность прохождения химической реакции
В соответствии со вторым началом термодинамики условие самопроизвольного прохождения химической реакции в закрытых системах
T S>Q. Ранее было показано, |
что для процессов, проходящих при постоянном |
|||||||||||||||||||
давлении, Qp = H. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Преобразуем неравенство при p,T = const: |
|
|
|
|
|
|
|
|
||||||||||||
|
T |
S > Qp, T |
S > |
H или |
H - T S<0. |
|||||||||||||||
При переходе системы из состояния 1 в состояние 2, согласно свойству |
||||||||||||||||||||
функций состояния |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H = H2 – H1, |
S = S2 – S1, |
|
|
|
|
|
|
т.е. (H2 – H1) – T(S2 – S1) < 0, |
||||||||||||
после перегруппировки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
(H2 – TS2) – (H1 – TS1) < 0. |
|||||||||||||||||
В термодинамике вводят еще одну функцию состояния системы, энергию |
||||||||||||||||||||
Гиббса, математически определяемую соотношением: |
||||||||||||||||||||
|
|
|
|
|
G |
H |
TS . |
|
|
|
|
|
|
|
|
|||||
Представляет интерес величина |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
G |
H T S при p,T |
const, |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель: |
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

используемая для оценки возможности самопроизвольного прохождения химических реакций в закрытых системах.
Таким образом, условие возможности самопроизвольного прохождения реакции в закрытой системе при р,Т = const имеет вид G<0. Процессы,
отвечающие этому условию, называют термодинамически возможными.
Величина G>0 соответствует термодинамически невозможным процессам.
Для обратимых химических процессов
G<0 реакция самопроизвольно идет в прямом направлении;
G>0 реакция идет в обратном направлении;
G=0 соответствует состоянию химического равновесия.
Особенности терминологии таковы, что величину G – изменение энергии Гиббса в ходе химической реакции, чаще называют энергией Гиббса химической реакции. Величина G зависит от природы и агрегатного состояния участвующих в реакции веществ, давления, температуры. Единицы измерения G - кДж/моль.
Следовательно, в закрытых системах осуществление химических реакций определяется совместным действием двух факторов: стремлением системы перейти в состояние с большей неупорядоченностью ( S>0) и с наименьшей внутренней энергией, с выделением ее части в форме теплоты ( H<0) или работы.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА НАПРАВЛЕНИЕ ХИМИЧЕСКОЙ РЕАКЦИИ
Проанализируем зависимость G f(T) . Для произвольной температуры
Т можно записать выражение
|
|
GT |
HT T ST , |
||||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в которое входят значения термодинамических функций при данной температуре, отмеченные подстрочным индексом «т». Если пренебречь зависимостями величин H и S от температуры, уравнение принимает вид
GT 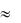 H T S
H T S
и является уравнением прямой в координатах (T  GT ) .
GT ) .
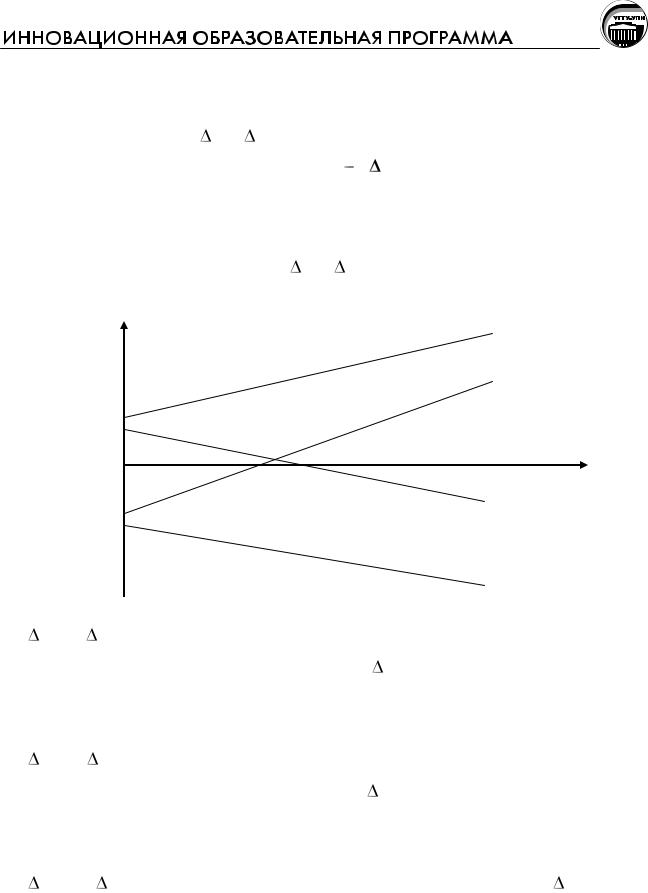
Возможны четыре варианта расположения прямой по отношению к осям координат в зависимости от знаков H и S.
3
∆G Т, кДж
1
Т, К
2
4
1.H<0, S<0. Экзотермические реакции, сопровождающиеся уменьшением энтропии, термодинамически возможны ( G<0) при низких температурах, при высоких температурах возможны обратные реакции.
Пример реакции: N2 + 3H2 = 2NH3.
2.H>0, S>0. Эндотермические реакции, сопровождающиеся увеличением энтропии, термодинамически возможны ( G<0) при высоких температурах, при низких температурах возможны обратные реакции.
Пример реакции: CaCO3 = CaO + CO2.
3.H>0, S<0. Во всем диапазоне температур значение G>0, т.е. эндотермические реакции, сопровождающиеся уменьшением энтропии, при
любых температурах термодинамически невозможны. Пример реакции: N2 + 2O2 = 2NO2.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

4. H<0, S>0. Во всем диапазоне температур значение G<0, т.е. экзотермические реакции, сопровождающиеся увеличением энтропии, при любых температурах термодинамически возможны.
Пример реакции: 2C + O2 = 2CO.
РАСЧЕТ СТАНДАРТНОЙ ЭНЕРГИИ ГИББСА ХИМИЧЕСКОЙ РЕАКЦИИ
В таблицах термодинамических величин приводят значения энергии Гиббса образования химических веществ в стандартных условиях ( G0 кДж/моль). Энергией Гиббса образования называют энергию Гиббса реакции образования одного моля данного вещества из простых веществ, устойчивых в стандартных условиях. Энергии Гиббса образования простых веществ равны нулю.
Стандартную энергию Гиббса реакции по справочным данным можно рассчитать двумя способами.
Способ 1 Стандартную энергию Гиббса химической реакции рассчитывают по стандартным энергиям Гиббса образования химических веществ:
G0 = Σ nпрод |
G0обр.прод - Σ n исх G0обр.исх , |
где . G0обр.исх, G0обр.прод – стандартные энергии Гиббса образования |
|
|
исходных веществ и продуктов реакции; |
nисх, nпрод - стехиометрические коэффициенты. |
|
Способ 2. Стандартную |
энергию Гиббса химической реакции |
рассчитывают, пользуясь значениями величин стандартных энтальпий образования H0обр и стандартных энтропий веществ S0.
По значениям энтальпий образования веществ рассчитывают
стандартную энтальпию реакции
|
H0 = Σ nпрод H0обр.прод - Σ nисх |
H0обр.исх, |
|||||||||||||||
по стандартным энтропиям веществ – стандартную энтропию |
|||||||||||||||||
|
|
S0 = Σ nпродS0прод - Σ nисхS0исх |
|||||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
Стандартную энергию Гиббса реакции находят подстановкой величин |
|||||||||||||
H0, S0 и Т=298К в уравнение |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
G0 = |
H0 - T S0. |
|
|
|
|
|||
|
Расчетное значение G0 позволяет сделать вывод о термодинамической |
|||||||||||||
возможности процесса в стандартных условиях. |
|
|
|
|
||||||||||
|
Пример. Оцените термодинамическую возможность прохождения |
|||||||||||||
реакции CaO(т) + CO2(г) = CaCO3(т) |
в стандартных условиях. |
|
|
|||||||||||
|
Решение. Из таблиц термодинамических величин: |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Вещество |
|
|
H0обр.298, |
|
|
S0298, |
|
|
G0обр 298, |
|
||
|
|
|
|
|
|
кДж/моль |
|
Дж/(моль.К) |
кДж/моль |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CaO(т) |
|
|
- 635,2 |
|
|
39,8 |
|
|
- 603,9 |
|
||
|
|
CO2(г) |
|
|
- 393,6 |
|
|
213,7 |
|
|
- 395,5 |
|
||
|
|
CaCO3(т) |
|
|
- 1207,1 |
|
|
92,9 |
|
|
- 1129,0 |
|
||
|
|
|
|
|
|
|
||||||||
Способ 1. Стандартная энергия Гиббса химической реакции |
G 0 : |
|||||||||||||
G0 |
|
GCaCO0 |
GCaO0 |
GCO0 |
|
1129,0 |
603,9 |
393,6 |
130,6 кДж . |
|||||
|
|
|
3 |
|
|
2 |
|
|
|
|
|
|
|
|
Способ 2. Стандартная энтальпия химической реакции |
Н0 : |
|||||||||||||
H0 |
HCaCO0 |
HCaO0 |
HCO0 |
|
1207,1 |
635,2 |
393,6 |
178,3 кДж. |
||||||
|
|
|
3 |
|
|
2 |
|
|
|
|
|
|
|
|
Стандартная энтропия химической реакции ΔS0 : |
|
|
|
|
||||||||||
S0 |
SCaCO0 |
SCaO0 |
SCO0 |
92,9 |
39,8 213,7 160,6 Дж/К. |
|||||||||
|
3 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
Значение стандартной энергии Гиббса данной реакции рассчитываем по |
|||||||||||||
формуле G0 |
H0 |
T S0 , подставляя в нее значения T |
298K , H0 и S0 с |
|||||||||||
учетом их размерностей: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G0 |
178,3 298( 160,6)10 3 |
|
130,5 кДж . |
|||||||||||||
G0 0 , в стандартных условиях реакция термодинамически возможна. |
|||||||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
