
1_Energetika_khim_protsessov
.pdf
ЛЕКЦИЯ 1
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ОСНОВЫ ТЕРМОХИМИИ
ПЛАН ЛЕКЦИИ
Основные понятия химической термодинамики.
Внутренняя энергия. Первое начало термодинамики.
Тепловые эффекты химических реакций. Энтальпия.
Основы термохимии. Термохимические уравнения.
Термохимические расчеты. Закон Гесса.
Химическая термодинамика – дисциплина, которая изучает: переходы энергии из одной формы в другую, от одной части системы к другой;
энергетические эффекты, сопровождающие различные химические и физические процессы; возможность и направление самопроизвольного протекания процессов.
ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Объектами изучения химической термодинамики являются разнообразные системы. Система – вещество или совокупность веществ,
находящихся во взаимодействии, реально или мысленно обособленных от внешней среды.
Фаза – совокупность всех однородных по составу и свойствам частей системы, отделенная от остальных частей системы поверхностью раздела.
Пример однофазной системы – лед; двухфазной – кипящая вода (жидкая и
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
газообразная фазы); трехфазной – насыщенный водный раствор соли
(кристаллическая соль, водный раствор соли и пары воды над раствором). Фаза может существовать в виде отдельных частей, но это не увеличивает число фаз в системе. Кусок льда и совокупность мелких кристаллов льда – это одна, а не несколько фаз.
Систему, состоящую из нескольких фаз, называют гетерогенной,
однофазную систему - гомогенной.
По характеру взаимодействия с внешней средой выделяют три типа
систем:
открытая – система, для которой возможен обмен веществом и энергией с внешней средой;
закрытая – система, для которой исключен обмен веществом и возможен обмен энергией с внешней средой;
изолированная – система, для которой исключен обмен веществом с внешней средой.
В природе не существуют изолированные системы. В науке используют воображаемые изолированные системы для различных теоретических построений. Примером закрытой системы является запаянный сосуд с взаимодействующими веществами. Примеры открытых систем – сосуд с
кипящей водой, горящая спичка и т.п.
Состояние системы - совокупность химических и физических свойств,
характеризующих систему. Для описания систем используются параметры
состояния:
давление p,
объем V,
температура T,
концентрация С.
Взаимосвязь между параметрами системы называют уравнением состояния:
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

f(p, V, T, С) 0.
Конкретный вид уравнения состояния известен лишь для некоторых относительно простых систем. В частности, уравнением состояния идеального газа является уравнение Клапейрона-Менделеева
pV Mm RT,
где - m - масса,
M - молярная масса,
R - универсальная газовая постоянная.
Вид уравнения состояния большинства систем неизвестен, поэтому для описания термодинамических свойств систем введены функции состояния:
U – внутренняя энергия,
H – энтальпия,
S – энтропия,
 G – энергия Гиббса. Свойства функций состояния:
G – энергия Гиббса. Свойства функций состояния:
численные значения однозначно определяются составом системы и ее параметрами;
изменение при переходе системы из одного состояния в другое не зависит от пути перехода и может быть найдено как разность конечного и начального значений функций.
ВНУТРЕННЯЯ ЭНЕРГИЯ. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Внутренняя энергия (U) – сумма кинетической энергии движения и потенциальной энергии взаимодействия структурных единиц (молекул, атомов, ядер, электронов и др.) в системе. Во внутреннюю энергию системы не входят кинетическая энергия системы в целом и потенциальная энергия, обусловленная воздействием внешних полей. При термодинамическом подходе
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

к описанию состояния систем предполагают, что полная энергия системы определяется запасом ее внутренней энергии.
Внутренняя энергия системы зависит от ее природы, агрегатного состояния и массы образующих систему веществ, температуры. Единицы измерения – кДж.
Определение абсолютного значения внутренней энергии системы невозможно, так как невозможен количественный учет всех составляющих. В ходе химических реакций происходит изменение внутренней энергии системы. Его можно определить, пользуясь одной из частных формулировок закона сохранения энергии – первым началом термодинамики.
Изменение внутренней энергии закрытой системы определяется количеством переданной теплоты и совершенной работой. Соответствующее математическое выражение имеет вид:
U Q A ,
где Q – количество переданной теплоты;
A – совершенная работа.
Величина А представляет сумму всех видов работы системы против внешних сил (внешнего давления, электрических или магнитных полей и т. д.).
Работу, совершаемую системой над внешней средой, считают положительной, а совершаемую над системой – отрицательной. Теплоту,
полученную системой, считают положительной, а отданную системой во внешнюю среду – отрицательной.
|
|
-А |
|
|
|
|
|
|
|
+А |
|
|
|
|
|
|
Система |
+Q |
Внешняя |
|
|
|
|
|
|
среда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-Q |
|
|
|
|
|
Исполнитель: |
Дата: |
|
Мероприятие № |
4 |
2 |
7 |
1 |

Теплота и работа не являются функциями состояния – они зависят от пути процесса.
ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ. ЭНТАЛЬПИЯ
В ходе химической реакции за счет изменения внутренней энергии может выделяться или поглощаться теплота и совершаться работа.
Количество теплоты, которое выделяется или поглощается в результате химической реакции, называют ее тепловым эффектом. Единицы измерения тепловых эффектов – кДж
В соответствии с первым началом термодинамики
Q 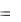 U A.
U A.
В большинстве химических реакций единственным видом работы, которая совершается системой, является работа расширения
A p V ,
где ∆V – изменение объема системы.
Тогда
Q 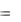 U p V.
U p V.
Для процессов, протекающих при постоянном объеме (изохорных)
Ар V 0 ,
QV  U.
U.
Тепловой эффект реакции при постоянном объеме (QV) равен изменению внутренней энергии системы.
Для процессов, протекающих при постоянном давлении (изобарных)
Qр  U p V.
U p V.
Условно будем считать, что при химической реакции система переходит
из исходного состояния 1 в конечное состояние 2, тогда
|
U=U2 - U1, |
|
|
|
|
V = V2 – V1, |
|||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Qp (U2 U1) (V2 V1) (U2 pV2 ) (U1 pV1)
В термодинамике введена функция состояния H – энтальпия, связанная с внутренней энергией и параметрами системы соотношением
H U pV .
Приведенное математическое выражение является математическим определением энтальпии.
Таким образом,
Qp H2 H1 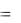 H .
H .
Тепловой эффект реакции при постоянном давлении (Qp,) равен изменению энтальпии.
Большинство химических реакций проходит в условиях постоянства
давления, тепловые эффекты выражают величиной H, которую называют энтальпией химической реакции.
ОСНОВЫ ТЕРМОХИМИИ. ТЕРМОХИМИЧЕСКИЕ УРАВНЕНИЯ
Термохимия – раздел химической термодинамики, изучающий |
тепловые |
эффекты химических реакций. Для практики наибольший |
интерес |
представляют расчеты энтальпий химических реакций.
В соответствии с тепловыми эффектами реакции можно разделить на две
группы: |
|
|
экзотермические – идут с выделением теплоты ( H |
0); |
|
эндотермические – идут с поглощением теплоты ( |
H |
0). |
Уравнения химических реакций, записанные |
с |
указанием значения |
энтальпии H (кДж) и агрегатного состояния участвующих в реакции веществ,
называют термохимическими уравнениями. Агрегатные состояния веществ обозначают подстрочными индексами: т – твердое или к – кристаллическое, ж – жидкое, г – газообразное, р – раствор.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Значение H зависит от природы и агрегатного состояния веществ,
участвующих в реакции, температуры, давления. Энтальпии большинства реакций при изменении температуры в пределах, меняются незначительно. Например, энтальпия реакции окисления графита
C(к) + СO2(г) = 2CO(г)
при увеличении температуры с 500 до 1500 К изменяется на 5%, а реакции окисления азота
N2(г) + O2(г) = 2NO(г)
при повышении температуры с 298 до 4000 К - на 2,2%. Влияние давления на энтальпии большинства реакций также невелико: например, при увеличении давления с 105 до 5.107 Па энтальпия реакции синтеза аммиака
N2(г) + 3H2(г) = 2NH3(г)
изменяется на 5%.
Как правило, значение энтальпии химической реакции указывают для стандартных условий.
Стандартные условия означают, что все участвующие в реакции вещества чистые, парциальные давления газов или атмосферное давление, если газы не участвуют в реакции, равно 1,013 105 Па, концентрации частиц для реакций в растворах равны 1 моль/л, температура 298 К.
Существует также понятие стандартное состояние вещества, которое отличается тем, что не включает температуру 298 К. Термодинамические величины, определенные для стандартного состояния вещества, отмечают в обозначении надстрочным индексом “0”, а для стандартных условий дополнительно указывают подстрочный индекс стандартной температуры:
например, H0298. Для упрощения обозначений в дальнейшем индекс температуры 298К в обозначении стандартных величин записывать не будем,
т.е. обозначение H0 соответствует энтальпии реакции в стандартных условиях.
Примеры термохимических уравнений:
CaCO3(к) = CaO(к) + CO2(г), H0 = 178 кДж (эндотермическая реакция);
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

N2(г) + 3H2(г) = 2NH3(г), H0 = - 92 кДж (экзотермическая реакция).
Значения энтальпий соответствуют количествам веществ в уравнениях реакций. Термохимическое уравнение реакции синтеза аммиака означает, что при взаимодействии 1 моль газообразного азота и 3 моль газообразного водорода в стандартных условиях выделяется 92 кДж теплоты. Можно также утверждать, что при получении 2 моль аммиака из простых веществ в стандартных условиях выделяется 92 кДж теплоты.
В справочных таблицах термодинамических величин приводят не энтальпии конкретных реакций, а стандартные энтальпии образования веществ.
Энтальпией образования называют энтальпию реакции образования одного моля данного вещества из простых веществ, устойчивых в стандартных условиях. Из определения следует, что энтальпии образования простых веществ равны нулю. В обозначении энтальпии образования вещества, как правило, указывают его формулу, например, H0обрNH 3 (г) . В дальнейшем
подстрочный индекс “обр”, как правило, записывать не будем: H0обрNH 3 (г) .
С термохимическими уравнениями можно проводить простейшие математические процедуры: складывать, вычитать, умножать или делить на какое-либо число. Разделим уравнение реакции синтеза аммиака на два, чтобы оно соответствовало реакции образования 1 моль аммиака:
1/2N2(г) + 3/2H2(г) = NH3(г), H0 = - 46 кДж/моль = H0обр NH 3 (г)
Согласно закону Лавуазье – Лапласа (1784 г.) энтальпия образования химического соединения равна по абсолютной величине и противоположна по знаку энтальпии его разложения. Вещества, характеризующиеся положительными значениями энтальпий образования, т.е. образующиеся в результате эндотермической реакции, неустойчивы, их разложение сопровождается выделением тепла.
Пример – фосфин PH3 ( H0PH 3 (г) = 13 кДж/моль).
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

В термохимии также существует понятие энтальпии сгорания веществ.
Энтальпией сгорания называют энтальпию реакции сгорания в кислороде одного моля данного вещества с образованием высших оксидов составляющих его элементов. Из определения следует, что энтальпии сгорания высших
оксидов равны нулю. |
|
|
|
|
|
|||
Например, для реакции окисления этанола |
|
|
|
|||||
|
|
|
С2H5OH(ж) + 3O2(г) = 2СО2(г) + 3H2O(г), |
H0 = - 1235,2 кДж, |
|
|||
энтальпия |
реакции |
равна |
энтальпии |
сгорания |
этанола, |
т.е. |
||
HсгС0 |
H |
OH |
-1235,2 кДж. |
|
|
|
|
|
2 |
5 |
|
|
|
|
|
|
|
Для характеристики топлив используют удельную теплоту сгорания QT (теплотворную способность топлива), которая равна количеству теплоты, выделяющейся при сгорании 1 кг жидкого или твердого вещества и 1 м3 газообразного вещества до образования высших оксидов.
QT |
Hсг1000/М , кДж, |
или для газообразных веществ |
|
QT |
Hсг1000/22,4 , кДж, |
где М - молярная масса вещества, г/моль; 22,4 – молярный объем газа, л/моль.
Используя справочные значения энтальпий образования веществ, можно рассчитать энтальпию любой химической реакции. Основой таких расчетов служит закон Гесса.
ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ. ЗАКОН ГЕССА
Основной закон термохимии сформулирован Г. И. Гессом (1840 г.):
энтальпии реакций, протекающих при постоянном давлении или при постоянном объеме, не зависят от пути протекания процесса (то есть от
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

характера и числа промежуточных стадий), а определяются лишь начальным и конечным состояниями системы.
Таким образом, для двух практически важных процессов – изохорного и изобарного теплота приобретает свойства функции состояния. Закон Гесса
является следствием первого начала термодинамики.
Проиллюстрировать закон Гесса можно на примере реакции образования
оксида железа (III): |
|
|
|
|
2Fe(к) + 3/2O2(г) = Fe2O3(к), |
Н0 |
821кДж . |
||
|
|
|
1 |
|
Эта же реакция может осуществляться другим путем, с образованием |
||||
промежуточного продукта – оксида железа (II): |
|
|||
2Fe(к) + O2(г) = 2FeO(к), |
|
Н02 |
527 кДж ; |
|
2FeO(к) + 1/2O2(г) = Fe2O3(к), |
Н30 |
294 кДж . |
|
|
Схема химических реакций: |
|
|
|
|
|
|
Н0 |
|
|
|
|
1 |
|
|
Fe(к) |
|
|
|
Fe2O3(к) |
Н02 |
|
|
Н30 |
|
|
|
FeO(к) |
|
|
Н0 |
Н0 |
Н0 |
527 294 |
821кДж . |
1 |
2 |
3 |
|
|
Как видно, энтальпия |
реакции, |
протекающей по разным путям, |
||
одинакова.
Закон Гесса хорошо иллюстрируется с помощью энтальпийных диаграмм. На диаграмме уровни энтальпии, соответствующие исходным и конечным веществам, изображают в виде горизонтальных отрезков прямой.
Стрелками указывают направления энергетических переходов в ходе реакции.
Разность конечного и начального уровней энергии системы составляет
значение энтальпии реакции.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
