
- •Патологическая физиология
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 695
- •Глава 12. Патологическая физиология 1237
- •.Краткие сведения об истории патологической физиологии
- •Экспериментально-физиологическое, физико-химическое направление
- •.Часть первая общая нозология
- •Глава 1. Общее учение о болезни
- •1.1. Здоровье и болезнь
- •1.1.1. Норма и здоровье
- •1.1.2. Определение сущности болезни
- •1.1.3. Патологическая реакция, патологический процесс, патологическое состояние
- •1.2. Общие вопросы учения об этиологии болезней
- •1.3. Общие вопросы учения о патогенезе болезней
- •1.4. Исходы болезни
- •На повреждение
- •2.1. Общая патология клетки
- •2.1.1. Повреждение клеток в патологии
- •2.1.2. Нарушение функций клеточных структур
- •Кусочки ткани Выделенные митохондрии
- •Время переживания органа при 24°с (мин)
- •2.1.3. Механизмы нарушения барьерной функции биологических мембран
- •СюТоксическое действие
- •Токсическое действие
- •2.1.4. Другие причины нарушения барьерных свойств липидного слоя мембран
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 705
- •Глава 12. Патологическая физиология 1247
- •2.1.5. Нарушение электрической стабильности липидного слоя
- •2.2. Общие реакции организма на повреждение
- •2.2.1. Общий адаптационный синдром (стресс)
- •2.2.2. Активация протеолитических систем плазмы крови
- •I Фактор Хагемана Калликреин j I Прекалликреин
- •2.2.4. Кома
- •2.2.5. Ответ острой фазы
- •2.2.5.2. Главные медиаторы ответа острой фазы
- •3.1. Реактивность организма
- •3.2. Виды реактивности
- •3.5. Резистентность
- •3.6. Факторы, влияющие на реактивность
- •3.7. Роль наследственности
- •Гидрооксифенил виноградная кислота
- •Фенилпиро- виноградная кислота
- •Гомоге нти зи н о вая кислота
- •Гомогентизиноксидаза (алкаптонурия)
- •4.1. Основные представления о строении
- •4.2. Общая стратегия иммунной защиты
- •4.3. Иммунодефицитные состояния
- •4.3.1. Первичные иммунодефициты
- •4.3.2. Вторичные иммунодефициты
- •4.4. Аутоиммунные процессы
- •4.5. Лимфопролиферативные процессы
- •5.1. Взаимоотношение аллергии и иммунитета
- •5.3. Специфические аллергические реакции
- •5.3.1. Аллергические реакции I типа (анафилактические)
- •5.3.2. Аллергические реакции II типа
- •5.3.3. Аллергические реакции III типа
- •5.3.4. Аллергические реакции IV типа
- •Характеристика повышенной чувствительности немедленного и замедленного типов
- •5.4. Атопия. Атонические и псевдоатопические заболевания
- •5.4.1. Механизмы развития
- •5.4.2. Механизмы обратимой обструкции дыхательных путей
- •5.5. Псевдоаллергия
- •5.5.1. Гистаминовый тип псевдоаллергии
- •5.5.2. Нарушение активации системы комплемента
- •5.5.3. Нарушения метаболизма арахидоновой кислоты
- •Глава 6. Патологическая физиология периферического (органного) кровообращения и микроциркуляции
- •Состояние кровотока в микрососудах при артериальной гиперемии, ишемии, капиллярном стазе и венозном застое крови,
- •Признаки расстройства периферического кровообращения (в.В. Воронин, модификация г.И. Мчедлишвили)
- •6.1. Артериальная гиперемия
- •6.3. Нарушение реологических свойств крови, вызывающее стаз в микрососудах
- •6.4. Венозный застой крови
- •Превалирование резорбция вал фильтрацией я оды а микрооо- суддк мозга
- •6.6. Кровоизлияние в мозг
- •7.1. Нарушение микроциркуляции
- •7.2. Воспалительные экссудаты
- •7.3. Эмиграция лейкоцитов периферической крови
- •7.4. Фагоцитоз
- •7.5. Специализированные функции нейтрофилов, моноцитов
- •7.6. Медиаторы воспаления
- •7.7. Исходы воспаления
- •8.1. Этиология
- •8.3. Функция органов и систем
- •9.1. Нарушение обмена белков
- •9.1.1. Нарушение расщепления и всасывания белков
- •9.1.4. Патология межуточного обмена белков (нарушение обмена аминокислот)
- •9.1.5. Изменение скорости распада белка
- •9.1.6. Патология конечного этапа обмена белков
- •9.2. Нарушение обмена липидов
- •9.2.1. Нарушение транспорта липидов и перехода их в ткани
- •9.2.2. Роль нарушений липидного обмена в патогенезе атеросклероза
- •9.2.3. Жировая инфильтрация и жировая дистрофия
- •9.3. Нарушение обмена углеводов
- •9.3.3. Нарушение регуляции углеводного обмена
- •9.4. Нарушение водного баланса
- •9.4.1. Основы регуляции водного баланса
- •9.4.2. Формы нарушения водного баланса
- •9.4.2.1. Увеличение объема внеклеточной жидкости (гиперволемия)
- •9.4.2.2. Уменьшение объема внеклеточной жидкости (гиповолемия)
- •9.5. Нарушение электролитного баланса
- •Организма человека
- •9.5.1. Нарушение баланса натрия
- •9.5.2. Нарушение баланса калия
- •9.5.3. Нарушение баланса кальция
- •9.5.4. Нарушение баланса фосфатов
- •9.5.5. Нарушение баланса магния
- •9.6. Нарушение кислотно-основного баланса
- •9.6.1. Основы регуляции кислотно-основного баланса
- •0A* й к * 5 сз" 5 неш Лшкжы Анионы КаикшыКат ионы
- •9.6.2. Основные показатели коб
- •9.6.3. Формы нарушения кислотно-основного баланса
- •9.6.3.1. Респираторный ацидоз
- •9.6.3.2. Метаболический ацидоз
- •9.6.3.3. Респираторный алкалоз
- •9.6.3.4. Метаболический алкалоз
- •9.6.3.5. Смешанные нарушения кислотно-основного баланса
- •10.2. Компенсаторно-приспособительные реакции при гипоксии
- •10.3. Нарушение обмена веществ
- •10.4. Коррекция гипоксии: необходим избыток или недостаток кислорода?
- •11.1. Механизмы клеточного деления
- •11 »2. Патофизиология клеточного деления
- •11.2.1. Активация онкогенов
- •11.2.2. Инактивация генов-супрессоров
- •11.2.3. Нарушение апоптоза
- •11.2.4. Нарушение механизмов репарации днк
- •11.3. Опухолевый рост
- •11.3.2. Этиология опухолей
- •11.3.3. Свойства опухолевых клеток in vitro
- •11.3.4. Межклеточная кооперация
- •11.3.5. Свойства злокачественных опухолей
- •11.3.6. Взаимоотношения опухоли и организма
- •11.3.7. Механизмы резистентности опухолей к терапевтическим воздействиям
- •.Часть третья нарушение функций органов и систем
- •Глава 12. Патологическая физиология нервной системы
- •12.1. Общие реакции нервной системы на повреждение
- •12.2. Нарушение функции нервной системы,
- •12.3. Метаболические энцефалопатии
- •12.4. Повреждение мозга,
- •12.5. Расстройства функций нервной системы, обусловленные повреждением миелина
- •12.6. Нарушение нервных механизмов управления движениями
- •12.6.1. Расстройства движений,
- •12.6.1.1. Болезни моторных единиц
- •12.6.1.2. Расстройства движений
- •12.6.1.3. Нарушение движений при повреждении мозжечка
- •12.6.1.4. Нарушение движений
- •13.1. Нарушение механизмов регуляции артериального давления
- •13.2. Расстройства функций мочевого пузыря
- •13.5. Вегетативные расстройства,
- •15.1. Нарушение центральных механизмов регуляции
- •15.2. Патологические процессы в железах
- •15.3. Периферические (внежелезистые) механизмы нарушения активности гормонов
- •15.4. Роль аутоаллергических (аутоиммунных) механизмов в развитии эндокринных нарушений
- •1]ДиОТипиЧесИиЕ ahtuteaa
- •16.1. Нарушение функций гипофиза
- •16.1.1. Недостаточность функции гипофиза
- •16.1.2. Гиперфункция передней доли гипофиза
- •16.2. Нарушение функций надпочечников
- •16.2.1. Кортикостероидная недостаточность
- •16.2.2. Гиперкортикостероидизм
- •16.2.3. Гиперфункция мозгового слоя надпочечников
- •16.3. Нарушение функций щитовидной железы
- •16.3.1. Гипертиреоз
- •16.3.2. Гипотиреоз
- •16.4. Нарушение функций околощитовидных желез
- •16.5. Нарушение функций половых желез
- •17.1. Краткие сведения
- •17.2. Атеросклероз
- •17.2.1. Теории происхождения
- •17.2.2. Регресс атеросклероза
- •17.3. Нарушение коронарного кровотока
- •17.3.1. Ишемия миокарда
- •17.3.2. Оглушенный и бездействующий миокард
- •17.4.Артериальная гипертензия
- •Гипертоническая болезнь!
- •17.4.1. Патогенез гипертонической болезни
- •17.4.2. Вторичная артериальная гипертензия
- •17.6. Механизмы развития сердечной недостаточности
- •17.6.2. Диастолическая форма сердечной недостаточности
- •17.7. Механизмы развития аритмий
- •17.7.1. Нарушение образования импульсов
- •17,7,2, Риэнтри
- •17.7.3. Нарушение проводимости
- •Внешнего дыхания
- •18.1. Определение понятия «дыхательная недостаточность»
- •18.2. Оценка функций внешнего дыхания придыхательной недостаточности
- •18.3. Патофизиологические варианты дыхательной недостаточности
- •18.3.1. Центрогенная дыхательная недостаточность
- •18.3.2. Нервно-мышечная дыхательная недостаточность
- •18.3.3. «Каркасная» дыхательная недостаточность
- •18.3.4. Механизмы дыхательной недостаточности при патологии дыхательных путей
- •18.3.5. Паренхиматозная дыхательная недостаточность
- •18.4. Показатели газового состава крови при дыхательной недостаточности
- •18.4.1. Гипоксемическая (I типа) дыхательная недостаточность
- •18.4.2. Гиперкапнически-гипоксемический (вентиляционный) тип дыхательной недостаточности
- •19.1. Основы регуляции клеточного цикла
- •19.2. Патология красной крови
- •19.2.1. Анемии
- •19.2.2. Эритроцитозы
- •19.4. Патология белой крови
- •19.4.1. Лейкоцитопении
- •19.4.2. Лейкоцитоз
- •19.5. Лейкозы (гемобластозы, лейкемии)
- •20.1. Факторы, свертывающие кровь
- •VIll/vWf I
- •20.2. Геморрагические синдромы
- •20.4. Синдром диссеминированного
- •20.5. Методы оценки нарушений системы гемокоагуляции
- •21.1. Нарушение лимфообразования
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 705
- •Глава 12. Патологическая физиология 1247
- •21.2. Недостаточность транспорта лимфы
- •21.3. Нарушение свертывания лимфы
- •21.4. Роль лимфатической системы в развитии отека
- •21.5. Функции лимфатической системы при развитии воспаления
- •22.1. Нарушение функций пищевода
- •22.2. Нарушение функций желудка
- •22.2.1. Нарушения секреции соляной кислоты и пепсина
- •22.2.2. Нарушение слизеобразующей функции желудка
- •22.2.3. Патофизиологические механизмы язвенной болезни
- •22.2.4. Нарушение двигательной функции желудка
- •22.3. Патофизиологические механизмы болей в животе
- •22.4. Нарушение экзокринной функции поджелудочной железы
- •22.4.1. Патофизиологические механизмы развития острого панкреатита
- •22.4.2. Патофизиологические механизмы развития хронического панкреатита
- •22.5. Нарушение функций кишечника
- •22.5.1. Нарушение переваривания и всасывания в кишечнике
- •22.5.2. Нарушения двигательной функции кишечника
- •23.1. Печеночно-клеточная недостаточность
- •23.2. Патофизиологические механизмы синдрома портальной гипертензии
- •23.3. Патофизиологические механизмы желтухи
- •24.1. Нарушение клубочковой фильтрации
- •24.2. Нарушение функций канальцев
- •24.3. Изменение состава мочи
- •24.4. Нефротический синдром
- •24.5. Острая почечная недостаточность
- •24.6. Хроническая почечная недостаточность
- •24.7. Мочекаменная болезнь
24.6. Хроническая почечная недостаточность
Хроническая почечная недостаточность (ХПН) — синдром, развивающийся вследствие постепенного снижения функций почек, обусловленного прогрессирующей гибелью нефронов. ХПН — в большинстве случаев необратимый процесс.
Термин «уремия» обычно используют для обозначения конечной стадии ХПН, когда определяется комплекс биохимических и патофизиологических расстройств и особенно выражены клинические проявления «уремического отравления».
Причины ХПН. Хроническая почечная недостаточность — исход многих болезней почек, чаще исход гломерулонефрита; к ХПН могут привести интерстИциальные болезни почек, урологическая патология, поли- кистоз почек, амилоидоз и диабетическая нефропатия, стеноз почечной артерии, системные болезни и др. В последние годы отмечено учащение ХПН как исхода токсического воздействия лекарств.
Стадии ХПН. При медленном прогрессировании ХПН целесообразно выделить три стадии, которые в определенной степени отражают тяжесть расстройств функций почек. Первая стадия характеризуется падением скорости клубочковой фильтрации до 50 % от нормы, т.е. клиренс креатинина составляет 50—60 мл/мин. В этот период у пациентов сохраняется способность поддерживать жизненно важные функции — выделять воду, органические вещества без существенного изменения диеты. При уменьшении массы нефронов и снижении скорости клубочковой фильтрации в крови прежде всего накапливаются соединения, баланс которых поддерживается уровнем клубочковой фильтрации — т.е. азотистые шла- ки, креатиНин и(в меньшей степени) мочевина. На ранних стадиях ХПН отмечают нерезкое увеличение этих веществ в крови. Возможно эпизодическое повышение их концентрации при воздействии некоторых отягощающих факторов (инфекция, кровотечение или потеря жидкости).
Первую стадию ХПН обозначают как стадию снижения почечного резерва, т.е. стадией снижения способности к максимально достигаемому уровню клубочковой фильтрации.
Вторая стадия соответствует снижению СКФ на 75 % от нормы или клиренсу креатинина 20—30 мл/мин. В этот период содержание азотистых шлаков в крови значительно увеличивается. Однако при стабилизации СКФ на уровне 25 мл/мин не всегда регистрируют признаки нарушенного гомеостаза и могут наблюдаться периоды кратковременного снижения концентрации азотистых шлаков. Нарастание тяжести ХПН (снижение СКФ до 10—15 мл/мин) сопровождается высокой азотемией, расстройством водно-электролитногобаланса, нарушением концентрирования мочи, гиперволемией, гиперкальциемией, гиперфосфатемией и развитием метаболического ацидоза.
Дальнейшее прогрессирование ХПН приводит к третьей стадии или стадии уремии, когда клиренс креатинина падает ниже 15 мл/мин, выражены высокая трудно корректируемая азотемия, расстройство функций многих органов и систем.
Темпы прогрессирования ХПН зависят от характера основного заболевания, адекватности лечения и состояния индивидуальных адаптационных механизмов, оценка которых сопряжена с определенными трудностями. Например, отмечены возможность многолетнего сохранения гомеостаза при ХПН и проявление выраженных расстройств лишь в терминальную стадию болезни; в то же время описано развитие анемии на ранних стадиях ХПН.
Адаптация нефронов к снижению функции почек. Изменение функций почек при ХПН определяется соотношением областей сохранившихся нефронов и областей нефункционирующих нефронов.
Гиперфункция остаточных нефронов и сохранение согласованности функций клубочков и канальцев (гломерулярно-тубулярный баланс) ответственны за сохранение гомеостаза в течение определенного периода при ХПН.
Скорость клубочковой фильтрации. Характер патологического процесса, обусловившего ХПН, может влиять на степень вовлечения гло- мерул и темпы прогрессирования ХПН. Например, если уменьшить массу почечной ткани нефрэктомией, скорость клубочковой фильтрации в каждом из оставшихся нефронов повышается в 2—3 раза. При патологических процессах, вызвавших распространенное поражение гломеруляр- ного аппарата (например, гломерулонефрит), скорость клубочковой фильтрации в остаточных нефронах будет разной, и зависит от степени вовлечения гломерул: в сохраненных или минимально пораженных гло- мерулах СКФ повышается, в то время как в других — более пораженных, уменьшается или сохраняется на нормальном уровне.
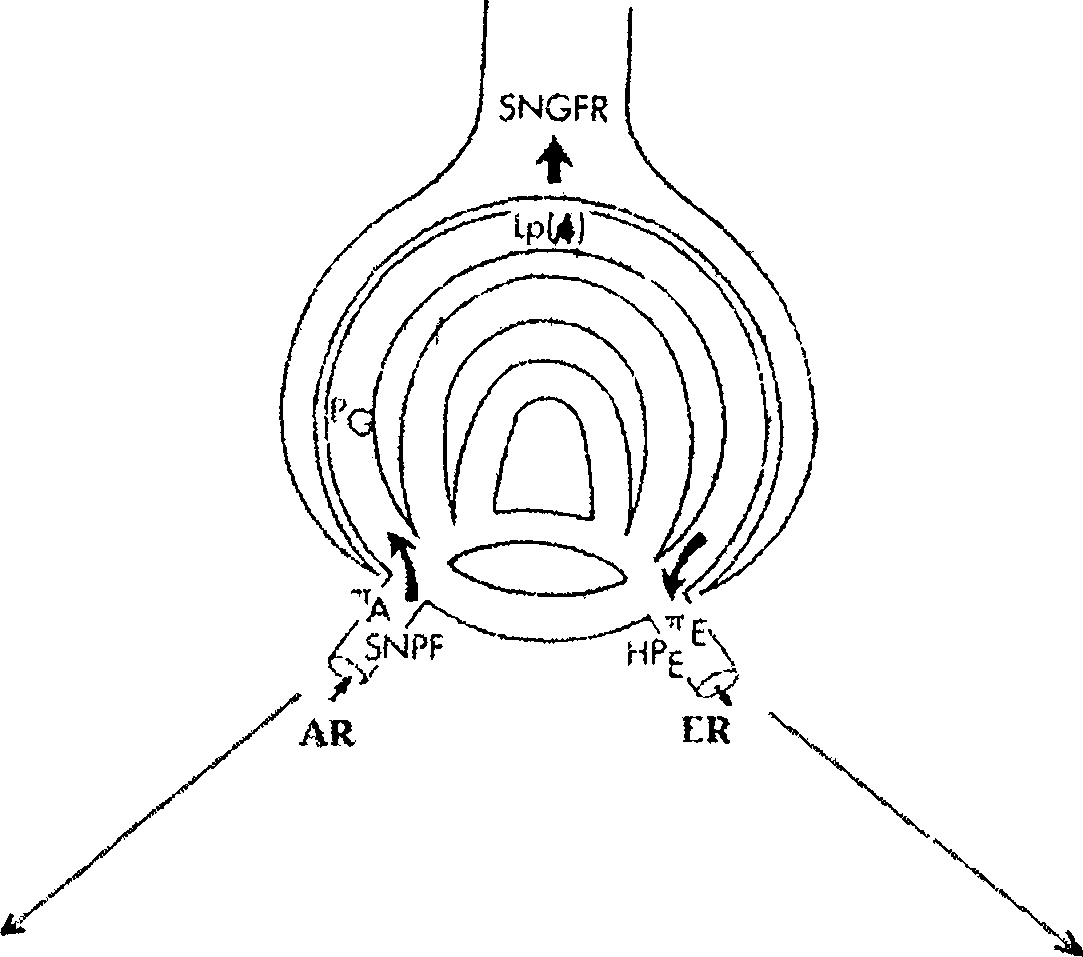
Компенсаторное увеличение СКФ в остаточных нефронах обусловливается влиянием нескольких факторов (рис. 24.2) — повышением плаз- мотока в клубочках вследствие дилатации афферентной артериолы, увеличением внутригломерулярного давления при наличии дилатации афферентной артериолы и одновременной констрикции эфферентной артериолы и наряду с этим увеличением коэффициента ультрафильтрации, связанного (предположительно) с адаптивной гипертрофией клубочков, увеличивающих фильтрующую поверхность или с увеличением гидравлической проводимости капилляров остаточных гипертрофированных нефронов.
Положительный эффект адаптационного повышения СКФ в остаточных нефронах проявляется увеличением клиренсатоксичныхх веществ. Однако, как свидетельствуют экспериментальные и клинические данные, ги- перфильтрация остаточных нефронов может привести к усилению склеротических процессов в почках и, в свою очередь, способствовать прогрессированиюХПН.
Данные по этой проблеме противоречивы, и предстоит выяснить, каков должен быть характер адаптационных механизмов нефрона, обеспечивающих длительное сохранение гомеостаза.
При ХПН наблюдается интенсификация «работы» канальцев почек, однако функция канальцев зависит от уровня СКФ в остаточных нефро
-
I
SNGFR i SNPF t AR f ER t ДР
Xor
44
LPA
t
SNGFR t SNPF iAR
=
ER
t
ДР
-or
I
LPA
А Б*
Нис. 24.2. Ультрафильтрация при уменьшении массы нефронов (А)
и при гломерулонефрите (Б). Скорость клубочковой фильтрации в отдельном нефроне (SNGFR) определяется показателями: скоростью плазмотока в отдельном нефроне (SNPF), градиентом гидростатического давления в гломерулах(ДР), системнымонкотическим давлением (яА, яЕ), коэффициентом ультрафильтрации (LPA), который зависит от эффективной площади гломерулярных капилляров и общей гидравлический проводимости стенок гломеруляр- ных капилляров. Скорость плазмотока в отдельном нефроне определяется резистентностью афферентной артериолы (AR) и резистентностью эфферентной артериолы (ЕЙ); гидростатическим давлением в гломерулярных капиллярах (PG) и гидростатическим давлением в эфферентной артериоле (НРЕ) [Модифицированная схема по R.C. Blantz, F.B. Gabbai: The Principles and Practice of
Nephrology / Ред. И. Jacobson et al. — Mosby, 1995.
нах. Частично клубочково-канальцевый баланс достигается физическими силами перитубулярных капилляров, действующих на уровне эпителия проксимальных канальцев, уменьшение или увеличение реабсорбции связано с сопутствующим изменением СКФ в соответствующих остаточных не- фронах.
Механизмы, мобилизующие адаптивные функции канальцев, не ясны. Полагают, что некоторые из них связаны с влиянием гуморальных факторов, например, усилением секреции альдостерона (усиление выведения камня) или увеличением высвобождения паратгормона (ингиби- ция реабсорбции фосфатов).
При нарастании тяжести ХПН нарушается функция концентрирования и разведения мочи, хотя не меняется способность к модуляции сек
реции АДГ. Нарушение концентрационных способностей почек связано с дезорганизацией мозгового слоя почки и расстройством функции проти- воточной множительной системы концентрирования мочи, и наряду с этим с развитием осмотического диуреза в остаточных нефронах, обусловленного увеличением фильтруемой нагрузки мочевиной и падением канальцевой реабсорбции натрия и воды. По мере нарастания концентрации растворенных веществ в канальцевой жидкости осмолярность выделяемой мочи увеличивается в разведенной моче и уменьшается в концентрированной моче, и в результате осмолярность мочи становится равной таковой в плазме лишенной белка (1008—1010), т.е. развивается изостенурия.
В этих условиях адекватность экскреции растворенных веществ зависит от объема экскреции воды. Если пациент потребляет меньше воды, чем это необходимо для обеспечения скорости движения воды, у него развивается дегидратация и гипернатриемия. Если пациент потребляет больше воды, чем требуется для адекватного выведения растворенных веществ, у пациента развивается водная «интоксикация» и гипон&триемия.
Баланс натрия при ХПН. Уменьшение массы функционирующих нефронов, гиперперфузия остаточных нефронов и потребность к чрезмерной мобилизации резервных возможностей почек при ХПН приводят к снижению адаптации канальцев к нагрузке натрием, и, таким образом, снижению способности почек экскретировать солевую нагрузку.
Если потребление солей превышает способность канальцев экскретировать натрий, содержание натрия в плазме повышается и развивается синдром гиперволемии. В то же время при ХПН нарушается способность сохранять натрий и резкое ограничение потребления натрия может вызвать гиповолемию и падение артериального давления. При далеко зашедшей стадии ХПН реабсорбция натрия подавлена постоянно, поскольку в этих условиях менее выражена восприимчивость систем транспорта натрия к колебаниям концентрации натрия в просвете канальцев.
Гиперкалиемия при ХПН. При падении функции почек для увеличения экскреции калия необходимо усиление процесса секреции калия канальцами остаточных нефронов. Это достигается повышением мине- ралокортикоидной активности.
Концентрация калия в плазме может сохраняться при ХПН на нормальном уровне достаточно длительный период, однако гиперкалиемия может возникнуть внезапно, если нарушается механизм экскреции калия дистальными канальцами в связи с уменьшением скорости мочеотделения или нарушением достатки натрия.
Гиперкалиемия при ХПН мбжет быть вызвана бесконтрольным приемом калийсберегающих диуретиков, ингибиторов ангиотензинпревра- щающего фермента, (32-блокаторов, нестероидных противовоспалительных препаратов.
При снижении СКФ до 40 мл/мин нарушается экскреция аммония, что способствует задержке ионов водорода и развитию хронического метаболического ацидоза.Концентрация бикарбонатов в сыворотке редко падает ниже 12 мэкв/ л, благодаря буферной способности костных тканей. Соотношение анионов изменяется в сторону увеличения концентрации неизмеряемых анионов — фосфатов, сульфатов, уратов, анионов гиппурата, поэтому возможно увеличение показателя «anion дар».
Развитие второй и третьей стадий ХПН сопровождается нарушением продукции некоторых гормонов, главным образом эритропоэтина и витамина D3, Недостаток эритропоэтина — главная причина анемии при ХПН. Плазма уремических больных содержит значительно меньше эритропоэтина по сравнению с плазмой пациентов с анемией другого генеза. В костном мозге пациентов с анемией при ХПН отсутствуют гиперпролифе- ративные процессы в отличие от пациентов с анемией другого происхождения.
При ХПН нарушается образование 1,25-гидроксихолекальциферо- ла — метаболита витамина D3 (в норме он образуется в клетках проксимальных канальцев с помощью фермента 1-а-гидроксилазы), что является причиной нарушения минерализации костей в связи с развитием вторичного гиперпаратиреоза и остеодистрофии. Гиперпаратиреоз при ХПН связан также с потерей способности почек поддерживать баланс фосфатов. При значительном снижении СКФ реабсорбция фосфатов падает с 90 % до 15 % и увеличивается экскреция фосфатов. Это стимулирует гиперсекрецию паратгормона, вызывающего задержку фосфатов, что обусловливает снижение уровня ионизированного кальция в плазме и усиление проявлений вторичного гиперпаратиреоза.
Для ХПН характерно расстройство обмена глюкозы, развивается потеря чувствительности тканей к инсулину. Продукция глюкоза и процесс усвоения глюкозы печенью остаются в норме. При падении СКФ ниже 10— 5 мл/мин снижается клиренс инсулина, и поэтому у некоторых больных диабетом исчезает потребность в инсулине.
При ХПН накапливается в кро?и большое количество пептидныхгормонов — гастрина, глюкагона, гормона роста, лютеинизирующегогормона, фолликулостимулирующего гормона, клиническое значение которых вариабельно.
Содержание гормона роста нередко повышено при ХПН, поскольку падает скорость его распада, однако у детей может наблюдаться задержка роста в связи с нарушением питания, ацидозом и остеодистрофией.
Уремические токсины. Поиску уремическихтоксинов уделено много внимания, хотя проблема патогенетической роли уремических токсинов при ХПН остается дискуссионной.
Предположение о существовании «уремических токсинов» поддерживается клиническими наблюдениями, свидетельствующими о клиническом улучшении и обратимости многих биохимических показателей после гемодиализа.
Уремический синдром — результат влияния многих факторов, действующих на вне- и внутриклеточную среду. Снижение экскреторной функции почек ведет к накоплению токсичных веществ, органических и неорганических, которые нарушают механизмы, регулирующие функцию клетки.
57 г
Терминальной стадии ХПН сопутствует нарушение транспорта ионов. Уменьшение активности Na+, К+аденозинтрифосфатазы, эритроцитов, клеток скелетных мышц, островковых клеток поджелудочной железы вызывает деполяризацию мембраны и увеличение в клетках Na+, Са++. Полагают, что расстройство транспорта ионов при ХПН составляет основу «уремического отравления».
Признано, что «уремическое отравление» может быть результатом взаимодействия разных соединений плазмы, не токсичных по природе, но оказывающих токсический эффект при взаимодействии с другими веществами, например,при карбомаилировании.
К уремическим токсинам в последние годы относят мочевину, гуа- нидин, мионозитол, р2-микроглобулин, «средние молекулы», парат гормон, микроэлементы.
Мочевина спонтанно расщепляется до цианата, концентрация которого может быть высокой, и в эксперименте на животных продемонстрирован токсический эффект цианата. Однако в клинике токсический эффект мочевины более очевиден только при быстром повышении концентрации мочевины в крови.
Токсический эффект гуанидинов и мионозитола продемонстрирован в эксперименте на животных, но не доказан их токсический эффект in vivo.
При ХПН меняется кишечная бактериальная флора, что способствует накоплению алифатических аминов, таких как диметиламин. Выделение паров диметиламина при дыхании может усилить одышку у больных ХПН и вызвать дыхание «рыбы, выброшенной на берег».
Не все функции полиаминов при ХПН выяснены, но установлено, что эти вещества могут стимулировать синтез РНК и ДНК, регулировать активность ферментов, способствовать клеточному росту и влиять на эрит- ропоэз.
Концепция «средних молекул» не получила клинического подтверждения, хотя исследования в этом направлении продолжаются, не определена также химическая структура «средних молекул».
В последние годы к «главным» уремическим токсинам относят па- ратиреоидный гормон (паратгормон). При второй и третьей стадиях ХПН наблюдается гиперсекреция или стимуляция его высвобождения в связи с влиянием различных факторов: метаболического ацидоза, недостатка витамина D3, гипокальциемии и гиперфосфатемии. Избыток паратгормо- на при ХПН способствует накоплению внутриклеточного кальция, который ингибирует окислительный процесс в митохондриях и генерацию АТФ. Уменьшение активности Na+, К+-аденозинтрифосфатазы ведет к гипер- калиемии и увеличению внутриклеточного натрия, уменьшению потенциала покоя клеточной мембраны, нарушению цитоскелета и обмена фос- фолипидов.
В эксперименте метаболические нарушения, вызванные па- ратгормоном, можно предотвратить паратиреоидэктомией, однако паратиреоидэктомия у человека не влияет на обратимость указанных нарушений.
Уремическая стадия характеризуется расстройством функций многих органов и систем: сердечно-сосудистой, эндокринной, нервной системы (уремическая энцефалопатия и периферическая нейропатия), поражением желудочно-кишечного тракта (гастрит, энтероколит, желу- дочно-кишечное кровотечение), системы гемостаза (изменение функций тромбоцитов) и гемопоэтической функции.
Сердечно-сосудистые осложнения — самая частая причина смерти больных ХПН.
Задержка воды и солей с последующей гиперволемией и увеличением минутного объема сердца — основные факторы, способствующие развитию артериальной гипертензии при ХПН.
Определенное значение (результаты противоречивы) имеет повышенная активность системы ренин—ангиотензин, избыточная секреция альдо- стерона, увеличение симпатической активности и уменьшение продукции вазодепрессорных гормонов. Имеются также данные, указывающие на роль увеличения общего периферического сопротивления в развитии артериальной гипертензии при ХПН. Этому могут способствовать повышенная чувствительность сосудистого русла к прессорному эффекту ангиотензи- на или других гормонов, которые повышают тонус сосудов в связи с их влиянием на увеличение внутриклеточного кальция.
Сердечной недостаточности при ХПН способствуют гиперволемия, артериальная гипертензия, анемия, изменение состава внеклеточной жидкости.
