
- •1) Идеальный газ
- •2) Основное уравнение молекулярно-кинетической теории идеального газа
- •Вывод основного уравнения мкт[править | править исходный текст]
- •3) Теорема о равномерном распределении кинетической энергии по степеням свободы. Уравнение состояния идеального газа.
- •Уравнение состояния идеального газа[править | править исходный текст]
- •4) Работа идеального газа. Внутренняя энергия и теплоемкость (молярная и удельная) идеального газа.
- •Адиабатический[править | править исходный текст]
- •Изотермический[править | править исходный текст]
- •Изохорный[править | править исходный текст]
- •Внутренняя энергия идеального газа
- •5) Первый и второй законы термодинамики (различные формулировки). Первый закон термодинамики
- •Частные случаи первого закона термодинамики для изопроцессов
- •Цикл Карно для тепловой машины
- •Эффективность теплового двигателя
- •6) Политропические процессы. Уравнения политропы для идеального газа
- •Уравнения политропы для газа Ван-дер-Ваальса
- •Адиабата Пуассона[править | править исходный текст]
- •Вывод уравнения[править | править исходный текст]
- •8) Циклические процессы. Коэффициент полезного действия и холодильный коэффициент. Циклические процессы
- •9) Цикл Карно. Коэффициент полезного действия и холодильный коэффициент.
Теоретические вопросы для 2-го модуля.
Давление и абсолютная температура идеального газа. Моль, молярная масса и молярный объем.
Основное уравнение молекулярно-кинетической теории идеального газа (вывести).
Теорема о равномерном распределении кинетической энергии по степеням свободы. Уравнение состояния идеального газа.
Работа идеального газа. Внутренняя энергия и теплоемкость (молярная и удельная) идеального газа.
Первый и второй законы термодинамики (различные формулировки).
Политропические процессы. Получить уравнение для этих процессов.
Адиабатический процесс. Получить уравнение для этого процесса.
Циклические процессы. Коэффициент полезного действия и холодильный коэффициент.
Цикл Карно. Коэффициент полезного действия и холодильный коэффициент.
1) Идеальный газ
Это несуществующая физическая модель газа, который состоит из большого числа молекул, размеры которых ничтожно малы по сравнению со средними расстояниями между ними. Молекулы такого газа можно считать материальными точками, это означает, что их вращательное и колебательное движения не принимаются во внимание. Движение молекул происходит без столкновений с другими молекулами, подчиняется законам Ньютона. Соударения молекул со стенками сосуда являются абсолютно упругими.
Параметры состояния газа
Давление, температура и объем - параметры состояния газа. Или их называют макропараметрами. Температура - внешняя характеристика скоростей частиц газа. Давление - внешняя характеристика соударений со стенками, например, сосуда. Объем - место, куда заключены частицы газа. Газ занимает весь предоставленный ему объем. Существуют еще внешние параметры, например тела или поля, действующие на газ из вне.
Микропараметры (маленькие, внутренние характеристики) газа - это параметры, которые мы не можем оценить без специальных экспериментов, например, скорость и направление движения каждой молекулы газа.
Состояние термодинамической системы, когда все ее параметры при неизменных внешних условиях не изменяются со временем, называют равновесным.
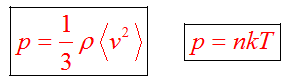
Основное уравнение молекулярно-кинетической теории
Уравнение связывает микропараметры и макропараметры (давление, объем и температуру) идеального газа.
Рассмотрим идеальный газ, который находится в кубическом сосуде. Каждая молекула упруго сталкивается со стенкой сосуда, при этом изменятся ее импульс. Столкновение всех молекул со стенкой на макроуровне ощущается как давление газа на сосуд. В формулах будут присутствовать средние значения, потому что какая-то молекула движется быстрее, какая-то помедленнее, для того, чтобы оценить примерную скорость, будем брать средние значения.
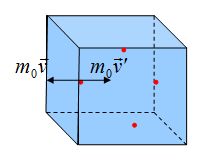
Основное уравнение мкт имеет вид
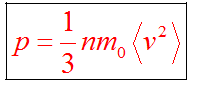
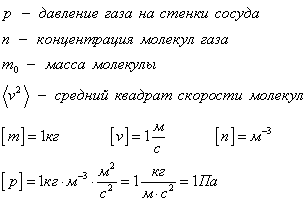
Средний квадрат скорости молекул
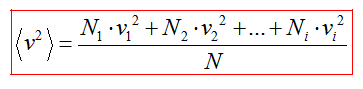
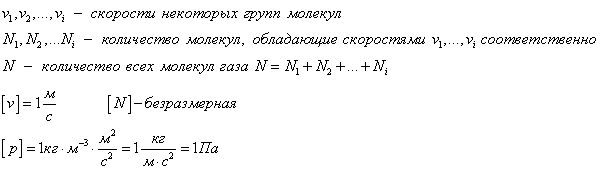
Средняя квадратичная скорость vкв молекул это квадратный корень из среднего квадрата скорости
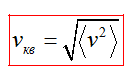
Средняя кинетическая энергия молекул
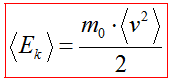
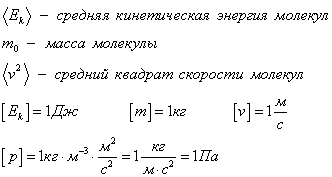
Можно вывести формулы
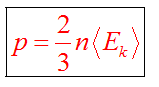
Температура
Это макропараметр, который характеризует способность тел к теплопередаче. Если два тела разной температуры контактируют, то произойдет переход энергии или передача теплоты от более горячего к холодному. Установится тепловое равновесие, все части будут одинаковой температуры.
Температура
характеризует интенсивность движения
частиц, поэтому связана со средней
кинетической энергией частиц. Из опыта
известно, что средняя кинетическая
энергия молекул не зависит от вида газа
и определяется температурой.
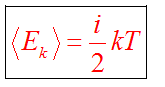

Связь между температурами по шкале Цельсия и по шкале Кельвина
![]()
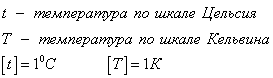
Моль есть количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Количество специфицированных структурных элементов в одном моле вещества называется постоянной Авогадро (числом Авогадро), обозначаемой обычно как NA. Таким образом, в углероде-12 массой 0,012 кг содержится NA атомов. Значение постоянной Авогадро, рекомендованное Комитетом по данным для науки и техники (CODATA) в 2010 году[4], равно 6,02214129(27)·1023 моль−1.
1/12 массы атома углерода-12 называют атомной единицей массы (обозначение а. е. м.). Отсюда следует, что 1 а. е. м. = 0,001/NA кг.
Из определения а. е. м. вытекает, что молярная масса вещества, выраженная в граммах на моль, численно равна массе молекулы этого вещества, выраженной в атомных единицах массы.
При нормальных условиях объём одного моля идеального газа составляет 22,413 996(39) л[5].
Моля́рная ма́сса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает смассой атома элемента, выраженной в а.е.м. (атомная единица массы).
Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов.
Например, молярная масса воды (H2O) есть MH2O = 2 MH +MO = 2·1+16 = 18 (г/моль).
Моля́рный объём — объём одного моль вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Значение NA = 6,022…×1023 называется числом Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.
Именно такое количество молекул содержит 1 моль кислорода О2, такое же количество атомов в 1 моль железа (Fe), молекул в 1 моль воды H2O и т. д.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях имеет один и тот же объём Vm = 22,413 996(39) л[1]. При нормальных условиях большинство газов близки к идеальным, поэтому вся справочная информация о молярном объёме химических элементов относится к их конденсированным фазам, если не оговорено обратное.
