
лаба4
.docxМинистерство науки и высшего образования Российской Федерации
Ф едеральное
государственное автономное образовательное
учреждение высшего образования
едеральное
государственное автономное образовательное
учреждение высшего образования
«НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Инженерная школа природных ресурсов
Направление подготовки 18.03.01 «Химическая технология»
Профиль «Химическая технология подготовки и переработки нефти и газа»
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №4
Название работы |
Расчет жидкофазного реактора алкилирования |
Вариант |
Вариант 8 |
По дисциплине |
Макрокинетика химических процессов и расчет реакторов |
Студент
Группа |
ФИО |
Подпись |
Дата |
2Д6В |
Коробер С.А. |
|
|
Руководитель
Должность |
ФИО |
Ученая степень, звание |
Подпись |
Дата |
Доцент |
Юрьев Е.М. |
к.т.н. |
|
|
Томск – 2020 г.
Цель работы:
Составить математическую модель жидкофазного реактора каскадного типа алкилирования изобутана.
Исследовать процесс алкилирования изобутана бутан – бутиленовой фракцией в присутствии серной кислоты.
Исходные данные:
Производительность установки по сырью 50000 кг/ч (с учетом рециркуляции изобутана).
Исходные данные для выполнения лабораторной работы приведены в таблице 1.
Таблица 1 – Исходные данные для выполнения лабораторной работы
Время, час |
Температура, K |
Мольное соотношение изо-С4Н10/С4Н8 |
6.0 |
284 |
6:1/8:1 |
Значения кинетических параметров:
k0 = 1,38∙1014 с-1
E = 9,3∙104 Дж/моль
Теоретическая часть:
Алкилирование осуществляется в реакторе (рисунок 1), реакционная зона которого состоит из пяти последовательных и равных по размерам секций.

Рисунок 1 – Жидкофазный реактор алкилирования изобутана:
1 – смеситель; 2 – насос; 3 – конденсатор; 4 – отстойник кислоты;5 – аккумулятор алкилата
На основании промышленных данных примем соотношение кислоты и углеводородов α = 1,2.
В реакторе протекает химическая реакция:
изо-С4Н10
+ С4Н8
 С8Н18.
С8Н18.
Давление при определенной температуре реакции рассчитается по уравнению изотермы жидкой фазы:

где
 –
давление насыщенных паров чистых
веществ;
–
давление насыщенных паров чистых
веществ;
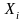 – мольные доли углеводородных компонентов;
– мольные доли углеводородных компонентов;
 – давление насыщенного пара серной
кислоты.
– давление насыщенного пара серной
кислоты.
Обозначим:
С1, С2, С3 – соответственно концентрации реагирующих веществ: изобутана, бутилена, октана (мольн. доли).
τ – время контакта, с;
t – время проведения процесса, с;
k – константа скорости химической реакции, с-1;
Q – тепловой эффект реакции, Дж/моль;
CPсм – теплоемкость смеси, Дж/моль·К;
N – число ячеек.
Тогда систему уравнений материального баланса можно записать следующим образом. Для первой ячейки:
 (1)
(1)
 (2)
(2)
 (3)
(3)
Для второй ячейки:
 (4)
(4)
 (5)
(5)
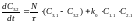 (6)
(6)
Либо в общем виде систему уравнений материального баланса можно представить, как:
 (7)
(7)
 (8)
(8)
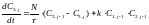 (9)
(9)
где j – номер ячейки, j = 1–5.
Уравнение теплового баланса:


Начальные условия:



Система уравнений математического описания процесса алкилирования может быть решена с использованием численных методов решения обыкновенных дифференциальных уравнений, например, метода Эйлера либо Рунге – Кутта. В данной лабораторной работе используется метод Рунге – Кутта.
Порядок выполнения лабораторной работы:
Приняли время контакта в одной ячейке равным 10 минут (600 секунд). Суммарно имеем 5 ячеек, соответственно время контакта 50 минут (3000 секунд).
Используя программу Microsoft Exсel и заданные кинетические параметры, по уравнению Аррениуса рассчитали константу скорости химической реакции, равную k = 6,16∙10-4 с-1.
По уравнениям (1), (2) и (3) с учетом теплового баланса рассчитали концентрацию изобутана, бутилена и изооктана в первой ячейке. Результаты расчета приведены на рисунках 2 и 3.

Рисунок 2 – График зависимости концентрации изобутана от времени для первой ячейки

Рисунок 3 – График зависимости концентрации бутилена и изооктана от времени для первой ячейки
Приняв за исходные концентрации реагирующих веществ конечные концентрации в предыдущей ячейке, рассчитали концентрации изобутана, бутилена и изооктана для 2, 3, 4 и 5 ячеек.
Результаты приведены в таблице 2.
Таблица 2 – Результаты расчета концентраций веществ для 5 ячейки при различных соотношениях изобутана и бутилена
Вещества |
Мольное соотношение изобутан : бутилен |
||
6:1 |
7:1 |
8:1 |
|
Концентрация, моль/л |
|||
Изобутан |
5,0005 |
6,0000 |
7,0001 |
Бутилен |
0,0005 |
0,0026 |
0,0001 |
Изооктан |
0,9995 |
0,9997 |
0,9999 |
Для исследования зависимости концентрации изооктана от соотношения изобутана и бутилена провели аналогичные расчеты для соотношений 7:1, 8:1. Результаты приведены на рисунке 4.
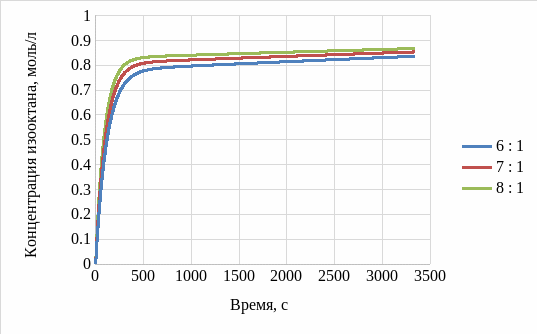
Рисунок 4 – График зависимости концентрации изооктана от времени для первой ячейки при различных соотношениях изобутана и бутилена
Также приведен график зависимости температуры в реакторе от времени (рисунок 5).

Рисунок 5 – График зависимости температуры в реакторе от времени для первой ячейки
Вывод:
В ходе лабораторной работы была разработа математическая модель жидкофазного реактора каскадного типа алкилирования изобутана. Проведено исследование процесса алкилирования изобутана бутан-бутиленовой фракции в присутствии серной кислоты.
Согласно полученным графикам (рисунки 2 и 3) в ходе реакции образуется изооктан и расходуются бутан с бутиленом. Причем образование изооктана пропорционально расходованию бутилена. Данные зависимости говорят о правильности составления математической модели.
При исследовании влияния соотношения изобутана и бутилена выяснилось, что согласно рисунку 4, увеличение соотношения изобутана и бутилена приводит к интенсификации процесса образования изооктана, т.е. образование аналогичного количества целевого продукта происходит за меньшее время. Однако, разница концентраций целевого продукта незначительна, поэтому однозначно считать целесообразным увеличение соотношения нельзя, т.к. необходимо провести дальнейшие исследования.
По рисунку 5 можно сделать вывод о том, что реакция практически изотермическая, т.к. исходная температура изменяется на 3.
Литература
Ушева Н. В. Макрокинетика химических процессов и расчет реакторов: учебное пособие / Н. В. Ушева, А. В. Кравцов; Национальный исследовательский Томский политехнический университет. — 2-е изд. — Томск: Изд-во ТПУ, 2013. — 92 с.
