
описание 18
.docx
ЦЕЛЬ РАБОТЫ: познакомиться с теоретическими положениями, описывающими свойства поверхностного слоя жидкостей и растворов. Изучить влияние поверхностно-активных веществ (мыла) на поверхностное натяжение воды.
ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ: жидкое состояние вещества очень распространено в условиях нашей планеты. В современной технологической практике и быту роль жидкостей тоже исключительно велика.
Чаще всего жидкости существуют в виде дисперсных систем, именно растворов молекулярных и коллоидных, эмульсий, суспензий.
Изучение общих свойств жидкостей и жидких дисперсных систем является важной задачей не только общего, но и специального образования, с учетом будущей специальности обучающихся.
При изучении жидкостей естественным является первоначальное знакомство со свойствами чистых жидкостей, а затем с системами.
Наш жизненный опыт показывает, что существуют непрерывные переходы от разреженных состояний к плотным (от паров к жидкостям), от жидкостей к парам. Отсюда следует утверждение наличия общего уравнения состояния как для жидкостей, так и паров, которое в неявном виде можно записать так
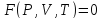
Однако молекулы жидкостей находятся на меньших расстояниях, чем газов и большую часть времени колеблются около некоторых положений равновесия. Вследствие взаимодействия при тепловом движении некоторые молекулы приобретают избыточную энергию и совершают перескоки, трансляция в свободные места.
Поскольку расстояние между молекулами невелики, то вблизи каждой можно говорить о ближнем порядке в расположении соседних.
Молекулы поверхностного слоя находятся в особом состоянии. Плотность жидкостей в переходном слое изменяется до плотности пара. При обычных температурах толщина этого слоя составляет несколько молекулярных диаметров и растет с повышением температуры. Взаимодействие между молекулами жидкости существенно больше, чем между молекулами жидкости и пара. Вследствие этого молекулы поверхностного слоя взаимодействуют друг с другом, создавая напряженное состояние поверхностного слоя и создают поверхностное давление на всю жидкость.
Расчет
дает для него
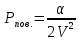 ,
,
где
 -
постоянная Ван-дер-Ваальса;
-
постоянная Ван-дер-Ваальса;
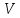 - мольный объем.
- мольный объем.
Ван-дер-Ваальсово
давление, как известно, равно
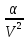 .
.
Таким
образом, общее молекулярное давление
в жидкости
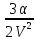
И уравнение состояния жидкости можно написать:
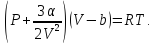
Оно
применимо для состояний вдали от
критического. Относительно свободного
объема (объема, не занятого частицами
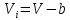 ),
имеет вид:
),
имеет вид:
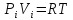 ,
,
где
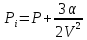 -
давление, называемое термическим.
-
давление, называемое термическим.
Напряженное состояние поверхностного слоя ведет к тому, что для увеличения поверхности необходима затрата энергии.
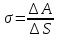 -
коэффициент поверхностного натяжения.
-
коэффициент поверхностного натяжения.
Он также равен численно силе, действующей на единицу длины линии, являющейся границей поверхности.
Исходя из последнего определения, можно предположить несколько методов определения поверхностного натяжения. Один из них – метод отрыва кольца, погруженного в смачивающую жидкость (см. рис.I.)

Рис.I.
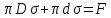
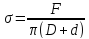
Если кольцо предварительно уравновесить на весах, то по величине силы отрыва его от жидкости можно судить о силе поверхностного натяжения. Она будет равна силе поверхностного натяжения.
Поверхностное натяжение очень существенно зависит от чистоты жидкости. Численное значение коэффициента поверхностного натяжения при определенной температуре служит одним из критериев чистоты жидкости.
При растворении твердого или жидкого вещества в жидком растворителе силы взаимодействия между молекулами растворенного вещества и молекулами растворителя не равны силами взаимодействия между молекулами растворителя. В одних случаях они больше, в других – меньше.
Если молекулы растворителя притягиваются друг к другу сильнее, чем к молекулам растворенного вещества, то из поверхностного слоя внутрь жидкости втягиваются молекулы растворителя, а молекулы растворенного вещества концентрируются в поверхностном слое. Поверхностное натяжение раствора становится меньше, чем поверхностное натяжение растворителя.
Концентрация молекул на поверхности тела называется адсорбцией. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными. По отношению к воде поверхностно-активными веществами являются, например, карбоновые кислоты, спиты, мыла и др.
Мыла представляют из себя соли высших карбоновых кислот как насыщенных, так и ненасыщенных. Натриевая соль стеариновой кислоты является одним из основных компонентов бытового мыла. Ее химическая формула:
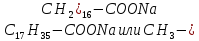
Атомы
углерода в углеродном радикале
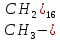 образуют зигзагообразную цепочку.
образуют зигзагообразную цепочку.
Молекула мыла, адсорбируясь на поверхности, ориентируется углеводородным радикалом в воздух и как угодно наклоняется по отношению к поверхности. С ростом числа молекул на поверхности они выстраиваются на поверхности, подобно частоколу. Поверхностное натяжение при этом уменьшается, стремясь к некоторому предельному значению, которое соответствует полностью насыщенному поверхностному слою. При этом с дальнейшим ростом концентрации мыла в растворе начинают возникать агрегаты мыльных молекул – мицеллы.
ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ
-
Прибор для измерения коэффициента поверхностного натяжения.
-
Колба с дистиллированной водой.
-
Колба с мыльным раствором известной концентрации.
-
Мерный стакан.
-
Широкий сосуд-кювета, в который заливается нужный объем воды.
В нем же приготовляются растворы добавлением в жидкость мыльного раствора.
-
Микропипетка объемом 0,2 мл для отмеривания мыльного раствора.

ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ:
В настоящей работе для измерения коэффициента поверхностного натяжения жидкости используется метод отрыва кольца. Усилие отрыва определяется с помощью прибора (рис.2.), который позволяет плавно это усилие изменять.
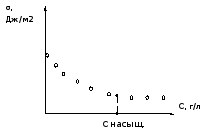
При вращении винта 8 по часовой стрелке закручивается металлическая нить, установленная внутри корпуса прибора и, соединенное с ней коромысло 6 с кольцом 1 поднимается вверх. Усилие отрыва можно определить, используя график (рис.3), откуда следует, что оно прямо пропорционально углу закручивания нити.
ВО ИЗБЕЖАНИЕ ВЫХОДА ПРИБОРА ИЗ СТРОЯ НЕ ЗАКРУЧИВАТЬ НИТЬ БОЛЕЕ ЧЕМ НА 600!!!
ПОРЯДОК ИЗМЕРЕНИЙ
-
Промыть спиртом и высушить кольцо 1.
-
Отодвинуть арретир вправо вдоль стрелки 6, освободить коромысло 5.
-
Винтом 8 установить коромысло 5 в горизонтальное положение (контроль по стрелке 6).
-
В чашку 2 столика 3 налить дистиллированную воду (50мл), поместить столик под кольцом, поднять его, (вращая винт 4), до соприкосновения кольца с жидкостью.
-
Плавно и медленно вращать винт 8 по часовой стрелке до тех пор, пока не наступит отрыв кольца от жидкости. При этом необходимо следить за горизонтальным положением коромысла, уменьшая при необходимости, винтом 4 высоту столика.
-
Зафиксировать угол закручивания нити прибора (по стрелке 7), соответствующий моменту отрыва кольца, по которому (с помощью градуировочного графика) найти усилие отрыва.
-
Проделав измерение несколько раз, определить среднее усилие отрыва и вычислить, в соответствии с выражением
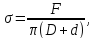 коэффициент
поверхностного натяжения жидкости.
коэффициент
поверхностного натяжения жидкости.
Параметры
кольца:
 = 49,6мм;
= 49,6мм;
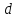 = 48,6мм.
= 48,6мм.
(Учитывая
линейность нагрузочной характеристики
прибора, можно вычислить коэффициент
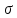 относительным методом, используя
табличное значение
относительным методом, используя
табличное значение
 для воды. Следует однако помнить, что в
этом случае измерение с чистой водой
надо проводить особенно тщательно, т.к.
наличие даже малых «загрязнений» может
существенно изменить поверхностное
свойства жидкости).
для воды. Следует однако помнить, что в
этом случае измерение с чистой водой
надо проводить особенно тщательно, т.к.
наличие даже малых «загрязнений» может
существенно изменить поверхностное
свойства жидкости).
-
Добавляя в чашку с водой по 0,2 мл мыльного раствора (
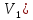 ,
и измеряя в каждом случае силу
поверхностного натяжения, довести
объем добавляемого раствора до 2мл.
,
и измеряя в каждом случае силу
поверхностного натяжения, довести
объем добавляемого раствора до 2мл. -
Определить температуру, при которой производится опыт.
-
Результаты опыта и расчетов концентраций поверхностного натяжения занести в таблицу. Таблица I
|
№ п/п |
𝖥натяжения |
V1 раствор |
C, г/л |
|
|
1 - - - 10 |
|
|
|
|
Концентрацию мыла в исследуемом растворе можно найти по формуле:
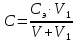
где,
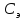 - концентрация мыла в эталонном растворе,
- концентрация мыла в эталонном растворе,
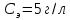 ;
;
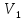 -
объем добавленного раствора;
-
объем добавленного раствора;
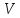 -
исходный объем воды в чашке,
-
исходный объем воды в чашке,
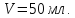
-
Построить график
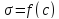 и указать на нем примерную концентрацию,
при которой наступает насыщение
поверхностного слоя молекулами мыла.
и указать на нем примерную концентрацию,
при которой наступает насыщение
поверхностного слоя молекулами мыла.
-
Вычислить погрешность косвенного измерения.
СОДЕРЖАНИЕ ОТЧЕТА
Отчет по лабораторной должен содержать: название работы, цель и задачи, краткие сведения из теории, рисунок лабораторной установки с ее описанием, сводку расчетных формул, результаты опыта и расчетов, сведенные в таблицу численные значения, расчет погрешности, выводы по работе.
КОНТРОЛЬНЫЕ ВОПРОСЫ
-
Каково энергетическое состояние молекул поверхностного слоя чистой жидкости?
-
Как изменяется энергетическое состояние поверхностного слоя, если он содержит адсорбированные молекулы поверхностно-активного вещества?
-
Какие связи между атомами в молекулах мыл?
ЛИТЕРАТУРА
-
Савельев И.В. Курс общей физики. М.: Наука, 1977, с.366-377, 1986, с.371-375.
-
Телеснин Р.В. Молекулярная физика. М.: высшая школа, 1973, с.232-234.
Рис.3.

 ,
Дж/м2
,
Дж/м2