
Лекция 8
5. Термодинамика
Термодинамика явилась первой наукой, на основе которой стало возможным статистическое изучение макросвойств и процессов для произвольных систем с числом частиц N>>1. При термодинамическом подходе о макросвойствах системы судят на основе обобщенных исследований. К числу этих исследований относятся изучения:
1) процессов взаимопревращения теплоты и работы;
2) обратимых и необратимых процессов;
3) процессов при низких температурах.
Аналитическое обобщение такого рода опытов позволяет сформулировать три закона термодинамики, которые можно записать в виде дифференциальных уравнений и которые составляют его фундамент. Такой метод исследования называют феноменологическим. Он присущ и другим разделам физики(механика, электростатика и др.). При феноменологическом подходе полностью используются молекулярно-кинетические представления, поэтому выводы полученные в этих рамках, не позволяют глубоко вскрыть природу изучаемых явлений. Оставаясь в рамках термодинамики невозможно обосновать законы термодинамики. Это свидетельствует об ограниченности феноменологического подхода. Эти законы термодинамики можно лишь обосновать на основе статистического метода.
5.1.Основные понятия термодинамики
1.Работа.
Рассмотрим макроскопическую систему
А.
Энергия этой системы зависит от свойств
самой системы и от внешних условий.
Внешние условия в которых находится
система, можно охарактеризовать заданием
внешних параметров (например, координат).
Энергия является функцией внешних
параметров
![]() .
.
Рассмотрим теперь изменение энергии системы при бесконечно малом изменении параметра а, при котором распределение вероятностей различных состояний остается неизменным. Это означает, что при изменении параметра а система не переходит из одного микросостояния в другое. В таком случае имеем:
![]() .
(5.1)
.
(5.1)
Производную
![]() можно
рассматривать как некоторую обобщенную
силу, действующую на систему. За счет
этой силы происходит изменение координатыа до
значения a+da
и изменение энергии системы на величину
можно
рассматривать как некоторую обобщенную
силу, действующую на систему. За счет
этой силы происходит изменение координатыа до
значения a+da
и изменение энергии системы на величину
![]() ,
где
,
где
![]() ,
,
![]() –энергия
системы в i-том
микросостоянии.
–энергия
системы в i-том
микросостоянии.
Переходя в выражении(1) к средним значениям, имеем:
![]() .
.
Величину
![]() можно рассматривать как обобщенную
силу, действующую на макроскопическую
систему и приводящую к изменению
координатыа.
Величину
можно рассматривать как обобщенную
силу, действующую на макроскопическую
систему и приводящую к изменению
координатыа.
Величину
![]() по аналогии с механической можно
рассматривать как работу, производимую
над макроскопической системой при
изменении координаты наdа.
Знак ‘’-’’ означает, что работа
совершается внешними силами. В
термодинамике процесс изменения энергии
макроскопической системы при изменении
внешних параметров называется работой.
С молекулярной точки зрения, совершение
работы связано с изменением значений
энергии микросостояния. Эти изменения
значений энергии связаны с изменением
внешних параметров. Распределение же
вероятностей различных состояний
остается неизменным.
по аналогии с механической можно
рассматривать как работу, производимую
над макроскопической системой при
изменении координаты наdа.
Знак ‘’-’’ означает, что работа
совершается внешними силами. В
термодинамике процесс изменения энергии
макроскопической системы при изменении
внешних параметров называется работой.
С молекулярной точки зрения, совершение
работы связано с изменением значений
энергии микросостояния. Эти изменения
значений энергии связаны с изменением
внешних параметров. Распределение же
вероятностей различных состояний
остается неизменным.
2.Квазистатические и нестатические процессы. Процессы, при которых макроскопическая система все время находится в равновесии (или точнее, в ходе которых система проходит через последовательный ряд равновесных состоянии) называется равновесным или квазистатическими.
Состояние считается равновесным, если во всех точках системы параметры состояния (p,V,T) одинаковы. Если какой - либо параметр состояния системы в её различных точках неодинаков, то состояние является неравновесным. Если такую систему предоставить самой себе, то значения параметра выравниваются, и система приходит в состояние равновесия.
Квазистатический
процесс легко представить, если реальная
скорость процесса
![]() много меньше скорости восстановления
равновесия. В этом случае при реальных
изменениях с малой скоростью равновесие
восстанавливается с большой скоростью,
и при реальном изменении состояния
макроскопической системы эта система
проходит через ряд равновесных состояний.
много меньше скорости восстановления
равновесия. В этом случае при реальных
изменениях с малой скоростью равновесие
восстанавливается с большой скоростью,
и при реальном изменении состояния
макроскопической системы эта система
проходит через ряд равновесных состояний.
Рассмотрим
макроскопическую систему А,
взаимодействующую с термостатом В.
Будем считать
давление макроскопической системы А
равным р,
а давление термостата (р+![]() ).
Тогда за счет бесконечно малого перепада
давление
).
Тогда за счет бесконечно малого перепада
давление![]() начинается
процесс выравнивания давления - системаА
начинает сжиматься. Если бы переход
давления был равен нулю, то процесс
отсутствовал бы, и его скорость была
бы равна нулю. При бесконечно малом
перепаде
начинается
процесс выравнивания давления - системаА
начинает сжиматься. Если бы переход
давления был равен нулю, то процесс
отсутствовал бы, и его скорость была
бы равна нулю. При бесконечно малом
перепаде
![]() скорость
процесс бесконечно мала, а скорость
скорость
процесс бесконечно мала, а скорость
![]() процесса восстановленного равновесия
в газе конечна, т.е.
процесса восстановленного равновесия
в газе конечна, т.е.![]() ,
и процесс сжатия газа будет проходить
через последовательность равновесных
состояний, т.е. квазистатически.
,
и процесс сжатия газа будет проходить
через последовательность равновесных
состояний, т.е. квазистатически.
Такой
процесс называют обратимым, т.к. достаточно
бесконечно малых условий, и процесс
потечет в обратном направлении, то есть
если давление газа будет p+![]() ,
а термостатар,
то газ будет расширяться, проходя
квазистатически через те же состояния,
но в обратном порядке.
,
а термостатар,
то газ будет расширяться, проходя
квазистатически через те же состояния,
но в обратном порядке.
В термодинамике обратимыми процессами
называют такие процессы, которые могут
протекать как в прямом, так в обратном
направлениях без заметных (конечных)
изменений в окружающей среде. Если же
скорость протекания процесса много
больше скорости восстановления
равновесия,
![]() ,
то процесс называется нестатическим
или неравновесным. В этом случае система
проходит ряд неравновесных состояний.
Физически такая ситуация встречается
тогда, когда имеет место конечный перепад
(градиент) параметров системыАи
термостатаВ. Такие процессы называют
еще необратимыми, т.к. бесконечно малых
изменений условий в конечном состоянии
будет недостаточно, чтобы вернуть
систему в исходное состояние, т.е. процесс
нельзя обратить без конечных изменений
в окружающей среде.
,
то процесс называется нестатическим
или неравновесным. В этом случае система
проходит ряд неравновесных состояний.
Физически такая ситуация встречается
тогда, когда имеет место конечный перепад
(градиент) параметров системыАи
термостатаВ. Такие процессы называют
еще необратимыми, т.к. бесконечно малых
изменений условий в конечном состоянии
будет недостаточно, чтобы вернуть
систему в исходное состояние, т.е. процесс
нельзя обратить без конечных изменений
в окружающей среде.
3.Полное изменение энергии равновесной системы. Рассмотрим систему А, которая находится в состоянии равновесия. Полное изменение средней энергии системы определяется выражением:
![]() .
(5.2)
.
(5.2)
Первое
слагаемое в выражении (5.2) - это работа
![]() ,
совершаемая над системой. Второе
слагаемое - это та часть изменения
энергии макроскопической системы,
находящейся во взаимодействии с
термостатом, которая не связана с
изменением внешних параметров (а=const).
Это вклад в изменение средней энергии
системы за счет непрерывной передачи
энергии от частиц термостата В
к частицам системы А.
Если внешние параметры не меняются, то
энергия отдельных микросостояний не
меняется, и энергия, подводимая к
макроскопической системе извне, идет
на изменение распределения вероятностей.
Состояние с большей энергией становятся
более вероятными - система нагревается.
Эту часть изменения полной энергии
называют теплотой dQ.
Итак, имеем:
,
совершаемая над системой. Второе
слагаемое - это та часть изменения
энергии макроскопической системы,
находящейся во взаимодействии с
термостатом, которая не связана с
изменением внешних параметров (а=const).
Это вклад в изменение средней энергии
системы за счет непрерывной передачи
энергии от частиц термостата В
к частицам системы А.
Если внешние параметры не меняются, то
энергия отдельных микросостояний не
меняется, и энергия, подводимая к
макроскопической системе извне, идет
на изменение распределения вероятностей.
Состояние с большей энергией становятся
более вероятными - система нагревается.
Эту часть изменения полной энергии
называют теплотой dQ.
Итак, имеем:
![]() .
(5.3)
.
(5.3)
Знаки в уравнении (5.3) определим следующим образом. Энергию, полученную системой А, будем считать положительной, а отдаваемую - отрицательной. Если dQ>0 - система получает теплоту (эндотермический процесс). Если dQ<0 - система отдает теплоту (экзотермический процесс).
Уравнение (5.3) представляет собой закон сохранения энергии, который впервые был получен в термодинамике и называется первым началом термодинамики. Оно определяет полное изменение энергии , которое может происходить только за счет тепловых воздействий, когда внешние параметры системы А зафиксированы, или за счет работы, когда внешние параметры изменяются под действием обобщенных сил самой различной природы (механические, электрические и т.д.).
Е - это внутренняя энергия, в термодинамике её обозначают U, ее изменение dЕ=dU.
Внутренней энергией системы называют кинетическую энергию хаотического движения частиц и потенциальную энергию их взаимодействия.
Таким образом, внутренняя энергия - это полная энергия системы за вычетом кинетической энергии системы как целого и потенциальной энергии её в поле внешних сил.
С учетом сказанного первое начало запишем в виде:
![]() .
(5.4)
.
(5.4)
О чевидно,
чтоdU
- это полный дифференциал, следовательно,
внутренняя энергия системы - это функция
её состояния.
чевидно,
чтоdU
- это полный дифференциал, следовательно,
внутренняя энергия системы - это функция
её состояния.
Действительно, рассмотрим круговой процесс 1-2-1 (рис.5.1). Полное изменение внутренней энергии
![]() .
(5.5)
.
(5.5)
(Если
бы
![]() ,
то в данном состоянии внутренняя энергия
могла бы иметь различные значения. Это
позволило бы без изменения состояния
системы получить работу, равную разности
энергий, что невозможно).
,
то в данном состоянии внутренняя энергия
могла бы иметь различные значения. Это
позволило бы без изменения состояния
системы получить работу, равную разности
энергий, что невозможно).
Из выражения (5.5) видно, что изменение энергии при переходе системы из состояния 1 в состояние 2 не зависит от пути перехода, а определяется только свойствами системы в состояниях 1 и 2. Поэтому U является функцией состояния.
Работа и теплота - характеристики процесса изменения энергии, для их определения надо знать не только переходные и конечные состояния системы, но и все промежуточные состояния процесса, поэтому они не являются функциями состояния.
Прибегая к модели идеального газа, мы пренебрегаем потенциальной энергией взаимодействия молекул, поэтому внутренняя энергия идеального газа равна кинетической энергии всех его молекул. Согласно принципу равнораспределения энергии по степеням свободы, кинетическая энергия молекулы идеального газа равна
![]()
где i – число степеней свободы молекулы. Тогда внутренняя энергия некоторой массы газа равна
![]()
где
![]() - количество вещества данного газа,
- количество вещества данного газа,![]() - число его молекул,
- число его молекул,![]() - число Авогадро ( количество молекул,
содержащееся в моле вещества),
- число Авогадро ( количество молекул,
содержащееся в моле вещества),![]() -
постоянная Больцмана,
-
постоянная Больцмана,![]() - универсальная газовая постоянная.
Последнее выражение показывает, что
внутренняя энергия является функцией
температуры.
- универсальная газовая постоянная.
Последнее выражение показывает, что
внутренняя энергия является функцией
температуры.
Выражение для внутренней энергии, казалось бы, подтверждает гипотезу о равнораспределении молекул по степеням свободы. Однако расширение температурного интервалы показывает иное. Вообще говоря, изначально эта гипотеза была не очень понятна : почему, например, двухатомная молекула не может вращаться вокруг своей оси, или почему «жесткая» молекула не испытывает колебаний. В истории физики имеет место следующий парадокс. Успех гипотезы о равнораспределении энергии по степеням свободы связан с отказом от этой гипотезы. Успех был основан на том, что некоторые степени искусственно исключались без каких-либо убедительных оснований, и множество степеней свободы молекулы просто игнорировалось.
Все эти вопросы были разрешены в рамках квантовой механики. Известно, что вращательная и колебательная энергии молекулы квантованы. Их уровни энергии
![]()
где
r
– вращательное
квантовое число (r=0,1,2,3…),
![]() - колебательное квантовое число, (
- колебательное квантовое число, (
![]() =0,1,2,3…),
=0,1,2,3…),
![]() - момент инерции молекулы относительно
той или иной главной оси,
- момент инерции молекулы относительно
той или иной главной оси,
![]() - собственная частота колебаний,
- собственная частота колебаний,
![]() - постоянная Планка.
- постоянная Планка.
Минимальная вращательная энергия молекулы водорода, рассчитанная по этим формулам, составляет порядка 0,01эВ, при низких температурах (~50К) средняя энергия поступательного движения молекулы вдвое меньше минимальной вращательной энергии, т.е. ее оказывается недостаточно, чтобы возбудить вращательные степени свободы. В этих условиях говорят, что вращательные степени свободы «заморожены».
В области температур ~500К вращательные степени свободы полностью разморожены, и молекула водорода ведет себя как жесткая двухатомная молекула с числом степеней свобода 5=3+2. При этом включаются две, а не три вращательные степени свободы, Это связано с тем, что для включения степени свободы, соответствующей вращению молекулы вокруг ее оси, проходящей через оба ядра, требуется значительно большая энергия из-за малости момента инерции молекулы относительно этой оси.
При температурах, превышающих 1000К, энергии уже оказывается достаточно для постепенного возбуждения колебательной степени свободы.
О бычно
вместо работы
бычно
вместо работы![]() ,
совершаемой внешними телами над системой,
рассматривают работу
,
совершаемой внешними телами над системой,
рассматривают работу![]() ,
совершаемую системой над внешними
телами. Очевидно,
,
совершаемую системой над внешними
телами. Очевидно,![]() ,
тогда первое начало термодинамики
принимает вид:
,
тогда первое начало термодинамики
принимает вид:
![]() (5.6)
(5.6)
- количество теплоты, сообщенной системе, идет на приращение внутренней энергии системы и совершение системой работы над внешними телами.
Найдем
работу, совершаемая макросистемой. Если
объем макросистемы
(например, газа) получает приращение
dV,
а давление,
оказываемое
ею на соседние тела (стенки), равно р,
то элементарная
работа сил, действующих со стороны газа
на стенки, равна
![]() .Это
легко получить для случая, когда система
(газ) находится в цилиндре с поршнем
(рис.5.2.)
.Это
легко получить для случая, когда система
(газ) находится в цилиндре с поршнем
(рис.5.2.)
Элементарная
работа, совершаемая
газом при перемещении поршня на
![]() ,равна
,равна
![]() ,
гдеF
— сила,
с которой газ действует
на поршень. Площадь сечения последнего
S,
поэтому F
= pS
и
,
гдеF
— сила,
с которой газ действует
на поршень. Площадь сечения последнего
S,
поэтому F
= pS
и
![]() ,
где
,
где
![]() .
Отсюда
.
Отсюда
![]() .
.
При
поднятии поршня давление газа, вообще
говоря, может меняться. Поэтому работа,
совершаемая газом при конечных изменениях
объема, например от
![]() до
V2,
должна
быть представлена
в виде интеграла:
до
V2,
должна
быть представлена
в виде интеграла:
A=![]() pdV
. (5.7)
pdV
. (5.7)
Еще
раз отметим, что работа А
существенным
образом зависит от процесса
(или «пути»), по которому
система переводится из состояния
1 в состояние 2.
Это
наглядно в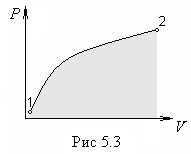 идно
из графика на рис.5.3, где изображен
процесс изменения объема на диаграмме
р,
V.
идно
из графика на рис.5.3, где изображен
процесс изменения объема на диаграмме
р,
V.
Мы знаем, что геометрическая интерпретация интеграла (5.7) — это «площадь» под кривой 1—2, а эта площадь зависит от вида кривой, т. е. от процесса.
Е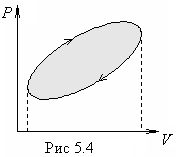 сли
в результате изменений макросистема
возвращается в исходное состояние, то
говорят, что она совершилакруговой
процесс или
цикл.
На
диаграмме р,
V
такой
процесс имеет вид замкнутой кривой
(рис.5.4.). Работа, совершаемая системой
за цикл, численно равна площади внутри
цикла, тонированной на рисунке. При
этом, если точка,
изображающая состояние системы,
описывает цикл по часовой стрелке
(как на рисунке 5.4), то работа
системы
А
>
0. Если же против часовой
стрелки, то А
<
0.
сли
в результате изменений макросистема
возвращается в исходное состояние, то
говорят, что она совершилакруговой
процесс или
цикл.
На
диаграмме р,
V
такой
процесс имеет вид замкнутой кривой
(рис.5.4.). Работа, совершаемая системой
за цикл, численно равна площади внутри
цикла, тонированной на рисунке. При
этом, если точка,
изображающая состояние системы,
описывает цикл по часовой стрелке
(как на рисунке 5.4), то работа
системы
А
>
0. Если же против часовой
стрелки, то А
<
0.
Знак работы зависит от знака dV: на тех участках процесса, где dV>0, работа А > 0, на тех же участках, где dV < 0, и А < 0.
