
Федеральное агентство по образованию
ГОУ ВПО Рыбинская государственная авиационная
технологическая академия им. П. А. Соловьева
Кафедра Общей и технической физики
Утверждено
на заседании методического
семинара кафедры физики
« » _________ 2006г.
Зав.каф. Пиралишвили Ш.А.
Лаборатория «Квантовая физика»
ЛАБОРАТОРНАЯ РАБОТА №КФ – 6
ИЗУЧЕНИЕ СПЕКТРА ИЗЛУЧЕНИЯ РТУТИ
ПРИ ПОМОЩИ СТИЛОМЕТРА
|
Нормоконтролёр |
Автор: к. ф–м. н., доцент Шалагина Е.В. |
|
|
|
|
____________ |
___________________ |
|
|
|
|
|
Рецензент: к.т. н., доцент Суворова З.В. |
|
|
___________________ |
Рыбинск 2006
ИНСТРУКЦИЯ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ
При выполнении работы правила по технике безопасности определяются общей инструкцией по технике безопасности в лаборатории «квантовая физика».
ВНИМАНИЕ! Ртутная лампа излучает мощный поток ультрафиолетовых лучей, вредных для глаз, поэтому ее включение разрешается лишь после того, как защитный фильтр БС-8 вставлен в гнездо держателя конденсатора.
Разряд в ртутно-кварцевой лампе сверхвысокого давления СВД-120А происходит при давлении 10-15 атмосфер. Лампа заключена в металлический кожух для защиты окружающих от попадания в них горячих осколков колбы лампы в случае ее взрыва.
После выключения ртутной лампы ее повторное зажигание следует производить не ранее как через 10 минут.
ЦЕЛЬ РАБОТЫ: Ознакомление с теорией строения многоэлектронных атомов путем изучения спектра атомов ртути. Определение длин волн в видимой области спектра атома ртути при помощи стилометра.
Теоретическое введение
В нормальном состоянии атомы не излучают. Атомы излучают, если им сообщена дополнительная энергия. Такие атомы называются возбужденными. Возбуждение атомов осуществляется в газовом разряде в результате соударения их с электронами или ионами, ускоренными в электрическом поле, а также в электрической дуге.
Изолированные атомы в виде разреженного газа или паров металла испускают спектр, состоящий из различных спектральных линий (линейчатый спектр). Спектр отражает свойства атомной структуры данного элемента: число линий, их расположение, интенсивность, характерные для каждого элемента. (Это обстоятельство лежит в основе спектрального анализа). Изучая атомный спектр, можно, с одной стороны, делать заключения о строении и свойствах атома, а с другой – если известно строение электронной оболочки, можно объяснить спектр элемента.
Расчет энергетического спектра многоэлектронных атомов, представляющих собой систему многих электронов в кулоновском поле ядра, является сложной задачей, так как в таком атоме каждый электрон кроме взаимодействия с ядром испытывает еще и взаимодействие с другими электронами. Решение уравнения Шредингера может быть получено лишь приближенно.
Сила
взаимодействия каждого электрона с
ядром больше, чем с каждым из других
электронов по отдельности, так как заряд
ядра в
![]() раз больше заряда электрона. Поэтому в
нулевом приближении можно рассматривать
взаимодействие электронов только с
ядром, пренебрегая их взаимодействием
между собой. Тогда для каждого электрона
будут верны результаты, полученные для
одного электрона при рассмотрении атома
водорода с учетом того, что заряд во
всех формулах равен
раз больше заряда электрона. Поэтому в
нулевом приближении можно рассматривать
взаимодействие электронов только с
ядром, пренебрегая их взаимодействием
между собой. Тогда для каждого электрона
будут верны результаты, полученные для
одного электрона при рассмотрении атома
водорода с учетом того, что заряд во
всех формулах равен![]() .
При учете взаимодействия электронов
эти формулы уже не будут верны, но
качественный характер наиболее
существенных результатов должен
сохраниться, состояние каждого электрона
в атоме по-прежнему характеризуются
четырьмя квантовыми числами: главнымп: орбитальным
.
При учете взаимодействия электронов
эти формулы уже не будут верны, но
качественный характер наиболее
существенных результатов должен
сохраниться, состояние каждого электрона
в атоме по-прежнему характеризуются
четырьмя квантовыми числами: главнымп: орбитальным![]() ,
магнитным
,
магнитным![]() и спиновым
и спиновым![]() .
.
Как и для атома водорода энергия каждого электрона зависит в основном от значения главного квантового числа п. При этом электроны с меньшими значениямипимеют меньшую в алгебраическом смысле и большую по абсолютной величине энергию:
![]() ,
(1.1)
,
(1.1)
где п=1; 2; 3; ….
Орбитальное квантовое число характеризует орбитальный момент импульса:
![]() ,
(1.2)
,
(1.2)
где
![]() = 0; 1; 2; …п–1. Всего
= 0; 1; 2; …п–1. Всего![]() принимаетпзначений.
принимаетпзначений.
Магнитное квантовое число определяет проекцию момента импульса на выделенное направление в пространстве (направление поля Н):
![]() ,
(1.3)
,
(1.3)
где
![]() =
0;1;2;
…
=
0;1;2;
…![]() ;
;![]() принимает (2
принимает (2![]() + 1) значения.
+ 1) значения.
Спиновое квантовое
число
![]() описывает
проекцию спина электрона на выделенное
направление в пространстве:
описывает
проекцию спина электрона на выделенное
направление в пространстве:
![]() ,
(1.4)
,
(1.4)
где
![]() .
.
Величина спина у
электрона принимает одно значение и
определяется квантовым числом
![]() :
:
![]() .
(1.5)
.
(1.5)
Поскольку электрон
обладает электрическим зарядом, его
можно уподобить электрическому току,
который можно охарактеризовать
орбитальным магнитным моментом
![]() и спиновым магнитным моментом
и спиновым магнитным моментом![]() .
Магнитные моменты направлены в сторону,
противоположную соответствующим
механическим моментам, и могут принимать
лишь определенные значения.
.
Магнитные моменты направлены в сторону,
противоположную соответствующим
механическим моментам, и могут принимать
лишь определенные значения.
Орбитальный магнитный
момент
![]() квантуется по закону:
квантуется по закону:
![]() ,
(1.6)
,
(1.6)
где
![]() – магнетон Бора.
– магнетон Бора.
Проекция орбитального магнитного момента на направление поля равна:
![]() .
(1.7)
.
(1.7)
Спиновый магнитный момент квантуется по закону:
![]() .
(1.8)
.
(1.8)
Проекция спинового магнитного момента на направление поля принимает два значения:
![]() .
(1.9)
.
(1.9)
С орбитальным магнитным
моментом
![]() связано некоторое магнитное поле.
Проекция спинового магнитного момента
связано некоторое магнитное поле.
Проекция спинового магнитного момента![]() на
направление этого поля может принимать
два значения
на
направление этого поля может принимать
два значения![]() .
Энергия этих двух состояний, равная
.
Энергия этих двух состояний, равная![]() ,
различна. В результате все уровни с
,
различна. В результате все уровни с![]() 0 оказываются дублетными (двойными).
Энергия спин – орбитального взаимодействия
зависит от квантовых чисел
0 оказываются дублетными (двойными).
Энергия спин – орбитального взаимодействия
зависит от квантовых чисел![]() и
и![]() .
Наличие этого взаимодействия приводит
к дополнительному «тонкому» расщеплению
электронных уровней с одинаковымипи
.
Наличие этого взаимодействия приводит
к дополнительному «тонкому» расщеплению
электронных уровней с одинаковымипи![]() ,
но с разной ориентацией спинового
момента по отношению к орбитальному
моменту.
,
но с разной ориентацией спинового
момента по отношению к орбитальному
моменту.
Полный механический момент каждого электрона складывается из орбитального и спинового моментов.
В легких и средних
атомах осуществляется нормальная связь
электронов. В этом случае орбитальные
моменты отдельных электронов,
характеризуемых квантовыми числами
![]() ,
,![]() 2,
2,![]() 3и т.д., складываются в суммарный орбитальный
момент атома
3и т.д., складываются в суммарный орбитальный
момент атома![]() ,
а спиновые моменты отдельных электронов,
описываемые квантовыми числами
,
а спиновые моменты отдельных электронов,
описываемые квантовыми числами![]() ,
,![]() ,
,![]() и т.д. – в суммарный спиновый момент
атома –
и т.д. – в суммарный спиновый момент
атома –![]() :
:
![]() ,
,
![]() .
.
Полный механический
момент атома
![]() определяется как векторная сумма
орбитального
определяется как векторная сумма
орбитального![]() и спинового
и спинового![]() моментов атома:
моментов атома:
![]() =
=![]() +
+![]() .
.
Сложение происходит
по законам квантовой механики таким
образом, что моменты
![]() ,
,![]() ,
,![]() квантуются и описываются квантовыми
числами
квантуются и описываются квантовыми
числами![]() – соответственно. При этом
– соответственно. При этом
![]() ,
(1.10)
,
(1.10)
причем
![]() ,
,
![]() ,
(1.11)
,
(1.11)
где
![]() ,
,
![]() ,
(1.12)
,
(1.12)
где
![]() .
.
Проекции механических моментов атома на направление поля принимают значения:
![]() ,
(1.13)
,
(1.13)
где
![]() .
.![]() принимает (
принимает (![]() )
значение,
)
значение,
![]() ,
(1.14)
,
(1.14)
где
![]() .
.
![]() ,
(1.15)
,
(1.15)
![]() .
.![]() принимает (
принимает (![]() )
значение.
)
значение.
Совокупность электронов во многоэлектронном атоме, имеющих одно и то же квантовое число п, называют электронной оболочкой.
Как указывалось выше,
электроны, принадлежащие к одной
оболочке, имеют приблизительно равные
значения энергии Еп.
Оболочки часто обозначают большими
буквами латинского алфавита:К–
оболочка прип= 1,![]() –
оболочка прип= 2,М– оболочка
прип= 3,
–
оболочка прип= 2,М– оболочка
прип= 3,![]() – оболочка прип= 4 и т.д.
– оболочка прип= 4 и т.д.
Однако во многоэлектронном
атоме следует учитывать не только
взаимодействие электронов с ядром, но
и их взаимодействие между собой.
Электронную оболочку можно рассматривать
как слой, заполненный электрическим
зарядом, равным по величине сумме зарядов
всех электронов данной оболочки. Внешние
электроны практически не действуют на
электроны внутренних оболочек. Действие
же внутренних оболочек приводит к тому,
что рассматриваемый электрон движется
в поле «нового» ядра
![]() ,
где
,
где![]() – разность между порядковым номером
атома и числом электронов, внутренних
по отношению к данному электрону.
– разность между порядковым номером
атома и числом электронов, внутренних
по отношению к данному электрону.![]() называют эффективным зарядом (
называют эффективным зарядом (![]() <Z).
При учете взаимодействия электронов
абсолютные значения энергии уровней
оказывается меньше величин, найденных
без учета этого взаимодействия (см.
формулу 1.1). В результате энергия внешних
электронов в любом атоме по порядку
величины соответствует энергии электрона
в атоме водорода, и при возбуждении
внешних оболочек атомы испускают
электромагнитное излучение, лежащее в
оптической области спектра.
<Z).
При учете взаимодействия электронов
абсолютные значения энергии уровней
оказывается меньше величин, найденных
без учета этого взаимодействия (см.
формулу 1.1). В результате энергия внешних
электронов в любом атоме по порядку
величины соответствует энергии электрона
в атоме водорода, и при возбуждении
внешних оболочек атомы испускают
электромагнитное излучение, лежащее в
оптической области спектра.
Вследствие эффекта
экранирования потенциал электрического
поля многоэлектронных атомов с увеличением
расстояния уменьшается быстрее, чем
для атома водорода. Это приводит к тому,
что основная доля энергии взаимодействия
электрона с ядром связана с той частью
волновой функции
![]() ,
которая соответствует малым расстояниям
,
которая соответствует малым расстояниям![]() до ядра. У электронов с
до ядра. У электронов с![]() =
0 эта часть существенно больше, чем у
электронов с
=
0 эта часть существенно больше, чем у
электронов с![]() =
1, а у электронов с
=
1, а у электронов с![]() =
1 больше, чем у электронов с
=
1 больше, чем у электронов с![]() =
2 и т.д.
=
2 и т.д.
Наглядно это можно
проиллюстрировать, воспользовавшись
представлениями теории Бора, согласно
которой электроны движутся по эллиптическим
орбитам, причем вытянутость эллипса
тем больше, чем меньше квантовое число
![]() ,
описывающее состояние электрона
(рис.1.1).
,
описывающее состояние электрона
(рис.1.1).
Рис. 1.1
При движении по вытянутым орбитам электроны могут ближе подходить к ядру и на некотором участке пути оказаться к ядру ближе, чем электроны внутренних по отношению к ним оболочек. В течение этого времени на них не сказывается экранирующее действие этих оболочек.
В результате во
многоэлектронных атомах происходит
расщепление энергетических уровней,
характеризуемых квантовым числом п,
нап– подуровней (подоболочек) с
различными значениями орбитального
квантового числа![]() .
В сложных атомах снимается вырождение
по квантовому числу
.
В сложных атомах снимается вырождение
по квантовому числу![]() .
Подуровни с
.
Подуровни с![]() =0
носят название
=0
носят название![]() – подуровней, с
– подуровней, с![]() =1
–р– подуровней,
=1
–р– подуровней,![]() =2
–
=2
–![]() – подуровней,
– подуровней,
![]() =3
–
=3
–![]() – подуровней и т.д.
– подуровней и т.д.
По мере возрастания
атомного номера элемента возрастает
не только количество подуровней во
внешней оболочке атома, но и разница в
энергиях между ними. При этом подуровни
последующей оболочки, имеющие малые
значения
![]() ,
могут оказаться ниже подуровней
предыдущей оболочки с большим значением
,
могут оказаться ниже подуровней
предыдущей оболочки с большим значением![]() .
.
Таким образом, энергия
электрона в многоэлектронном атоме
зависит от квантовых чисел п,![]() ,
,![]() (п,
(п,![]() ,
,![]() ).
Поэтому для указания состояния атома
необходимо знать квантовые числа
).
Поэтому для указания состояния атома
необходимо знать квантовые числа![]() .
В связи с этим в атомной физике используются
такие обозначения состояний атома
(терма), из которых можно определить
квантовые числа
.
В связи с этим в атомной физике используются
такие обозначения состояний атома
(терма), из которых можно определить
квантовые числа![]() .
.
В зависимости от
величины орбитального квантового числа
атома
![]() состояния обозначаются прописными
буквами:
состояния обозначаются прописными
буквами:![]()
![]() –
состояние;
–
состояние;![]() Р– состояние;
Р– состояние;![]()
![]() –
состояние и т.д.
–
состояние и т.д.
Справа внизу у этого
символа указывается значение квантового
числа
![]() для
атома, а сверху – мультиплетность
состояния, т.е. число, равное
для
атома, а сверху – мультиплетность
состояния, т.е. число, равное![]() .
.
Символическая запись данного состояния атома выглядит так:
![]() .
.
Как известно, в
химических и оптических свойствах
атомов наблюдается периодическая
зависимость от порядкового номера
элемента
![]() .
Эта периодичность может быть объяснена,
если наряду с перечисленными выше
закономерностями для описания поведения
электронов во многоэлектронных атомах
привлечь принцип Паули. Согласно этому
принципу в атоме не может находиться
двух или более электронов, у которых
значения всех четырех квантовых чисел
.
Эта периодичность может быть объяснена,
если наряду с перечисленными выше
закономерностями для описания поведения
электронов во многоэлектронных атомах
привлечь принцип Паули. Согласно этому
принципу в атоме не может находиться
двух или более электронов, у которых
значения всех четырех квантовых чисел![]() одинаковы. Принцип Паули ограничивает
число электронов, которые могут находиться
на данной электронной оболочке или
подоболочке.
одинаковы. Принцип Паули ограничивает
число электронов, которые могут находиться
на данной электронной оболочке или
подоболочке.
Очевидно, если задано
квантовое число
![]() ,
то согласно принципу Паули электроны
в данном состоянии должны отличаться
квантовыми числами
,
то согласно принципу Паули электроны
в данном состоянии должны отличаться
квантовыми числами![]() и
и![]() ,
причем
,
причем![]() принимает всего 2
принимает всего 2![]() +1 значений, для каждого из которых
возможно по два различных значения
спинового квантового числа
+1 значений, для каждого из которых
возможно по два различных значения
спинового квантового числа![]() .
.
Таким образом, в данном
энергетическом подслое число различных
возможных состояний (комбинаций чисел
![]() и
и![]() )
равно 2 (2
)
равно 2 (2![]() +1).
+1).
При заданном квантовом
числе пизменяться могут числа![]() ,
поэтому число возможных состояний
окажется равным:
,
поэтому число возможных состояний
окажется равным:
![]() .
.
В электронной оболочке
не может одновременно находиться более
чем 2п2электронов, а в подоболочке
– 2 (2![]() +1) электронов.
+1) электронов.
Распределение электронов по оболочкам и подоболочкам приведено в таблице 1.1.
Таблица 1.1
|
Cлой |
п |
|
|
|
Оболочка |
Слой |
п |
|
|
|
Оболочка |
|
К |
1 |
0 |
0 |
|
К(1S) |
N |
4 |
0 |
0 |
|
N1(4S) |
|
L |
2 |
0 |
0 |
|
L1 (2S) |
1 |
-1 0 +1 |
|
N2(4p) | ||
|
1 |
-1 0 +1 |
|
L2(2р) | ||||||||
|
2 |
-2 -1 0 +1 +2 |
|
N3(4d) | ||||||||
|
М |
3 |
0 |
0 |
|
М1(3 S) | ||||||
|
1 |
-1 0 +1 |
|
М2(3 р) |
3 |
-3 -2 -1 0 +1 +2 +3 |
|
N4(4f) | ||||
|
2 |
-2 -1 0 +1 +2 |
|
М3(3 d) |
Для
заполненных оболочек полный орбитальный
и спиновый моменты атома равны нулю, а,
следовательно, равен нулю и полный
момент атома
![]() .
В связи с этим при определении момента
любого атома полностью заполненные
оболочки можно не принимать во внимание.
.
В связи с этим при определении момента
любого атома полностью заполненные
оболочки можно не принимать во внимание.
Чтобы
задать структуру сложного атома, следует
перечислить состояния всех его электронов.
Если в состоянии с данным значением п,![]() ,
,![]() находится несколько электронов, то
запись можно упростить. Например,
электронная конфигурация для атома
водорода имеет вид:
находится несколько электронов, то
запись можно упростить. Например,
электронная конфигурация для атома
водорода имеет вид:![]() ,
для гелия –
,
для гелия –![]() ,
для лития –
,
для лития –![]()
![]() ,
для бериллия
,
для бериллия![]()
![]() и т.д.
и т.д.
В данной работе изучается атомный спектр ртути. Ртуть занимает в периодической таблице 80 место. Электроны распределяются по энергетическим уровням следующим образом:
|
п |
Обозначение уровня |
Число электронов на уровне |
|
1 |
К |
2 |
|
2 |
|
8 |
|
3 |
М |
18 |
|
4 |
|
32 |
|
5 |
О |
18 |
|
6 |
Р |
2 |
Схема электронной оболочки записывается так:
![]() ,
,
т.е. вследствие
взаимодействия электронов энергетически
более выгодным оказывается состояние
6s, а не состояния![]() и т.д., характеризуемые меньшими значениями
квантового числап, но более высокими
значениями
и т.д., характеризуемые меньшими значениями
квантового числап, но более высокими
значениями![]() (
(![]() = 2; 3; 4). Подоболочки
= 2; 3; 4). Подоболочки![]() в нормальном состоянии у ртути не
заполнены.
в нормальном состоянии у ртути не
заполнены.
В результате во внешнем
электронном слое в состоянии 6sу ртути находятся два электрона, которые
называются оптическими. Эти электроны
ответственны за физические и химические
свойства ртути. В результате квантовых
переходов этих электронов возникает
оптический спектр ртути. Спектры атомов
с двумя внешнимиs–
электронами в нормальном состоянии
являются простейшим типом сложных
спектров. Эти два внешних электрона
могут возбуждаться. Если возбуждается
один электрон, возникают спектры,
характерные для рассматриваемой группы
атомов. Если возбуждаются оба 6s– электрона, что требует значительно
большей энергии, то происходит смещение
уровней и сильное усложнение спектра.
При возбуждении одного из 6s– электронов получаются различные
двухэлектронные конфигурации, при
которых возбужденный электрон может
попасть в состояние![]() и т.д., гдеп6.
и т.д., гдеп6.
Невозбужденный электрон находится в состоянии 6, т.е. двухэлектронная конфигурация для внешних электронов имеет вид:
![]() и т.д.
и т.д.
В атоме ртути структура
термов сложнее, чем у атома водорода. В
этом случае снимается вырождение по
квантовому числу
![]() (энергетический уровень, характеризуемый
квантовым числомп, расщепляется
напподуровней, характеризуемых
квантовыми числами
(энергетический уровень, характеризуемый
квантовым числомп, расщепляется
напподуровней, характеризуемых
квантовыми числами![]() ).
Для определения полного момента импульса
атома ртути
).
Для определения полного момента импульса
атома ртути![]() необходимо учесть взаимодействие
четырех моментов – двух орбитальных и
двух спиновых, характеризующих два
внешних электрона на незаполненной 6sоболочке.
необходимо учесть взаимодействие
четырех моментов – двух орбитальных и
двух спиновых, характеризующих два
внешних электрона на незаполненной 6sоболочке.
Если орбитальные
квантовые числа этих электронов
![]() 1и
1и![]() 2,
а спиновыеs1иs2, согласно
формулам (1.10), (1.11), орбитальное квантовое
число атома
2,
а спиновыеs1иs2, согласно
формулам (1.10), (1.11), орбитальное квантовое
число атома![]() ,
спиновое квантовое число атома ртути:
,
спиновое квантовое число атома ртути:![]() .
Поскольку
.
Поскольку![]() ,
тоS принимает два
значения
,
тоS принимает два
значения![]() и
и![]() .
Полный момент атома
.
Полный момент атома![]() характеризуется
квантовым числомJ,
определяемым из равенства (1.12):
характеризуется
квантовым числомJ,
определяемым из равенства (1.12):
![]() .
.
Таким образом, для
атома ртути существует система синглентных
(одиночных) термов энергетических
состояний с
![]() и система триплетных (тройных) термов
с
и система триплетных (тройных) термов
с![]() и
и![]() .
К числу синглентных термов относятся
термы:
.
К числу синглентных термов относятся
термы:

К числу триплетов относятся термы:
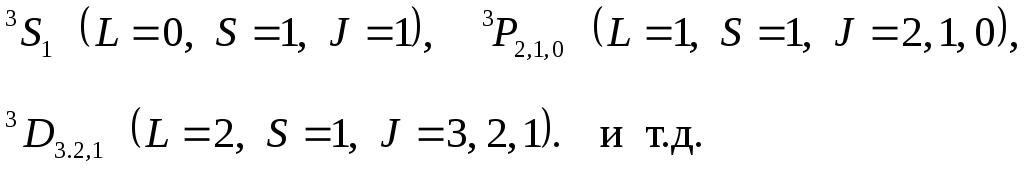
В связи со схемой термов и переходов в атоме ртути необходимо отметить, что для больших атомных номеров мультиплетное расщепление уровней из-за спина электрона имеет большие значения.
Например, для терма 63Р0, 1, 2это расщепление порядка нескольких эВ, тогда как для атома водорода дублетное расщепление терма 22Р1/2, 3/2 всего порядка 4,5410-5эВ.
Анализ спектров излучения и поглощения ртути в ультрафиолетовой, видимой и инфракрасной областях длин волн позволил составить схему возможных термов и переходов приведенную на рис. 1.2.
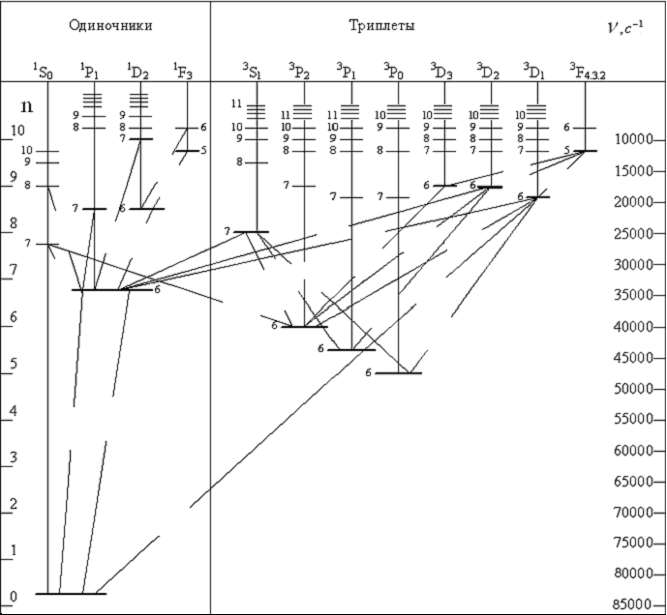

Рис. 1.2. Диаграмма энергетических уровней и переходов для атома ртути
С помощью этой схемы можно определить, каким переходам соответствует исследуемая линия ртути и записать, пользуясь атомной символикой, соответствующий переход.
Общее число линий в спектре атома ртути составляет несколько десятков. Они располагаются в инфракрасной, видимой и ультрафиолетовой областях.
На рис. 1.3 представлена схема спектральных линий атома ртути в видимой части спектра, доступных визуальному наблюдению
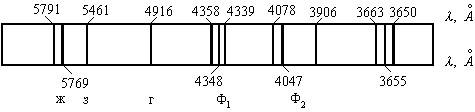
Рис.1.3.Спектр ртути
