
книги / Основы биохимии и молекулярной биологии
..pdf4.Некоторые нуклеотиды выполняют роль вторичных переносчиков (мессенджеров) регуляторных сигналов (ц-АМФ, ц-ГМФ), аллостерических регуляторов.
5.Другие нуклеотиды входят в состав коферментов ФАД, ФМН, НАД, НАДФ, служат переносчиками метильных групп (S-аденозинметионин).
6.Пиримидиновые нуклеотиды функционируют в качестве макроэргических посредников в углеводном обмене (УДФглюкоза, УДФ-галактоза), всинтезелипидов(ЦДФ-ацилглицерол).
Нуклеотид состоит из трех компонентов – азотистого основания, углевода, остатка фосфорной кислоты.
Азотистые основания, входящие в состав нуклеиновых кислот, являются производными ароматических гетероциклических соединений – пурина и пиримидина. Производные пурина – аденин (А) и гуанин (Г), а производные пиримидина – цитозин (Ц), урацил (У), тимин (T). В состав ДНК входят аденин, гуанин, цитозин, тимин; в РНК вместо тимина присутствует урацил.
Углеводным компонентом нуклеотидов являются β-D-ри- бофураноза (рибоза) в РНК и β-2'-дезокси-D-рибофураноза (дезоксирибоза) в ДНК.
Лабораторная работа № 1 Количественное определение углеводов в растительной биомассе
Цель работы – овладеть методами количественного определения содержания углеводов в растительном сырье.
Теоретические сведения В различных сортах яблок содержание углеводов может
изменяться в диапазоне 6–148 мг/г с преобладанием отдельных моносахаридов, а также сахарозы.
Исследуемый материал: яблоки нескольких сортов.
11
Реактивы:
1)0,1 н. раствор йода;
2)0,1 н. раствор натрия гидроксида;
3)10%-ный раствор серной кислоты;
4)0,1 н. раствор натрия тиосульфата;
5)1%-ный раствор крахмала;
6)10%-ный раствор соляной кислоты;
7)сода.
Оборудование:
1)плоскодонные колбы на 100 мл;
2)водяная баня с термометром;
3)воронки;
4)фильтры бумажные;
5)мерные колбы на 100 мл;
6)пипетка на 5 мл;
7)индикаторная бумага;
8)мерные колбы на 50 мл.
Ход работы Берут навеску 5 г одного из сортов яблок, помещают в кол-
бу на 100 мл, прибавляют 50 мл дистиллированной воды и экстрагируют на водяной бане при температуре 70 °С в течение 30 мин. Температуру бани не доводят до 100 °С, чтобы избежать гидролиза сахарозы, который может идти под влиянием имеющихся в яблоках кислот. По истечении времени нагревания вытяжку отфильтровывают через складчатый фильтр в мерную колбу на 100 мл. Остаток на фильтре несколько раз промывают горячей водой. Охлажденную до комнатной температуры вытяжку с промывными водами доводят водой до метки.
Отбирают пипеткой 5 мл вытяжки и определяют в ней содержание глюкозы по Вильштеттеру. Метод определения основан на окислении альдегидной группы глюкозы йодом до карбоксильной группы в присутствии фруктозы и сахарозы, которые остаются неизменными:
12
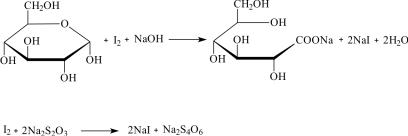
Для определения содержания глюкозы по Вильштеттеру к 5 мл исследуемого раствора прибавляют 7 мл 0,1 н. раствора йода. Через 2–3 мин при энергичном перемешивании медленно добавляют 10 мл 0,1 н. раствора натрия гидроксида и оставляют стоять 20 мин в темном месте. После этого раствор подкисляют 10%-ным раствором серной кислоты до уровня рН кислой среды и остаток йода титруют 0,1 н. раствором натрия тиосульфата в присутствии индикатора – раствора крахмала. Титрование повторяют, как минимум, три раза.
Далее 25 мл вытяжки из яблок помещают в коническую колбу, прибавляют 2 мл 10%-ной соляной кислоты и смесь выдерживают на кипящей водяной бане в течение 30 мин, затем раствор охлаждают, доводят до уровня рН нейтральной среды с помощью соды, переливают в мерную колбу на 50 мл и доводят водой до метки. Далее снова определяют содержание глюкозы по методу Вильштеттера. В этом случае будет определено суммарное количество свободной глюкозы и глюкозы, образовавшейся при гидролизе сахарозы.
Указания к составлению отчета Содержание свободной глюкозы в яблоке (мг/г) рассчиты-
вать по результатам первого титрования (до гидролиза сахарозы) по формуле
Q1 = T·(V1 – V2)·k1/m,
где Т – титр 0,1 н. раствора йода по глюкозе, равный 9 мг/мл; V1 – объем 0,1 н. раствора йода, добавленный в аликвоту иссле-
13
дуемой вытяжки до гидролиза сахарозы, мл; V2 – объем 0,1 н. раствора тиосульфата натрия, пошедший на титрование вытяжки до гидролиза сахарозы, мл; k1 – коэффициент пересчета, учитывающий соотношение объема аликвоты вытяжки, взятой на анализ, с общимобъемомвытяжки(k1 = 20); m – массанавескияблока, г.
Содержание сахарозы в яблоке (мг/г) рассчитывать совместно по результатам первого (до гидролиза сахарозы) и второго (после гидролиза сахарозы) титрований по формуле
Q2 = (T·(V3 – V4)·k2 / m – Q1)·Mс/Мг,
где V3 – объем 0,1 н. раствора йода, добавленный в аликвоту вытяжки, полученной после гидролиза сахарозы, мл; V4 – объем 0,1 н. раствора тиосульфата натрия, пошедший на титрование вытяжки, полученной после гидролиза сахарозы, мл; k2 – коэффициент пересчета, учитывающий соотношение объема аликвоты вытяжки, взятой на анализ, с общим объемом вытяжки и разведение, произведенное на стадии гидролиза сахарозы; Mс, Мг – соответственно молярные массы сахарозы и глюкозы, г/моль.
Написать уравнение реакции гидролиза сахарозы.
Лабораторная работа № 2 Качественные реакции на компоненты нуклеиновых кислот
Цель работы – сформировать навыки исследования состава нуклеиновых кислот с помощью качественного определения компонентов, образующихсяврезультатегидролизануклеопротеидов.
Теоретические сведения Для изучения состава нуклеопротеидов проводят кислот-
ный гидролиз дрожжей в присутствии серной кислоты. При непродолжительном гидролизе нуклеопротеиды распадаются на белок и нуклеиновые кислоты. При продолжительном гидролизе наступает полный распад нуклеопротеидов. С помо-
14
щью специальных реакций можно обнаружить в гидролизате составные части нуклеопротеидов. Биуретовой реакцией устанавливают наличие полипептидов. Пуриновые основания обнаруживают по образованию осадка серебряных солей, фосфорную кислоту – по реакции с молибдатом аммония, а пентозу – по пробе Троммера.
Исследуемый материал: пекарские дрожжи. Реактивы:
1)10%-ный раствор серной кислоты;
2)аммиак концентрированный;
3)2%-ный аммиачный раствор нитрата серебра (к 2%-ному раствору нитрата серебра добавляют концентрированный раствор аммиака до растворения осадка);
4)10%-ный раствор NaOH;
5)7%-ный раствор CuSO4;
6)1%-ный раствор CuSO4;
7)молибдат аммония в азотной кислоте (7,5 г молибдата аммония растворяют в 100 мл воды и добавляют 100 мл 32%- ного раствора азотной кислоты; полное растворение молибдата аммония происходит после добавления азотной кислоты);
8)1%-ныйраствораскорбиновойкислотына1МраствореHCl.
Оборудование:
1)большая пробирка или круглодонная колба с пробкой,
вкоторую вставлена длинная стеклянная трубка;
2)песчаная баня;
3)штатив с пробирками;
4)пипетки;
5)индикаторная бумага.
Ход работы Помещают 1 г пекарских дрожжей в большую пробирку
или круглодонную колбу, добавляют 20 мл 10%-ного раствора серной кислоты и 20 мл дистиллированной воды, закрывают
15

пробкой с длинной стеклянной трубкой и кипятят под тягой в течение часа. После прекращения кипячения охлаждают, фильтруют. С фильтратом проделывают качественные реакции на составные части нуклеопротеидов.
1. Серебряная проба на пуриновые основания
Метод основан на способности пуриновых оснований образовывать с аммиачным раствором нитрата серебра осадок серебряных солей пуриновых оснований, окрашенных в светлокоричневый цвет. Например, используется следующая реакция:
|
OH |
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
AgNO3 NH4OH |
|
N |
|
|
|
N |
NH4NO3 |
H2O |
||||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H2N N NH |
|
|
|
H2N N |
|
N |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ag |
|
|
||||
|
гуанин |
|
|
|
|
серебряная соль гуанина |
|
|||||||||||||
Нейтрализуют 10 капель гидролизата 1 каплей концентрированного аммиака и добавляют 5 капель 2%-ного аммиачного раствора нитрата серебра. Через 3–5 мин выпадает небольшой бурый осадок серебряных производных пуриновых оснований.
2. Проба Троммера на пентозы
Метод основан на окислении альдегидной группы рибозы и дезоксирибозы до карбоксильной, при этом гидроксид меди (II) восстанавливается в гидроксид или оксид меди (I) и выпадает в осадок. Для рибозы схема процесса имеет вид:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2
рибоза |
рибоновая кислота |
2CuOH → H2O + Cu2O↓
16
К 10 каплям гидролизата добавляют 5 капель 10%-ного раствора NaOH до щелочной среды и добавляют по каплям 7%-ный раствор сульфата меди CuSO4 до появления голубой мути, далее пробирку нагревают до кипения, при этом выпадает желтый осадокCuOH иликрасныйосадокCu2O.
Внимание! Избыток CuSO4 мешает реакции, так как образующийся гидроксид меди Cu(OH)2 при нагревании дает оксид меди (II) CuO черного цвета.
3. Молибденовая проба на фосфорную кислоту
Метод основан на обнаружении фосфорной кислоты по реакции с молибдатом аммония, в результате которой образуется фосфомолибденовый комплекс, который, в свою очередь, под действием восстановителей (аскорбиновая кислота) переходит в молибденовую синь:
H3PO4 +2(NH4)2MoO4 + 21HNO3 →
→ (NH4)3(PO4·12MoO3) + 21NH4NO3 + 12H2O
Берут 10 капель гидролизата, добавляют 10 капель раствора молибдата аммония, перемешивают содержимое встряхиванием и наливают 10 капель раствора аскорбиновой кислоты. Вновь перемешивают и оставляют стоять до развития специфического окрашивания.
4. Биуретовая реакция на белок
К 5 каплям гидролизата добавляют 10 капель 10%-ного раствора NaOH до щелочной среды (проверить рН) и прибавляют 1 каплю 1%-ного раствора CuSO4. В пробирке наблюдается характерное сине-фиолетовое окрашивание.
Указания к составлению отчета При составлении отчета написать схему полного распада
нуклеопротеидов, химические формулы нуклеотидов и их компонентов.
17
Вопросы для самостоятельной работы к разделу «Углеводы и нуклеиновые кислоты»
1.Какие свойства глюкозы положены в основу метода определения ее содержания?
2.Почему для определения содержания сахарозы необходим ее гидролиз?
3.Какие органические соединения, кроме углеводов, находятся в яблоке?
4.Почему реакция Троммера не является специфичной для глюкозы?
5.Как вы думаете, можно ли применять реакцию Троммера для определения содержания глюкозы в крови? Почему?
6.Напишите реакцию окисления глюкозы до глюкуроновой кислоты.
7.Крахмал, гликоген и целлюлоза являются полимерами глюкозы. Будет ли синее окрашивание с йодом у гликогена и целлюлозы? Почему?
8.Какие белки входят в состав нуклеопротеидов и в чем состоит их особенность?
9.Какие типы нуклеиновых кислот вы знаете и какова их биологическая роль?
10.Какие углеводы и азотистые основания входят в состав ДНК и РНК?
11.Напишите формулу динуклеотида, образованного за счет 3′,5′-фосфодиэфирной связи.
12.Какие ферменты расщепляют нуклеиновые кислоты?
13.Напишите параллельную цепь ДНК для участка: ААТЦЦГТТАТГГ. Укажите триплеты.
14.Напишите последовательность цепи мРНК, синтезированной при использовании в качестве матрицы участка ДНК: ЦЦТГАТАЦЦТГА.
15.Напишите уравнение реакции гидролиза мононуклеотида, образованного рибозой, аденином и остатком фосфорной кислоты.
18
Раздел II. ВИТАМИНЫ
Витаминами называют низкомолекулярные органические вещества различной химической природы, необходимые для обеспечения нормального протекания биохимических и физиологических процессов в организме. При этом витамины не включаются в структуру тканей и не используются в организме в качестве источника энергии. Они условно объединены в одну группу по признаку жизненной необходимости для организма. Поскольку в организме человека и животных витамины не синтезируются, за исключением некоторых из них, образующихся симбиотической микрофлорой пищеварительного тракта, они относятся к незаменимым факторам питания. Поступая в организм в небольших количествах с пищей, витамины обеспечивают нормальное протекание биохимических процессов и таким образом участвуют в регуляции многих метаболическихфункцийорганизма.
Биологическая роль большинства витаминов заключается в том, что многие из них входят в состав коферментов (простетических групп) ферментов. Недостаточное поступление витаминов с пищей, а также нарушение их всасывания в организме приводит к развитию тяжелых нарушений обмена веществ: авитаминозам и гиповитаминозам.
Заболевание, возникающее в результате отсутствия того или иного витамина, называют авитаминозом. При относительной недостаточности какого-либо витамина наблюдается гиповитаминоз. Поскольку функции витаминов тесно связаны между собой, то обычно наблюдаются полиавитаминозы или полигиповитаминозы. Авитаминозы встречаются достаточно редко; чаще встречаются гиповитаминозы как результат нерационального питания, нарушения обмена веществ или перенесенных заболеваний и лекарственнойтерапии(антибиотиковисульфамидов).
Избыточный прием ряда витаминов приводит к нарушениям метаболических функций – гипервитаминозу.
Эти особенности влияния витаминов на организм послужили основанием для их комбинированного применения как в
19
профилактических, так и в лечебных целях в виде так называемых поливитаминных препаратов.
Простейшая классификация витаминов основана на их фи- зико-химических свойствах, в частности на растворимости. По этому признаку витамины делят на две группы:
а) витамины, растворимые в воде; б) витамины, растворимые в жирах и органических раство-
рителях.
К водорастворимым витаминам относятся витамины груп-
пы В (В1, В2, В6, В9, В12), витамин С, витамин Р, витамин РР, витамин Н, пантотеновая кислота и витаминоподобные вещества:
холин, инозит, пангамовая, липоевая, парааминобензойная кислоты, витамин U, коэнзим Q. К жирорастворимым витаминам относятся витамины группы А, витамины группы D, витамины группы Е, витамины группы K, непредельные жирные кислоты, имеющие две и более двойных связи.
Антивитамины – вещества, уменьшающие биологическую активность ферментов, – являются или структурными аналогами витаминов и конкурентно препятствуют образованию активных формферментов, илиферментами, разрушающимивитамины.
Для обнаружения витаминов в пищевых продуктах или других биологических объектах обычно пользуются качественными реакциями, основанныминавозникновениихарактернойцветнойреакции какого-либовитаминассоответствующимхимическимреактивом.
Лабораторная работа № 3 Качественные реакции на витамины
Цель работы – приобрести навыки качественного определения витаминов, необходимые для проведения анализов биологических материалов.
Исследуемый материал:
1)рыбий жир;
2)0,05%-ный раствор викасола;
20
