
6613
.pdf2.Определение интенсивности клеточного дыхания в условиях загрязнения окружающей среды.
3.Изучение активности ферменов в различных экологических условиях.
4.Влияние токсикантов на прорастание семян.
5.Электромагнитное загрязнение ОПР (методы контроля).
6.Шумовое воздействие на организм человека.
7.Воздействие физических полей на жизнедеятельность организмов.
8.Влияние экологических факторов на активность фермента пероксидазы.
4.4. Примеры методик и фрагментов текстов курсовой курсовой работы
Тема: Влияние физических факторов (температуры) на активность α-амилазы слюны
1.Оборудование: электрическая плитка, химические стаканы, колбы, термостойкая колба, тер-
мометр, водяная баня, пипетка, мензурка.
2.Реактивы: крахмал, раствор йода.
3.Приготовление раствора крахмала:
4.В термостойкую колбу добавляем 200 мл воды. В нее же добавляем 2 г крахмала. Доводим смесь до кипения и кипятим несколько минут. Таким образом получаем 1% раствор крахмала.
5.Приготовление раствора слюны:
6.50 мл воды полощем во рту в течение 3-4 минут.
7.Проведение эксперимента:
8.В три пробирки добавляем по 25 мл раствора крахмала и каплю йода. Раствор крахмала окра-
шивается в интенсивно синюю окраску. Нагреваем электрическую плитку и измеряем темпера-
туру водяной бани. В течение 8-10 минут даем время, чтобы температура водяной бани и тем-
пература раствора в пробирках уравнялась. Снова измеряем температуру водяной бани. Добав-
ляем в раствор 5 мл раствора слюны и включаем секундомер. Отмечаем время исчезновения синей окраски. Затем в следующие три пробирки добавляем раствор крахмала и каплю раство-
ра йода, охлаждаем водяную баню и повторяем процедуру при более низкой температуре.
9.Результаты эксперимента приведены в таблице:
t, C° |
22 |
|
30 |
34 |
37 |
40 |
45 |
58 |
||
|
|
|
|
|
|
|
|
|
|
|
t1 |
11 |
мин |
7 |
мин |
3 мин |
3 мин |
4 |
мин |
5 мин |
6 мин |
|
17 |
сек |
5 |
сек |
56 сек |
16 сек |
6 |
сек |
13 сек |
57 сек |
|
|
|
|
|
|
|
|
|
|
|
21
t2 |
11 |
мин |
7 |
мин |
4 |
мин |
3 мин |
4 |
мин |
5 |
мин |
6 |
мин |
|
22 |
сек |
13 сек |
6 |
сек |
23 сек |
16 сек |
5 |
сек |
55 сек |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t3 |
11 |
мин |
7 |
мин |
4 |
мин |
3 мин |
4 |
мин |
5 |
мин |
7 |
мин |
|
23 |
сек |
9 |
сек |
|
|
21 сек |
8 |
сек |
11 сек |
3 |
сек |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
tср |
11 |
мин |
7 |
мин |
4 |
мин |
3 мин |
4 |
мин |
5 |
мин |
6 |
мин |
|
21 |
сек |
9 |
сек |
1 |
сек |
20 сек |
10 сек |
10 сек |
58 сек |
|||
|
|
|
|
|
|
|
|
|
|||||
tc° |
22 |
|
30 |
34 |
37 |
40 |
45 |
58 |
|||||
|
|
|
|
|
|
|
|
||||||
1/t, |
0,088 |
0,14 |
0,25 |
0,24 |
0,195 |
0,195 |
0,143 |
||||||
мин-1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10.Можно видеть, что кривая имеет колокообразный характер с максимумом при температуре 37
С°. Это подтверждает белковое строение α-амилазы, так как при использовании неорганиче-
ских катализаторов скорость при повышении температуры постоянно возрастает. Так же мож-
но видеть, что в нейтральной среде оптимальная работа фермента происходит при 37 С°, что совпадает с температурой человека.
Тема: Влияние циркадных ритмов на суточную динамику активности амилазы
Практическая часть
1. Действие амилазы на сырой и вареный крахмал Крахмал – главный резервный полисахарид растений. Бесцветное аморфное вещество, не раствори-
мое в холодной воде, диэтиловом эфире, этаноле, в горячей воде образует клейстер. В зернах крах-
мала содержаться 98-99,5% полисахаридов и 0,5-2% неуглеводных компонентов (в т.ч. липиды, бел-
ки, зольные элементы). Крахмал представляет собой смесь линейного (амилозы) и разветвленного
(амилопектина) полисахаридов. Амилоза построена главным образом из остаткова-D-
глюкопиранозы с 1:4 – связями. В зависимости от вида растения молекулярная масса амилозы ко-
леблется от 150 тыс. ( рисовый, кукурузный крахмал). Молекулы амилопектина сильно разветвлены и состоят из фрагментов амилозы ( около 20 моносахаридных остатков), связанных между собой а- 1:6 – связями. Молекулярная масса 106-109. В воде амилопектин, так же как амилоза, образует ми-
целлярные растворы.
22
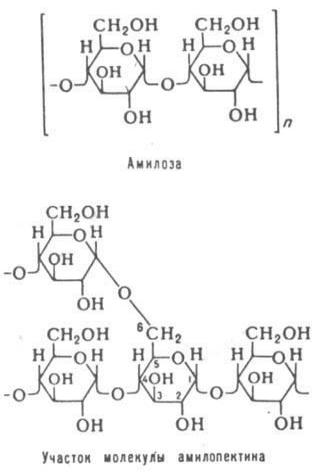
Рисунок 5. Модель структуры амилозы и амилопектина.
Соотношение амилозы и амилопектина в крахмале зависит от вида растения и стадии его развития.
В среднем, крахмал содержит 15-25% и 75-86% амилопектина.
По химическим свойствам крахмал – типичный представитель полисахаридов. В обычных усло-
виях крахмал образует по гидроксильным группам простые или сложные эфиры и окисляется соля-
ми йодной кислоты. С иодидом и полярными органическими веществами крахмал образует соеди-
нения включения (клатраты). Такие соединения с иодом окрашены в характерные цвета – синий для амилозы и красный для амилопектина. Молекулы амилозы в этих комплексах образуют вокруг мо-
лекулы йода спираль, каждый виток которой содержит 6 остатков глюкозы.
При расщеплении молекулы крахмала образуются более простые углеводы – декстрины, мальто-
за, глюкоза. Этот процесс называется осахариванием. При действии ферментов или нагревании с кислотами подвергается гидролизу:
(С6H10O5)n + nH2O-H2SO4→nС6H12O6
Амилазы – ферменты, ускоряющие реакцию гидролиза крахмала. Они содержатся в тканях жи-
вотных и растений, микроорганизмов, слюне, молоке, крови и др. жидкостях организма. Высокой амилазной активностью обладают слюна и солод.
23
Слюна и другие пищеварительные соки животных и человека, являются концентрированными растворами ферментов. В слюне содержится α-амилаза – фермент, гидролизующий крахмал.
Известны три вида амилаз, которые различаются главным образом по конечным продуктам их ферментативного действия: α-амилаза, β-амилаза, γ-амилаза. Α-амилаза отщепляет один за другим глюкозные остатки от конца полигликоизидной цепочки.
Амилаза слюны является α-амилазой. Под влиянием этого фермента происходят первые фазы распада крахмала. Процесс расщепления макромолекул крахмала водой идет постепенно. Сначала образуются промежуточные продукты с меньшей молекулярной массой, чем у крахмала, - декстри-
ны, затем изомер сахарозы – мальтоза. Образующаяся мальтоза оказывается только временным про-
дуктом, так как она быстро гидролизуется под влиянием фермента мальтазы (α-глюкозидазы) на 2
молекулы глюкозы.
Податливость субстрата к действию фермента получила название атакуемости. Атакуемость крах-
мала амилазами зависит от степени повреждения структуры крахмального зерна. Неповрежденные или механически поврежденные крахмальные зерна довольно устойчивы к действию амилазы,
оклейстеренный крахмал (варенный) расщепляется амилазами с большей скоростью. Резервный крахмал семян, зерен злаковых и клубней гидролизуется только после набухания (обводнения). [10]
1.1 Материалы и оборудование Для проведения практической работы потребовались следующие реактивы: вода дистиллированная;
раствор йода в йодиде калия; растворы с массовыми долями: оклейстеренного крахмала 2 %; сырого крахмала 2 %; слюна разбавленная.
1.2 Ход работы.
Берут две пробирки. В одну вносят 5 мл раствора оклейстеренного крахмала, в другую – 5 мл рас-
твора сырого крахмала ( содержимое флакона перед отбором пробы тщательно перемешивают). В каж-
дую пробирку добавляют по 1 мл разбавленной (1:1) слюны. Опыт проводят в 8.00, 12.00, 16.00, 20.00
часов и наблюдают изменения атакуемостифермента слюны амилазы в зависимости от времен суток.
Методика приготовления разбавленной слюны:
Рот ополаскивают 2-3 раза водой для удаления остатков пищи. Отмеряют цилиндром 50 мл дистил-
лированной воды и ополаскивают ею рот в течение 3-5 минут в несколько приемов. Собранную жид-
кость фильтруют через вату, и фильтрат используют для работы.
Содержимое перемешивают (т.е. слюну и крахмал), и в пробирки добавляют по 3 капли раствора йо-
да, содержимое хорошо перемешивают и по результатам опыта дают делают вывод. [11]
В результате при добавлении йода в пробирку в вареным крахмалом произошло интенсивное окра-
шивание раствора в синий цвет. При добавлении йода в пробирку с сырым крахмалом произошло окра-
шивание в желтый цвет. Однако по истечению некоторого времени раствор частично окрасился в синий
24
цвет, это окрашивание было непосредственно на дне пробирки, где осел не растворившийся крахмал.
Результаты и их обсуждение
1. Процесс приготовления реактивов Была проведена работа по определению действия фермента слюны амилазы на сырой и вареный
крахмал. Для этого был приготовлен раствор разбавленной слюны (1:1) следующим образом: рот опо-
ласкивают 2-3 раза водой для удаления остатков пищи, далее цилиндром было отмерено 50 мл дистил-
лированной воды и ополаскивали рот в течение 3-5 минут. Собранную жидкость была профильтрована через вату, и фильтрат использовался для работы.
Раствор сырого крахмала готовим путем добавления к 100 мг крахмала 50 мл горячей воды. В ре-
зультате произошло осаждение крахмала, так как он не растворяется в воде.
Раствор вареного крахмала готовили путем добавления к 100 мг крахмала 50 мл горячей воды. В ре-
зультате крахмал разбух в горячей воде и образовался вязкий коллоидный раствор – клейстер.
После приготовления этих растворов были взяты две пробирки. В одну внесли 5 мл раствора оклей-
стеренного крахмала, в другую – 5 мл раствора сырого крахмала и в каждую пробирку добавили по 1 мл разбавленной (1:1) слюны. Затем содержимое перемешали и добавили по 3 капли раствора йода.
2. Результаты работы При добавлении йода в вареный крахмал раствор приобрел интенсивно синий цвет. Однако окраши-
вание произошло не полностью. На дне пробирки остались хлопья вареного крахмала. Через некоторое время весь раствор приобрел синее окрашивание.
При добавлении йода в раствор с сырым крахмалом содержимое пробирки приобрело желтоватый оттенок. На дне пробирки образовался осадок крахмала, так как он не растворим в холодной воде. Через несколько минут раствор начал приобретать синюю окраску.
Интенсивность окрашивания раствора с сырым и вареным крахмалом зависит от податливости крах-
мала к действию фермента (атакуемости). Атакуемость крахмала амилазами зависит от степени повре-
ждения структуры крахмального зерна. Неповрежденные или механически поврежденные крахмальные зерна довольно устойчивы к действию амилазы, оклейстеренный крахмал (вареный) расщепляется ами-
лазами с большей скоростью.
Раствор сырого крахмала пробрел синюю окраску через некоторое время после добавления йода, так как неповрежденные крахмальные зерна устойчивы к действию амилазы и расщепление происходило с меньшей скоростью по сравнению с раствором, в котором находился вареный крахмал.
Раствор с вареным крахмалом сразу после добавления йода окрасился в синий цвет. Это доказывает,
что ферменты амилазы расщепляют вареный крахмал с большей скоростью, чем сырые крахмальные зерна.
Опыт проводили в 8.00, 12.00, 16.00, 20.00 часов и наблюдали изменения атакуемости фермента слю-
25
ны амилазы в зависимости от времен суток. Эти изменения можно увидеть на графиках.
На графиках представлено действие амилазы на сырой и вареный крахмал в зависимости от времени суток. По горизонтальной оси указано время суток в которое проводились исследования, по вертикаль-
ной показано время, за которое раствор с сырым и вареным крахмалом приобрел синее окрашивание.
Если сравнить графики, то из них видно, что раствор с вареным крахмалом после добавления йода окрашивается в синий цвет быстрее, чем раствор с сырым крахмалом. Это связано с тем, что ферменты амилазы расщепляют вареный крахмал с большей скоростью, чем сырые крахмальные зерна.
Из полученных результатов можно сделать вывод, что утром (8.00 ч.) атакуемость фермента слюны амилазы минимальна, так как слюна утром еще не смешана с пищевыми ферментами. Натощак пищева-
рительная система находится в состоянии периодической функциональной ( моторной и секреторной)
активности. В обеденный период (12.00 ч.) скорость расщепления амилазами крахмала достигает своей максимальной величины. Вероятно, это связано с тем, что в обед организм наиболее нуждается в энер-
гии, следовательно, и в пище, поэтому процесс пищеварения происходит быстрее. В 16.00 атакуемость амилаз уменьшается по сравнению и обеденным периодом. В 20.00 скорость расщепления амилазами крахмала становится еще более меленной. Это происходит из-за того, что организм вечером начинает готовиться ко сну и все пищеварительные процессы замедляются.
4.3Учебно-методическое обеспечение самостоятельной работы
1.Барышева Е. С.. Биохимия : Учебное пособие. / Барышева Е. С. ; Е. С. Барышева. – Оренбург :
Оренбургский государственный университет, ЭБС АСВ, 2017. – 142 с. – URL: URL: http://www.iprbookshop.ru/78767.html. – ISBN ISBN 978-5-7410-1888-0.
2. Димитриев А. Д.. Биохимия : Учебное пособие. / Димитриев А. Д. ; А. Д. Димитриев. – Сара-
тов : Вузовское образование, 2018. – 111 с. – URL: URL: http://www.iprbookshop.ru/74956.html. – ISBN ISBN 978-5-4487-0165-8.
3. Физиология и биохимия сельскохозяйственных растений : учеб. для студентов вузов по агрон.
спец.. / под ред. Н. Н. Третьякова. – Москва : Колос, 1998. – 640 с. – ISBN ISBN 5-10-002915-3.
4. Биохимия: практикум : учебно-методическое пособие. / Борисова, Г. Г., Чукина, Н. В., Киселе-
ва, И. С., Малева, М. Г., Борисовой, Г. Г. ; Г. Г. Борисова, Н. В. Чукина, И. С. Киселева, М. Г. Малева;
под редакцией Г. Г. Борисовой. – Екатеринбург : Издательство Уральского университета, 2017. – 116 с.
– URL: URL: http://www.iprbookshop.ru/106349.html. – ISBN ISBN 978-5-7996-2057-8.
26

М.А. Патова.
Биохимия, биофизика и физико-химические основы жизнедеятельности
Учебно-методическое пособие по подготовке к лекционным и практическим занятиям
(включая рекомендации по организации самостоятельной работы и выполнению курсовых работ)
Федеральное государственное бюджетное образовательное учреждение высшего образования «Нижегородский государственный архитектурно-строительный университет»
603950, Нижний Новгород, ул. Ильинская, 65. http://www. nngasu.ru, srec@nngasu.ru
