
- •Методы электронной спектроскопии
- ••Спектроскопия — разделы физики и аналитической химии, посвящённые изучению спектров взаимодействия излучения (в
- •Электромагнитный спектр
- ••Прямая задача спектроскопии —
- ••Атомный и молекулярный спектральные анализы позволяют определять элементный и молекулярный состав вещества, соответственно.
- •Вид спектров
- ••Фраунгоферовы линии— это узкие полоски,
- •Спектральный терм-это группа энергетических состояний, характеризуемая одними и теми же величинами L и
- •Взаимное расположение термов одной электронной конфигурации определяется
- •Вероятность перехода атома из одного
- ••Линии, обусловленные переходом электрона на основной уровень, принято называть резонансными. Особое аналитическое значение
- •Основные узлы приборов в АЭС
- •Источники возбуждения спектров
- •Диспергирующий элемент
- •Приемники излучения
- •От способа оценки интенсивности
- •Содержание
- •Стилоскоп универсальный СЛУ
- •• Ширина спектральной линии(δλ или δν) -
- •Количественный анализ
Методы электронной спектроскопии
Эмиссионный спектральный анализ
•Спектроскопия — разделы физики и аналитической химии, посвящённые изучению спектров взаимодействия излучения (в том числе, электромагнитного излучения, акустических волн и др.) с веществом. В физике спектроскопические методы используются для изучения всевозможных свойств этих взаимодействий. В аналитической химии — для обнаружения и определения веществ при помощи измерения их характеристических спектров, то есть методами спектрометрии. К существенным преимуществам спектроскопии можно отнести возможность диагностики in situ, то есть непосредственно в «среде обитания» объекта, бесконтактно, дистанционно, без какой-либо специальной подготовки объекта. Поэтому она получила широкое развитие, например, в астрономии.
•По объектам исследования можно выделить следующие виды спектроскопии: атомная спектроскопия, молекулярная спектроскопия, масс-спектроскопия, ядерная спектроскопия (ЯМР. ЭПР, ОЭС) и другие.
•По типу излучения, которое используется в спектроскопии, её можно разделить на оптическую спектроскопию, рентгеновскую спектроскопию, фотоэлектронную спектроскопию, Мёссбауэровскую спектроскопию, масс- спектроскопию, спектроскопию с использованием радиоизлучения (γ-спектроскопия)и т. д.
Электромагнитный спектр
Излучение |
λ, нм |
Е, эв |
γ-Лучи |
0.1-10-4 |
~ 107 |
Рентгеновские |
10-10-2 |
~ 105 |
лучи |
|
|
Ультрафиолетовое |
10-400 |
~ 10 |
Видимый свет |
400-760 |
|
Инфракрасное |
760- 106 |
~ 10-1 |
Микроволновое |
10-3- 1м |
~ 10-3 |
или СВЧ |
|
|
Радиоволны |
> 1м |
~ 10-6 |
Процессы, происходящие при поглощении или излучении
Изменения в энергетическом состоянии ядер (спектроскопия γ-резонанса)
Изменения в энергетическом состоянии внутренних электронов атомов (рентгеноспектроскопия)
Изменение энергетического состояния внешних электронов (электронная спектроскопия)
Колебание атомов в молекуле (ИК- спектроскопия)
Колебание атомов в кристаллической решетке; изменение вращательного энергетического состояния (ЭПР)
Изменение энергетического состояния спинов ядер и электронов (спектроскопия ЯМР и ОЖЕ-спектроскопия)
•Прямая задача спектроскопии —
предсказание вида спектра вещества исходя из знаний о его строении, составе и прочем.
•Обратная задача спектроскопии —
определение характеристик вещества (не являющихся непосредственно наблюдаемыми величинами) по свойствам его спектров (которые наблюдаются непосредственно и напрямую зависят как от определяемых характеристик, так и от внешних факторов).
•Атомный и молекулярный спектральные анализы позволяют определять элементный и молекулярный состав вещества, соответственно. В эмиссионном и абсорбционном методах состав определяется по спектрам испускания и поглощения.
• |
M* → M + hν |
(эмиссия) |
• |
M + hν → M* |
(абсорбция) |
• |
Эмиссионно-спектральный анализ (ЭСА) |
|
|
является методом определения содержания |
|
|
элементов по характеристическому |
|
линейчатому спектру испускания (эмиссии) свободных, нейтральных или ионизованных атомов химического элемента в оптическом диапазоне электромагнитных волн. С его помощью
можно анализировать твердые, жидкие и газообразные вещества более 70 элементов(и радиоактивных).
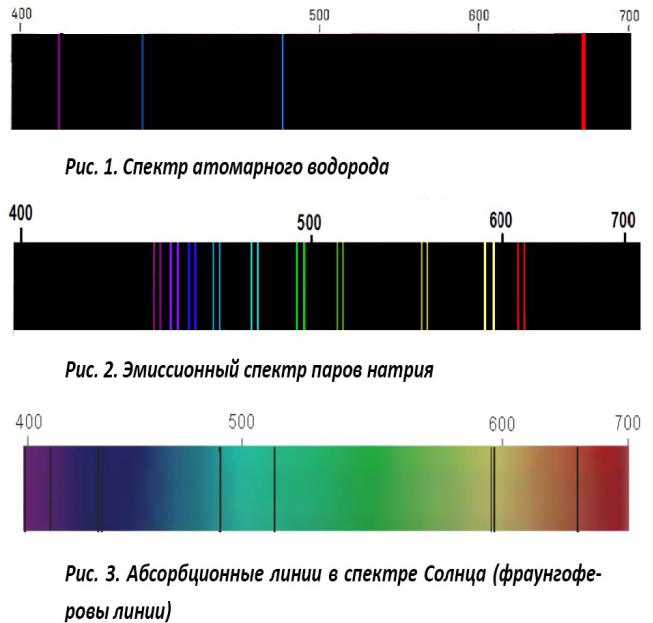
Вид спектров
•Фраунгоферовы линии— это узкие полоски,
пересекающие солнечный спектр.
•Фраунгоферовы линии были открыты немецким ученым Фраунгофером в 1802 г. Они играют большую роль в целях ориентировки. Благодаря им весь спектр разделяется на -определенные участки, а это способствует определению места нахождения исследуемых полос или линий. Определение длины волн, соответствующих разным цветным лучам, Фраунгофер произвел при помощи диффракционной решотки, и поэтому, наблюдая солнечный спектр по Фраунгоферовым линиям, можно определять не только место расположения полосы, но и сами длины 'волн.
Е0 , Е1 , Е2 , Еn |
Еi - Еn |
= hν (10-7-10-8 с.) λ = c/ν |
|
(нм, мкм , Å), ΔЕ=hν(эВ). |
|
||
ν= Еi – Еn / h (с-1), |
ν/= Еi – Еn / ch |
ν/= = |
|
ν/c (см-1), |
|
|
|
•1. Главное квантовое число п (п = 1-7 для атомов в основном состоянии) соответствует уровням, обозначаемым К, L, M, ... Q, и характеризует удаленность электрона от ядра.
•2. Квантовое число орбитального углового момента l (l<п, l = 0,1,2,...)( L –для атома) соответствует подуровням s, p, d, f и связано с пространственным распределением электронной плотности. (S,P,D,F –для атома)
•3. Орбитальное магнитное квантовое число ml (любое целое, удовлетворяющее условию - l < ml < +l). ml = 0; ±1; …±l -всего(2l+1)
•4. Спиновое квантовое число ms (ms = ±1/2).
Спектральный терм-это группа энергетических состояний, характеризуемая одними и теми же величинами L и S и имеющих близкую энергию
L - суммарный орбитальный момент атома
S- суммарный спин атома М=2S+1 -мультиплетность терма.
S s |
L l |
|
J L S |
|
полный угловой |
|
|
момент |
|
|
|
|
|
|
|
S=0-синглет;S=1/2-дублет; S= 1-ТРИПЛЕТ |
2S 1 |
L j |
|||||
|
|
|
|
|
|
||
|
|
|
|
|
Обозначение терма- |
||
L = 0, 1, 2, 3, 4, - обозначаются S, P, D, F, G |
|
||||||
2 |
2 |
|
3; S |
3 P |
- означают терм дублетного |
||
3 S1/ 2 |
3 |
P3/ 2 |
2 |
2 |
|
|
|
расщепления с L=1/1,2 S= 1/2, J= 1/2 и 3/2. перед символом терма указывается главное квантовое число n, например,
для Na.
32S1/ 2
Взаимное расположение термов одной электронной конфигурации определяется
правилами Хунда:
• 1. Основное, т. е. низшее, энергетическое состояние имеет наибольшее значение суммарного спина М (мультиплетности).
• 2. Среди термов с максимальной мультиплетностью низшим является тот, у которого наибольшее значение L.
• 3. Низшим компонентом мультиплета будет J = L – S, если уровень заполнен меньше чем наполовину, и J = L + S, если он заполнен больше чем наполовину.
