
- •Электрохимические методы анализа
- ••Методы анализа, основанные на
- •• Идея метода:- явление поляризации
- ••Зависимость тока I от приложенного напряжения Е при обратимом электродном процессе передается уравнением
- •• Количественный полярографический анализ
- •Потенциометрический метод анализа
- ••R - универсальная газовая постоянная, равная
- •Классификация электродов.
- ••К электродам второго рода относятся
- •Электроды для измерения рН
- ••Окислительно - восстановительным электродом является хингидронный электрод (хингидрон - смесь органического
- •1 – полый шарик из электродного стекла; 2 – стеклянный электрод; 3 –
- ••Согласно уравнению Нернста
- •Ионоселективные
- ••Ионоселективные электроды (ИСЭ), представляет
- •Типы ионоселективных электродов
- ••Электроды с твердыми мембранами
- •Уравнение Никольского - Эйземана
- •Характеристики ионоселективных электродов
- •Кондуктометрия
- ••Величину, обратную удельному
- ••Эквивалентной электрической проводимостью называют проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося
- ••Методы прямой кондуктометрии основываются на том,
- ••В методах кондуктометрического титрования измеряют электрическую проводимость раствора после добавления небольших определенных порций
- ••Токи, имеющие частоту порядка мегагерц и десятков мегагерц, называют токами высокой частоты. При
- •Кулонометрия
- ••Суть законов Фарадея заключается в том, что для выделения одного моля эквивалента любого
- ••Различают два основных вида
- ••Кулонометрические определения могут
- ••Определение точки эквивалентности можно
- ••Установка для кулонометрического титрования при
- ••Силу тока или разность потенциалов
Электрохимические методы анализа
Полярографический
анализ
•Методы анализа, основанные на
расшифровке поляризационных кривых (вольтамперограмм), получаемых в электролитической ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения, называют
вольтамперометрическим.
•В качестве поляризующегося
микроэлектрода
применяют ртутный капельный элек трод, а сам метод называют в этом
случае полярографией, следуя
• Идея метода:- явление поляризации
Электрический ток может возникать под действием приложенной к системе электроды-электролит внешней разности потенциалов.
Изменение электрического состояния электрода (его потенциала) под действием электрического тока, проходящего через границу электрод-электролит называется
поляризацией электрода.
При поляризации потенциал электрода изменяется по сравнению с тем равновесным значением, которое наблюдалось в данном растворе у электрода при отсутствии тока
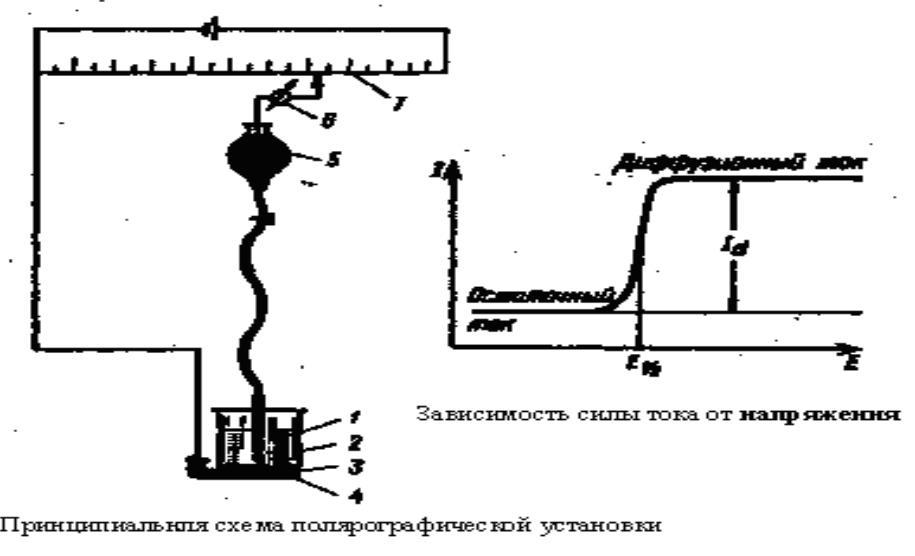
•Зависимость тока I от приложенного напряжения Е при обратимом электродном процессе передается уравнением полярографической волны:
Е = Е1/2 + (R T / n F) ln ( Id – I ) / I, (1)
Где Е1/2 – потенциал полуволны; Id – диффузионный ток.
При I = Id / 2 уравнение (1) переходит в
Е = Е1/2 . (2)
• |
Это соотношение показывает независимость потенциала |
|
|
|
полуволны от тока и, следовательно, от концентрации |
|
восстанавливающегося иона. Потенциал полуволны является, |
|
таким образом, качественной характеристикой иона в |
|
растворе данного фонового электролита, и определение |
|
потенциала полуволны составляет основу качественного |
|
полярографического анализа. |
•
• Количественный полярографический анализ
основан на уравнении Ильковича, которое
связывает диффузионный ток Id с концентрацией |
|
иона с и рядом других величин: |
|
Id = 605 z D1/2 m 2/3 t1/6 c |
(3) |
Где z - заряд иона; D – коэффициент диффузии; m – масса ртути, вытекающей из капилляра за 1 с, мг; t – время образования капли (периода капания), с.
В практике количественного полярографического анализа коэффициент пропорциональности межу концентрацией вещества и силой диффузионного тока обычно устанавливают с помощью стандартных растворов. При постоянных условиях полярографирования D, m, и t постоянны, поэтому уравнение (3) переходит в
Id = k c . (4)
Потенциометрический метод анализа
Потенциометрические методы основаны на измерении разности потенциалов индикаторного электрода и электрода сравнения или, точнее,электродвижущих сил (ЭДС) различных цепей, поскольку экспериментально измеряется именно ЭДС, являющаяся разностью потенциалов.
Равновесный потенциал индикаторного электрода связан с активностью и концентрацией веществ, участвующих в электродном процессе,уравнением Нернста:
•
Е = Е° + R T/(n F) ln (аокис/авосст)
Е = Е° + R T /(n F) ln ([окисл] үокисл / ([восст] үвосст)),
•R - универсальная газовая постоянная, равная
8,31 Дж/(моль . К); Т - абсолютная температура; F- постоянная Фарадея (96500 Кл/моль); n - число электронов, принимающих участие в электродной реакции; аокис, авосст - активности соответственно окисленной и восстановленной форм редокс- системы; [окисл] и [восст] - их молярные концентрации; үокис, үвосст - коэффициенты активности; Е° - стандартный потенциал редокс- системы.
• |
Подставляя Т = 298,15 К и числовые |
|
значения констант в уравнение, получаем: |
• Е = Е° + (0,059 / n) lg (аокис/авосст)
• Е = Е° + (0,059 / n) lg ([окисл] үокисл/([восст] үвосст))
Классификация электродов.
•Электроды первого рода представляют собой систему из
металла или неметалла, погруженного в раствор, содержащий его же ионы. Электрод из металла обратим относительно катионов, электрод из неметалла обратим относительно анионов.
•Меz+/Me0, например Cu2+/Cu0
Аz- /A0, например Se2-/Se0 К этой же группе электродов относятся амальгамные электроды (содержащие Hg).
•К электродам второго рода относятся
системы, в которых металл покрыт слоем труднорастворимой соли этого металла (или оксидом), а раствор содержит анионы этой соли.
• Аz- /МеА, Ме, например Cl-/AgCl, Ag Примером электродов второго рода могут служить каломельный и хлорсеребряный электроды, которые являются электродами сравнения:
каломельный электрод |
хлорсеребряный |
Cl-/Hg2Cl2, Hg |
Cl-/ |
AgCl, Ag |
|
½ Hg2Cl2 + = Hg + Cl- |
AgCl + = |
Ag + Cl- |
|
