
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Расписанные билеты СГМУ
.pdf
введением низкомолекулярных веществ. Коацервацию используют при микрокапсулировании лекарственных веществ. Для этого лекарственное вещество диспергируют в растворе полимера. В результате на поверхности лекарственного вещества формируется оболочка из адсорбированных капелек коацервата полимера. Капельки сливаются в сплошной слой на поверхности частиц лекарственного вещества и специальной обработкой переводятся в твѐoрдое состояние. Образовавшаяся твѐoрдая оболочка обеспечивает устойчивость, увеличивает длительность действия и устраняет неприятный вкус лекарственного вещества.
Билет 28 1)Скорость химической р-ции, факторы влияющие на нее, правило Вант-Гоффа
2)Буферная ёмкость.Интервал буферного действия 3)Коагуляция(определение) Скрытая и явная коагуляции, факторы вызывающие ее 4) написать мицеллу AgNO3(изб)+NaBr
1. Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени: V=± dc/dt
Зависимость скорости реакции от концентрации. Закон действующих масс. аА + вВ = АВ W = k [A]а∙[B]b Скорость реакции пропорциональна произведению концентрации реагирующих веществ, взятых в степени равной их молярным коэффициентам. Эти степени называются частными порядками реакции: а - частный порядок реакции по веществу А, b - частный порядок реакции по веществу В. Сумма частных порядков дает полный порядок реакции n: n=a+b. k - константа скорости реакции.( не зависит от значения концентраций реагентов)
Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Скорость химической реакции увеличивается с повышением температуры. Правило Вант-Гоффа: При повышении температуры на каждые 10 градусов, скорость реакции увеличивается в 2-4 раза
kT |
|
T2−T1 |
|
2 |
=γ10 |
||
kT |
|||
1 |
где V2 – скорость протекания реакции при температуре t2, а V1 – скорость |
||
|
протекания реакции при температуре t1; ɣ - температурный коэффициент скорости реакции. Этот коэффициент есть отношение констант скоростей при температуре t+10 и t.
2. Интервал рН=рКа±1 называется зоной буферного действия.
Буферная ёмкостьЭто способность буферной системы противодействовать изменению рН среды. Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия. Она равна рН = рК ± 1 Буферная ёмкость (В) выражается количеством мольэквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
В = |
n |
= |
nэ |
|
p Hk −p H n |
∆ pH |
|||
|
|
В – буферная ёмкость,
nЭ – количество моль-эквивалента сильной кислоты или щелочи, рНН – начальное значение рН ( до добавления кислоты или щелочи) рНК – конечное значение рН (после добавления кислоты или щелочи) ΔрН – изменение рН. На практике буферная ёмкость рассчитывается по формуле:
v n
В=vбуф ∆ pH
3. Коагуляция - процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет седиментационную устойчивость. Коагуляция самопроизвольный процесс, так как она
приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии. Факторы коагуляции: Коагуляция возникает под действием разнообразных внешних воздействий.
К ним относятся: изменение температуры; действие электрического и электромагнитного полей; действие видимого света; облучение элементарными частицами; механическое воздействие; добавление электролитов и др.
Процесс коагуляции имеет две стадии: скрытую и явную.
На скрытой стадии происходит формирование коллоидного раствора гидроксидов и образование микрохлопьев. А затем на явной стадии процесса образуются крупные хлопья размером 1—3 мм, которые, обладая высокой сорбционной способностью, могут дополнительно извлекать примеси из воды.
Билет 29
1 Ионная адсорбция, её правила, примеры
2 Происхождение связи в комплексных соединениях
3 Энергия активации, уравнение Аррениуса
4 Задача на порог коагуляции
1. Ионная адсорбция – адсорбция из растворов сильных электролитов. В этом случае растворённое вещество адсорбируется в виде ионов.
Особенности ионной адсорбции: 1. Адсорбируются заряженные частицы (ионы), а не молекулы. 2. Адсорбция происходит только на полярных адсорбентах, поэтому её часто называют полярной адсорбцией. 3. Адсорбция сопровождается образованием двойного электрического слоя (ДЭС). 4. Адсорбция является избирательной, т.е. на каждом данном адсорбенте катионы и анионы адсорбируются неодинаково. 5. В основе ионной адсорбции лежат химические силы, и она чаще всего кинетически необратима. 6. Для ионной адсорбции характерно явление обменной адсорбции
Факторы: 1. Химическая природа адсорбента Чем более полярным является адсорбент, тем лучше он адсорбирует ионы из водных растворов. На активных центрах, несущих положительный заряд, адсорбируются анионы(-), на отрицательных – катионы(+).
2. Химическая природа ионов а) На адсорбцию ионов большое влияние оказывает величина радиуса иона. С увеличением кристаллического радиуса иона возрастает адсорбционная способность. В соответствии с этим ионы можно расположить в ряды по возрастающей способности к адсорбции. Эти ряды называют лиотропными рядами Гофмейстера: Li ‹ Na ‹ K ‹ Rb ‹ Cs б) Чем больше заряд иона, тем сильнее адсорбция: K ‹‹ Са ‹‹ Al Правило Панетта-Фаянса: На кристаллической поверхности адсорбируются те ионы, которые способны достраивать кристаллическую решетку и дают труднорастворимое соединение с ионами, входящими в кристалл.
2.Комплексообразующая способность катионов определяется следующими факторами: Заряд катиона, радиус катиона и электронная конфигурация катиона. Чем больше заряд катиона и меньше радиус, тем прочнее связь комплексообразователя с лигандами. Поэтому катионы s- элементов (К+, Nа+, Са+2, Мg+2 и др.) обладающие относительно большим радиусом и малым зарядом, имеют низкую комплексообразующую способность. Катионы d-элементов (Со+3, Рt+4, Сr+3и др.), имеющие, как правило небольшой радиус и высокий заряд, являются хорошими комплексообразователями. (образуют дативную связь)
3.Энергия активацииэто та избыточная энергия, которой должны обладать сталкивающиеся молекулы, чтобы быть способными к химической реакции. (Активация вызывается повышением температуры, действием квантов света и т. д.) Энергия активации постоянна в данном температурном интервале и определяется механизмом реакции. Ее можно определить графически по уравнению Аррениуса:

где А-предэкспоненциальный множитель
Билет 30
1.Поверхностная активность, ПАВ, ПИВ, ПНВ и примеры
2.Бикарбонатный буфер
3.Роль осмотического давления: тургор, плазмолиз, гемолиз
4.Задача на приготовление раствора
1.Поверхностная активность (g) как характеристика поведения вещества при адсорбции. g = - при c → 0
Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества и наоборот. Поверхностно-активные, поверхностно-инактивные и поверхностно-неактивные вещества.. Правило Дюкло-Траубе.
1.Если Г › 0, т.е. концентрация растворенного вещества в поверхностном слое больше, чем в объёме раствора, то ‹ 0. Это характерно для ПАВ. Важнейшие ПАВ – водоростворимые органические соединения, молекулы которых состоят из двух частей: полярной (гидрофильной) и неполярной (гидрофобной). Если в данном растворителе полярная часть диссоциирует, то ПАВ называется ионогенным, в противном случае – неионогенным.
2.При добавлении веществ более полярных, чем растворитель (ПИВ), поверхностное натяжение увеличивается, а Г ‹ 0. Ионы этих соединений взаимодействуют сильнее с молекулами воды, чем молекулы воды друг с другом. Поэтому значительная часть ионов увлекается внутрь объема раствора. Оставшиеся на поверхности ионы создают силовое поле, тем самым повышая поверхностное натяжение.
3.Есть вещества, которые не изменяют поверхностное натяжение Г=0.Их называют (ПНВ).
Из графика следует, что по мере увеличения концентрации вещества адсорбция возрастает вначале резко, а затем всё медленнее и медленние, приближаясь к некоторой величине предельной адсорбции Г∞. Поверхность раствора имеет определенную площадь и при достижении определенной концентрации ПАВ в растворе она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна, дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое.
В гомологическом ряду жирных кислот с увеличением длины углеводородного радикала на одну -СН2 группу поверхностная активность возрастает в 3 - 3,5 раза
2. Бикарбонатный буфер. Он составляет 53 % буферной ёмкости и представлен: Н2СО3 NaHCO3 Соотношение 1 : 20 Бикарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продукт его взаимодействия с кислотами СО2 – быстро выводится через легкие. Помимо плазмы, эта буферная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани. Механизм действия. В случае накопления кислот в крови уменьшается количество НСО3- и происходит реакция: НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2↑. Избыток удаляется лёгкими. Однако значение рН крови остаётся постоянным, так как увеличивается объём лёгочной вентиляции, что приводит к уменьшению объёма СО2 При увеличении щелочности крови концентрация НСО3увеличивается: Н2СО3 + ОН- ↔ НСО3- + Н2О. Это приводит к замедлению вентиляции лёгких, поэтому СО2 накапливается в организме и буферное соотношение остаётся неизменным
3. Осмос регулирует поступление воды в клетки и межклеточные структуры. Если бы вода просачивалась в ткани, то это вызывало бы отек различных органов и подкожной живой клетки. Это наблюдается при механических повреждениях различных органов Упругость клеток (тургор), эластичность тканей, сохранение определенной формы органов обусловлены осмотическим давлением.
Помещая клетку в дистиллированную воду, наблюдается эндосмос (молекулы воды проникают во внутрь клетки), происходит набухание, а затем и разрыв оболочки и вытекание клеточного содержимого. Это явление называется лизисом. В случае эритроцитов – гемолизом. В концентрированных растворах солей отмечается сморщивание клеток - плазмолис, связанный с потерей воды, или экзосмосом
. Растворы, имеющие одинаковое осмотическое давление называются изотоническими. Например, используются в медицине такие растворы как 0,9%-ный р-р NaCl и 5%-ный р-р глюкозы, которые изотоничны крови (т.е. имеют такое же осмотическое давление). Растворы с более высоким осмотическим давлением называются гипертоническими, а более низким –гипотоническими . Осмотическое давление плазмы крови человека при 37 С составляет около 7,6 атм, это давление создает электролитный состав крови: 60% этого давления создает NaCl , з атем глюкоза и др. Часть осмотического давления (около 0,03 атм) обусловлено белками (альбумины). Это давление называется онкотическим.
Билет 31
1.Ионообменная адсорбция
2.Строение комплексного соединения и понятия теории Вернера
3.Обратимые и необратимые по направлению реакции
4.Задача на высаливание и коагуляцию
Ионообменная адсорбция – это процесс, при котором твердый адсорбент обменивает свои ионы того же знака из жидкого раствора.
Ионообменная адсорбция характерно: 1) эта адсорбция специфична, т.е. к обмену способны только определённые ионы, по своей природе этот процесс приближается к химическим явлениям
2)эта адсорбция не всегда обратима
3)протекает медленнее, чем молекулярная адсорбция
4)при этой адсорбции может меняться рН среды
2. Комплексные соединения это молекулярные или ионные соединения, образующиеся путем присоединения к атому или иону металла или неметалла, нейтральных молекул или других ионов. Они способны существовать как в кристалле, так и в растворе.
Основные положения и понятия координационной теории Вернера.
Главная валентность - валентность посредством которой соединяются атомы с образованием простых соединений, подчиняющихся теории валентности.
Побочная валентность – валентность, в результате проявления которой и образуется комплексное соединение. Центральные атомы или комплексообразователи - атомы стремящиеся равномерно окружить себя ионами или молекулами, являясь центром притяжения.
Лигандами - ионы или молекулы, непосредственно связанные с комплексообразователем. Посредством главной валентности присоединяются ионы-лиганды, а посредством побочной валентности – ионы и молекулы. Координация - притяжение лиганд к комплексообразователю Координационное число - число лиганд комплексообразователя Число координационных мест, занимаемых лигандом около комплексообразователя, называется его координационной ёмкостью или дентатностью
Комплексообразователь и лиганды составляют внутреннюю сферу соединения или комплекс (в формулах комплекс заключают в квадратные скобки). Ионы, не связанные непосредственно с комплексообразвателем, составляют внешнюю координационную сферу.

Билет 32 1)электрофорез и электроосмос
2)константа хим равновесия и Ее условия 3)массовая доля , титр и так далее
1 ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯгруппа явлений, наблюдаемых в дисперсных системах, мембранах и капиллярах; включает электроосмос, электрофорез.
Электроосмос - течение жидкости в капиллярах и пористых телах, вызванное внеш. электрич. полем. Электрофорез - движение твердых частиц или капель, взвешенных в электролите, при наложении электрич. поля 21Химическое равновесие — состояние химической системы, при котором скорости прямой и обратной
реакций равны между собой. В ходе самопроизвольного процесса энергия Гиббса уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Дальнейшее изменение энергии Гиббса при неизменных условиях становится невозможным, система переходит в состояние химического равновесия ∆G = 0 Любая химическая реакция протекает самопроизвольно только в направлении, приближающем систему к состоянию равновесия. Равновесие может существовать только для обратимых реакций. Принцип Ле Шателье: воздействие какого-либо фактора на равновесную систему стимулирует смещение равновесия в таком направлении, которое способствует восстановлению первоначальных характеристик системы.
3 1 1. Массовая доля (ω) - отношение массы соответствующего компонента в растворе к общей массе этого раствора. Выражается в единицах или процентах.
ω (х)= 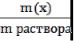 Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора.
Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора.
2. Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора.
См= 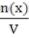 Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Сокращенно пишут М.
Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Сокращенно пишут М.
1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества); 0,1М – децимолярный раствор;
0,01М – сантимолярный раствор; 0,001М – милимолярный раствор.
3. Нормальная концентрация (молярная концентрация эквивалента, СN)- количество мольэквивалентов вещества, содержащегося в 1 л раствора.
СN= 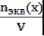 Единица измерения моль-экв/л, Сокращенно обозначается буквой N.
Единица измерения моль-экв/л, Сокращенно обозначается буквой N.
Титркол во грамм растворенного вещества содержащегося в 1 мл раствора.
