
- •Автор не сдержался и стал готкой делает перерыв на мемы.
- •ИЗОФЕРМЕНТЫ
- •Субстратная:
- •Каталитическая:
- •1. Гипотеза Фишера ака модель «жёсткой матрицы» ака «ключ-замок».
- •Всё логично, правда?
- •КОМПАРТМЕНТАЛИЗАЦИЯ
- •ЭНЗИМОДИАГНОСТИКА
- •ЭНЗИМОТЕРАПИЯ
- •ЭНЗИМОПАТИИ
- •Витамины витамины витаминчики мои
- •Курина Таня, 2.2.15
- •Каждый витамин имеет 3 названия:
- •ЕЩЁ РАЗ ВСЕМ СПАСИБО ЗА ВНИМАНИЕ У ВАС ВСЁ ПОЛУЧИТСЯ!!!!
- •Курина Таня, группа 2.2.15
- •Надеюсь, все сдали коллок на ура, в отличии от меня (прямо перед колком посадили на карантин, здоровья погибшим…) и готовы с новыми силами копаться в биохимии вместе со мной!
- •I этап
- •II этап
- •III этап
- •Всем спасибо за внимание!
- •1) Переваривание углеводов. Полостное и пристеночное пищеварение
- •3) Причины непереваривания целлюлозы в жкт. Роль целлюлозы в пищеварении
- •5) Пути превращения глюкозы в клетке. Источники глюкозы в клетке
- •9) Особенности обмена гликогена в печени и мышцах при некоторых физиологических состояниях (потребление пищи, голодание, мышечная активность). Участие гормонов в этих процессах
- •11) Генетические нарушения синтеза (агликогеноз) и распада гликогена (печеночные, мышечные и смешанные гликогенозы)
- •Дорогие друзья, всё…
- •ГЛИКОЛИЗ. ГЛЮОНЕОГЕНЕЗ.
- •Оглавление
- •Оглавление
- •Пусть он будет намного лучше, чем уходящий<3

БХ by tani$simo | vkontakte https://vk.com/tanissimooo
На печеньки моим общажным тараканам: 5469
ОГЛАВЛЕНИЕ
1 КОЛЛОКВИУМ
ФЕРМЕНТЫ РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ ВИТАМИНЫ
ВИТАМИНЫ ТАБЛИЦА КОФЕРМЕНТЫ ТАБЛИЦА
2 КОЛЛОКВИУМ
ОБЩИЕ ПУТИ КАТАБОЛИЗМА ПУТИ СИНТЕЗА АТФ СВОБОДНЫЕ РАДИКАЛЫ АФК
ЭЛЕКТРОННО-ТРАНСПОРТНАЯ ЦЕПЬ / АТФ СИНТАЗА
На печеньки моим общажным тараканам: 5469
3 КОЛЛОКВИУМ ПЕРЕВАРИВАНИЕ УГЛЕВОДОВ. ГЛИКОГЕН
ГЛИКОЛИЗ. ГЛЮКОНЕОГЕНЕЗ СХЕМЫ ГЛИКОЛИЗ И ГЛЮКОНЕОГЕНЕЗ
ПФП. ГАЛАКТОЗА, ФРУКТОЗА. РЕГУЛЯЦИЯ УРОВНЯ ГЛЮКОЗЫ
4 КОЛЛОКВИУМ ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ ЛИПИДОВ. ЛИПОГЕНЕЗ ХОЛЕСТЕРИН. ЛИПОПРОТЕИНЫ. АТЕРОСКЛЕРОЗ
5 КОЛЛОКВИУМ БЕЛКИ. ОБМЕН АМИНОКИСЛОТ
МЕТАБОЛИЗМ ОТДЕЛЬНЫХ АМИНОКИСЛОТ
На печеньки моим общажным тараканам: 5469
На печеньки моим общажным тараканам: 5469

Ферменты для реальных простых пацанов
Основано на реальных событиях методе Тимина, Северине, Википедии и моих псевдознаниях. Ни на что не претендую, просто подумала, что если я скомпоную методу, учебник, интернет и мою маленькую способность доносить материал доступно, я могу кому-то помочь.
Курина Таня, группа 2.2.15
@tanissimoo
2020 год (а вы живы?...)
На печеньки моим общажным тараканам: 5469

Ферменты. ака «возбудители жизни» (Павлов)
ака «возбудители жизни» (Павлов)
Заюш, ну это как бы нужно знать…
Наверняка помнишь ещё с санного ЕГЭ по химии, что для многих реакций нужны катализаторы. Оттуда ты, скорее всего, знаешь, что
Катализаторами называются вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными.
Мы запоминали такие катализаторы, как Al2O3, H2SO4 и прочая фигня (это мало кому сейчас интересно).
Так вот, в нашем организме происходит чуть больше чем дохуя очень много БИОХИМИЧЕСКИХ реакций, которые так же нуждаются в катализаторах. В данном случае их принято называть ферментами, о них мы сегодня и поговорим.
На печеньки моим общажным тараканам: 5469

ФЕРМЕНТЫ – это биологические катализаторы. Большинство из них по своей природе являются
белками, но существую и такие соединения, как рибозимы.
Рибозим (ферментативная РНК) – молекула РНК, обладающая каталитическим действием. Это, например, рибосома, которую мы все прекрасно знаем. Её рРНК катализирует образование пептидной связи.
Давай пока что пройдёмся по самым основам, необходимым для понимания самих ферментативных процессов.
ЭНЕРГИЯ АКТИВАЦИИ
АКТИВАЦИИ
Смотри, чтобы реакция в нашем организме(да и вообще) произошла, вещества должны обладать определённой энергией. Верхняя пунктирная линия на графике – количество энергии, которая потребовалось бы для осуществления реакции без катализатора (фермента). Вещества преодолевают этот энергетический барьер и реакция происходит, образуются продукты. Но это полный зашквар. Зачем ждать, если можно получить продукт намного
быстрее? Если вы хотите эту реакцию, логично предположить, что надо ту самую линию опустить. Кто нам тут поможет? Конечно ферменты, которые как раз и занимаются тем, что
На печеньки моим общажным тараканам: 5469
опускают энергетический барьер и лактат превращается в пируват в сотни раз быстрее. Вы, конечно, можете ускорить реакцию повышением температуры, давления, облучением, но в условиях нашего организма это невозможно. Поэтому наши катализаторы – ферменты – просто
снижают значение требуемой для данной реакции энергии (очевидно, что у каждой реакции он свой). Короче мы хитрые, хах.
На печеньки моим общажным тараканам: 5469

ЭТАПЫ ФЕРМЕНТАТИВНОГО
ФЕРМЕНТАТИВНОГО КАТАЛИЗА
КАТАЛИЗА НА
НА ПАЛЬЦАХ
ПАЛЬЦАХ
Всё очень просто – субстрат (S) присоединяется к ферменту (E – энзим). Образуется фермент-субстратный комплекс(E-S).
Происходит биохимическая магия (ака реакция), в одну или несколько стадий (E-X) . Уже измененный комплекс превращается в комплекс фермент-продукт (P), и продукт отделяется от фермента. Короче, фермент пришёл-> сделал своё дело с субстратом->съебался (фермент мужского рода, чего вы ещё от него ждали).
ФЕРМЕНТАТИВНЫЕ РЕАКЦИИ
РЕАКЦИИ
1) «Пин-понг» - сначала фермент взаимодействует с субстратом А, отнимает субстрата какую-нибудь группу и передаёт её другому субстрату Б. Субстрат А, ты вошёл в токсичные отношения и тобой воспользовались:))))))
Пример: перенос аминогруппы с аминоксилоты (субстрат А) на кетокислоты (субстрат Б)
2) Тип последовательных реакций – к ферменту по очереди подходят субстраты А и Б («тройной комплекс»), он выполняет свою работу (катализ), после чего субстраты так же по очереди отщепляются от фермента.
На печеньки моим общажным тараканам: 5469

3) Тип случайных взаимодействий – ваще всё равно в каком порядке субстраты присоединяются к ферменту, и таааак сойдёт. И отсоединяются пускай тоже как хотят. Реально до алмазной пизды.
РАЗЛИЧИЯ ОРГАНИЧЕСКИХ
ОРГАНИЧЕСКИХ И
И НЕОРГАНИЧЕСКИХ
НЕОРГАНИЧЕСКИХ КАТАЛИЗАТОРОВ
КАТАЛИЗАТОРОВ
Давай сравним те самые MnO2, H2SO4, Cu, Pd и прочие катализаторы, которые ты заучивал перед ЕГЭ, чтобы тебе не урезали 2 балла за неправильно написанную реакцию)00))))
Тимин сделал офигенную табличку, не буду выпендриваться, это просто надо зазубрить.
Помнишь, как много реакций могли катализировать оксиды амфотерных металлов, серная и соляные кислоты? В организме это не прокатит, определённые ферменты действуют на определенные субстраты – это принципиально.

Конечно, обязательны и определённые условия протекания р-ции – наш организм очень привередлив к температуре, pH, окружающей среде. Ферментам приходится работать в очень ограниченных условиях, но об этом мы поговорим ниже.
КЛАССИФИКАЦИЯ И
И НОМЕНКЛАТУРА
НОМЕНКЛАТУРА ФЕРМЕНТОВ.
ФЕРМЕНТОВ.
В нашем организме более 5000 разных ферментов, все они имеют разное строение, но некоторые объединяются в группы, так как выполняют сходные действия.
Давай договоримся с тобой на берегу: номенклатура у ферментов с первого взгляда сложная, но она крайне логичная. Посмотрев на название фермента, ты, скорее всего, сможешь сказать, что является субстратом и что этот фермент с ним делает. Но в силу существования тривиальных названий (липаза, амилаза, пепсин), современной классификации и реальных рабочий названий, номенклатура слегка долбит по мозгам.
По «правильному», название фермента складывается таким образом:
Субстрат + химическое наименование акцептора+ тип реакции+ аза
Например: L-аланин(субстрат):2-оксоглутарат(ацептор)-аминотрансфераза(переносит аминогруппу с аланина на глутарат)
Рабочее название этой елды – сукцинатдегидрогеназа.
Я не вижу смысла учить систематическое название, на курсе бх мы будем пользоваться рабочими. Потому что если ты знаешь рабочие названия – знаешь реакцию. Знаешь реакцию – знаешь субстрат и акцептор. Значит и название фермента по классической номенклатуре сможешь составить
На печеньки моим общажным тараканам: 5469
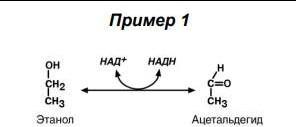
I.Оксидоредуктазы
Систематическое название : Донор электронов : акцептор электронов – оксидоредуктаза.
Катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Чаще всего ты будешь встречать их рабочие названия по окончаниям: дегидрогеназа, редуктаза, окидаза, монооксигеназ, пероксидаза и тд.
Коферменты (мы потом разберемся, что это такое. Пока что просто выучи, деваться некуда): НАД, НАДФ, ФАД, ФМН, убихинон, глутатион
Смотри, OH группа этанола окислилась до C=O. Однозначно ОВР! Значит это точно дело оксидоредуктазы. Это произошло при помощи алкогольдегидрогеназы – рабочее название (студентам РНИМУ она особенно важна…). По факту это оксидоредуктаза, и ты легко можешь это понять, посмотрев на реакцию.
Давай попробуем составить систематическое название, глядя на
реакцию: Алкоголь(этанол,субстрат): НАД (акцептор)-оксидоредуктаза(катализ ОВР)
На печеньки моим общажным тараканам: 5469

II. Трансферазы
Систематическое название образуется: Донор группы : акцептор группы – переносимая группа трансфераза
Катализируют реакции переноса различных групп от одного субстрата (донор) к другому (акцептор), участвуют в реакции взаимопревращения различных веществ, обезвреживания природных и чужеродных соединений.
Коферменты: пиридоксальфосфат, коэнзим А, тетрагидрофолиевая кислота, метилкобаламин.
Жила была глюкоза, но пришёл фермент гексокиназа – рабочее название(кинетика, движение, ю ноу блин) и перенесла фосфатную группу с АТФ на 6ой атом углорода. Та-дам, получился глюкозо-6- фосфат, а АТФ (трифосфосфат) превратился в АДФ (дифосфат). То бишь, сидела какая-то группа на одном вещества, а трансфераза перенесла эту группу на другое (ну, ему нужнее, конечно). С систематическим названием всё то же самое.
На печеньки моим общажным тараканам: 5469

Ш. Гидролазы
Дада, снова ебучий гидролиз, он происходит не только на ЕГЭ, но и внутри тебя
Осуществляют разрыв внутримолекулярных связей в субстрате путём присоединение воды. Здесь уже нет никаких коферментов, слава богу, это значит, что ферменты – простые.
Очень легко понять, что именно расщепляют гидролазы. Просто к субстрату добавляют окончание АЗА и никто никому не ебёт мозг. Люблю гидролазы.
На что действует данный фермент? На жир. Значит липаза. Действовала бы на ДНК – была бы ДНКаза, на глутамат – глутаминаза, на сложноэфирные связи - эстераза. Всё просто, друг мой.
IV. Лиазы
Название фермента: отделяемая группа-лиаза
Катализируют разрыв углерод-углеродной связи, углерод-кислородной и углеродазотной связи, и, в отличии от гидролаз, катализируют реакции отщепления различных групп уже негидролитическим путём. Часто реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи.
Коферменты: пиридоксальфосфат, тиаминдифосфат, магний, кобальт
На печеньки моим общажным тараканам: 5469

Была карбоксильная группа у ПВК (кстати, запомни её, ты ещё её миллион раз её встретишь за курс бх), пируватдекарбоксилаза взяла и превратила её в CO2, получился альдегид. Что произошло? Негидролитическим путём отщепилась COOH(реакция декарбоксилирования). Значит это точно лиаза, несмотря на то, что окончание не «лиаза». Это рабочее название, а вот систематическое давай снова составим вместе по схеме:
2-оксокислота(это ПВК, субстрат):карбокси(отделяемая карбоксильная группа)- лиаза(осуществляет негидролитический отрыв группы)
V. Изомеразы
Название ферментов: Субстрат – [ ] – реакция,
где [ ] – обозначение, отражающее суть реакции, например, "номер изменяемого атома углерода", изменение "цис-транс", изменение "кето-енол", изменение "альдозо-кетозо"
Катализируют изомерные превращения в пределах одной молекулы.
Коферменты: пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов
Изомеразы могут осуществлять обратимые превращения стереоизомеров (L и D, помнишь?). Мы называли этот процесс рацемизация, значит ферменты – рацемазы. Есть ещё эпимеразы (превращения эпимеров, молекул, у которых больше одного центра ассиметрии) и
На печеньки моим общажным тараканам: 5469
мутазы (внутримолекулярные трансферазы)
На печеньки моим общажным тараканам: 5469

Был рибулозо-5-фосфат, D-форма. Пришла рубилозофосфат-3- эпимераза и сместила OH справа налево. Получился ксилилозо-5- фосфат. Всё, опять же, очень просто, главное понять
VI. Лигазы
субстрат 1:субстрат 2 – лигаза
Катализируют присоединение друг к другу двух молекул при помощи энергии АТФ. АТФ обладает макроэргическими связями, они высокоэнергетические, что позволяет лигазам с огромной скоростью образовывать между молекулами новые связи.
Коферменты: нуклеотидные (УТФ), биотиновые (витамин Н), фолиевые коферменты
Фермент на схеме: глутамат(субстрат):аммиак(акцептор)- лигаза. По факту происходит синтез глутамина (карбоксильный атом углерода реагирует с аммиаком и образуется амид), поэтому рабочее название –
глутаминсинтетаза.
На печеньки моим общажным тараканам: 5469

Автор не сдержался и стал готкой делает перерыв на мемы.
На печеньки моим общажным тараканам: 5469

ХАРАКТЕРИСТИКА СТРУКТУРНО-ФУНКЦИОНАЛЬНОЙ
СТРУКТУРНО-ФУНКЦИОНАЛЬНОЙ ОРГАНИЗАЦИИ
ОРГАНИЗАЦИИ
ФЕРМЕНТОВ
Все ферменты мы можем разделить на простые и сложные.
Простые ферменты состоят только из белковой части
(аминокислот) – апофермента. К ним относятся пепсин, трипсин, лизоцим и т.д.
Сложные (или холоферменты) = белковая часть(апофермент)+небелковая часть (кофактор)
Кофактор может быть представлен:
1)Коферментами – органическое вещество, чаще всего это витамины (их коферментные формы)
2)Ионами металлов – кофактор неорганической природы (магний, кобальт, цинк и т.д.)
3) Коферментами и ионами – кофактор содержит и органическую, и неорганическую часть (алкогольдегидрогеназа – НАД(кофермент)+ионы цинка
Функции кофактора: 1. Могут быть участниками ОВР (в составе оксидоредуктаз), т.е. выступают в качестве доноров или акцепторов электронов. Например, витамины Е,С, НАД, ФАД, ФМН и т.д.
2. Образуют ковалентные связи с ферментом, изменяя его конфигурацию и способствуя
На печеньки моим общажным тараканам: 5469
«открытию» для субстрата активного центра.
На печеньки моим общажным тараканам: 5469

1 – участок связывания, 2 – каталитический участок
Активный центр ферментов — это определенный участок белковой молекулы, способный комплементарно связываться с субстратом и обеспечивающий его каталитическое превращение. Структура активного центра сформирована радикалами аминокислот, так же как и в случае активного центра любого белка. В активном центре фермента имеются
аминокислотные остатки, функциональные группы которых обеспечивают комплементарное связывание субстрата (участок связывания), и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата (каталитический участок).
То есть он состоит из якорного участка(участка связывания), ответственного за связывание с определённым субстратом, и каталитического участка, который творит всю магию и преобразует субстрат в продукт. Всё донельзя просто.
Смотрим на схему – плавает у нас гдето апофермент, без своего небелкового кофактора он неактивен и грустит. Как только происходит их соединение, образуется активный центр
На печеньки моим общажным тараканам: 5469
фермента (состоящий из якорного и каталитического участка),
На печеньки моим общажным тараканам: 5469

к которому уже может присоединиться субстрат. Запомни, для катализа необходим комплекс апобелка (аминокислотной части) и кофактора (небелковой части), отдельно друг от друга они пустышки
Есть ещё такая штука, как аллостерический центр (не у всех ферментов!). Это тоже часть фермента, являющаяся полимерным белком. Он отделён от его активного центра (якорный и каталитический участки) и обеспечивает регуляцию активности фермента. С аллостерическим центром связывается какая либо молекула – ингибитор или активатор, модулятор, да кто угодно, кто может повлиять на конфигурацию самого фермента aka сродство активного центра к специфическому субстрату (лиганду) и регулирует его деятельность. Это может быть продукт данной или последующей реакций, субстрат реакции или другое в- во.
На печеньки моим общажным тараканам: 5469

КОФЕРМЕНТНЫЕ ФОРМЫ
ФОРМЫ ВИТАМИНОВ
ВИТАМИНОВ
Витамины играют очень важную роль в нашем метаболизме, некоторые из них являются коферментами (т.е. небелковой частью фермента, с апоферментом которого он обязательно потом должен соединиться) для многих биохимических реакций. Рассмотрим некоторые из них.
Витамин
 B2 (рибофлавин, витамин роста)
B2 (рибофлавин, витамин роста)
Кофермент оксидоредуктаз(вспомни, что они делают) – обеспечивает перенос 2 атомов водорода в окислительно-восстановительных реакциях.
Витамин содержат: 1. Дегидрогеназы энергетического обмена – пируватдегидрогеназа, -
кетоглутаратдегидрогеназа, сукцинатдегидрогеназа, ацил-КоА-дегидрогеназа, митохондриальная - глицеролфосфатдегидрогеназа. 2. Оксидазы, окисляющие субстраты с
участием молекулярного кислорода.
Состоит из флавина и спирта рибитола (нам это пока ненужно, но можешь блеснуть знаниями).
Чтобы он стал коферментом, он должен дополнительно содержать либо только фосфорную кислоту (тогда он превращается в коферментную форму - флавинмононуклеотид ), либо фосфорную кислоту, дополнительно связанную с АМФ – флавинадениндинуклеотид (нуклеотид в составе рибофлавина и нуклеотид в составе АМФ, поэтом ДИнуклеотид). В таком виде Витамин В2 может соединиться с активным центром фермента, а, если ты читал внимательно, то без кофермента просто апофермент ничего не может сделать, у него лапки.
На печеньки моим общажным тараканам: 5469
Поэтому кушай мясо, дрожжевые булочки и молочные продукты, чтобы каждый апофермент в твоём
организме нашёл свой кофермент (плакала вся 361 маршрутка).
На печеньки моим общажным тараканам: 5469

Витамин
 В3 (PP, ниацин, антипеллагрический – предотвращает пеллагру)
В3 (PP, ниацин, антипеллагрический – предотвращает пеллагру)
Существует в виде никотиновой кислоты или никотинамида.
Его коферментные формы – всем нам давно известные ещё с первого курса НАД и НАДФ.
Биохимические функции: Перенос гидрид-ионов Н– (атом водорода и электрон) в окислительно-восстановительных реакциях. Т.е. опять оксидоредуктазы.
Рассмотрим их названия и ты раз и навсегда запомнишь название
этого кофермента:
НАД: никотинамид(сам витамин В3)-аденин(азотистое основание)-динуклеотид(два нуклеотида в составе, у одного в качестве азотистого основания аденин, у другого – никотинамид)
НАДФ: никотинамид(витами В3)-аденин(азотистое основание)-динуклеотид-фосфат(рибоза в составе АМФ фосфорелированная)
И вот никотиамидадениндинуклеотид и никотинамидадениндинуклеотидфосфат сами выстраиваются в голове по логической цепочке. А то МнОгА БуКф МнОгА бУкФ, МнОгА БуКф
На печеньки моим общажным тараканам: 5469
МнОгА бУкФ… всё просто, пирожочек.
На печеньки моим общажным тараканам: 5469

МУЛЬТИФЕРМЕНТНЫЙ КОМПЛЕКС
КОМПЛЕКС
Одна голова хорошо, а две – лучше. Вот и ферменты лучше работают, когда соединены в комплексы. Они прочно связаны и осуществляют ряд последовательных реакций одного пути.
Работает это так: продукт реакции первого фермента с субстратом передаётся на следующий фермент и является только его субстратом.
Зачем эти комплексы нужны? Они значительно ускоряют ход реакции. Намного проще работать, когда система налажена, так ведь? Мультиферментные комплексы концентрируют каталитическую активность, повышают концентрацию интермедиатов, субстрат не рассеивается из-за диффузного эффекта, а целиком переходит на следующий фермент, так сказать, безотходно.
Таких комплексов в нашем организме много: пируватдегидрогеназный комплекс
(пируват ацетил-S- КоА), альфа-кетоглутарадегидрогеназный комплекс (альфакетоглутарат сукцинил-S-KoA),
«синтаза жирных кислот» (синтез пальмитиновой кислоты)
Для тех кто хочет вые..выделиться, доп.инфа:
Мультиферментные комплексы концентрируют каталитическую активность, повышают концентрацию интермедиатов, субстрат не рассеивается из-за диффузного эффекта, а целиком переходит на следующий фермент, так сказать, безотходно.
На печеньки моим общажным тараканам: 5469
Они могут образовывать конъюгаты – то есть фермент (полипептид) один, но он имеет несколько активных центров (комплекс синтаза жирных кислот)
Метаболоны – тоже своего рода ферментные комплексы, которые формируются на подложках (обычно это мембраны, структурные белки мышц). Пример из нашей любимой гисты – белок полосы 3. Плюсы метаболона – всё происходит в микрокомпартаменте, без выхода интермедиатов в объём тканевой жидкости или цитоплазмы.
На печеньки моим общажным тараканам: 5469
