
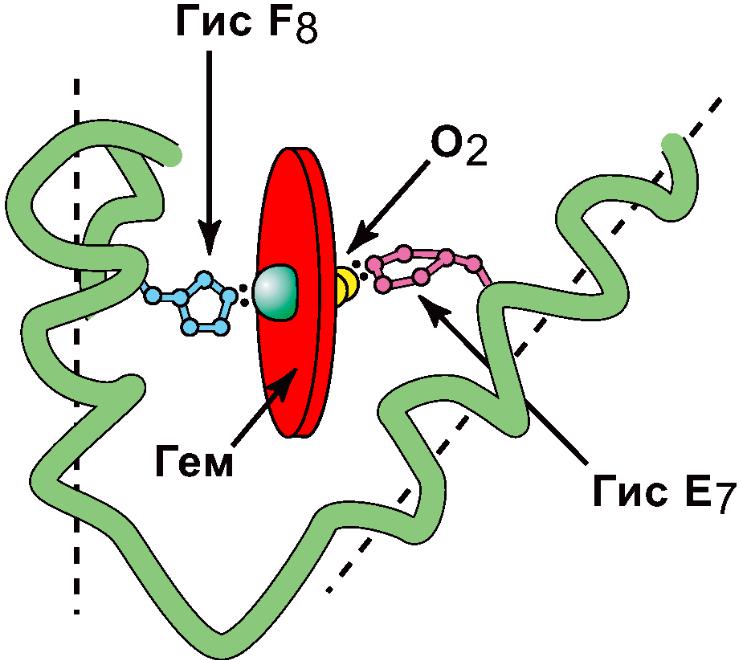
Строение активного центра Mb и Hb (схема из малинового учебника):
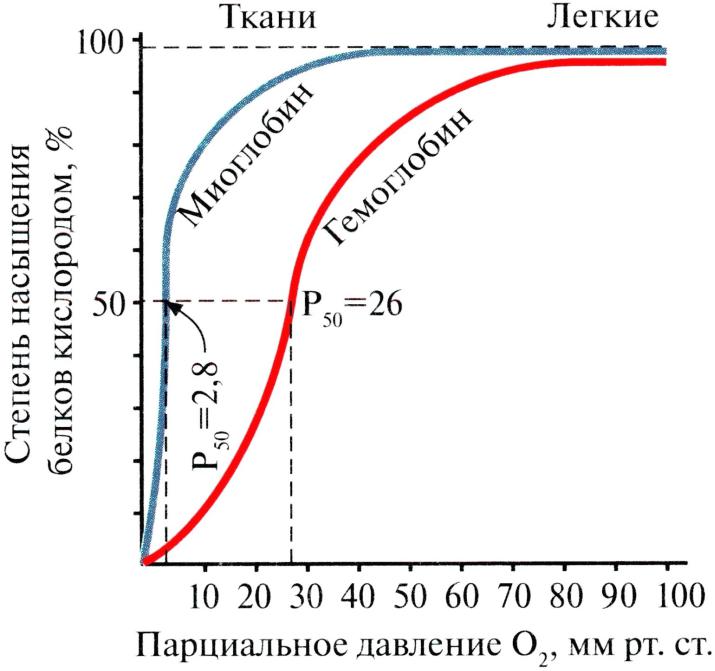
Кривые диссоциации O2 для Mb и Hb:

1) Mb имеет очень большое сродство к O2.
При ПД O2 – 40 мм рт. ст. в венозной крови Mb полностью насыщен O2. И даже при низком ПД O2 – (10-20 мм рт. ст.) Mb почти полностью насыщен O2. Только при тяжелой физической работе ПД O2 может снизиться до 5 мм рт. ст., и Mb способен легко отдавать O2.
2) Hb – насыщается в легких O2 на 100%, а в тканях отдает его в зависимости от ПД.
Вотдыхающих мышцах ПД O2 – 40-50 мм рт. ст. При этом Hb отдает тканям ~ 20% O2.
Вработающей мышце ПД O2 падает до 10 мм рт. ст. и Hb резко ↑ отдачу O2.
Вывод: отдача O2 в ткани – регулируемая функция Hb.
Это происходит благодаря кооперативным изменениям конформации протомеров.
Кооперативные взаимодействия между протомерами характерны для всех олигомерных белков.
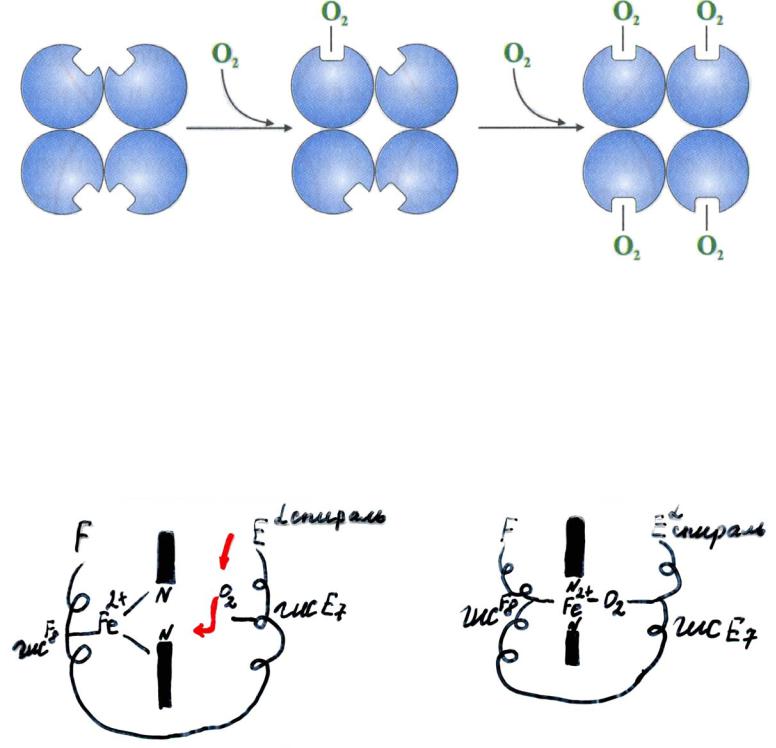
Это проявляется в том, что изменение конформации одной из субъединиц олигомерного белка приводит к изменению конформации всех субъединиц, т.е. конформации всего белка.
В легких: присоединение 1-й молекулы O2 к протомеру Hb меняет конформацию всего олигомерного белка и облегчает присоединение следующих молекул O2 к другим протомерам.
Последняя молекула O2 присоединяется к Hb в 300 раз легче, чем первая.
В тканях: отрыв 1-й молекулы O2 облегчает отщепление от Hb всех последующих молекул O2.
Типы гемоглобина:
Все типы гемоглобина являются тетрамерами и содержат 2α-цепи.
1)Гемоглобин A – 2α- и 2β-цепи. Составляет ~ 98%
гемоглобина эритроцитов взрослого человека;
2)Гемоглобин A2 – 2α- и 2δ-цепи. Составляет ~ 2%
гемоглобина взрослого человека;
3)Гемоглобин эмбриональный – 2α- и 2ε-цепи.
Обнаруживается на ранних этапах развития плода;
4)Гемоглобин F – 2α- и 2γ-цепи. Приходит на смену
раннему гемоглобину плода на 6-м месяце развития;
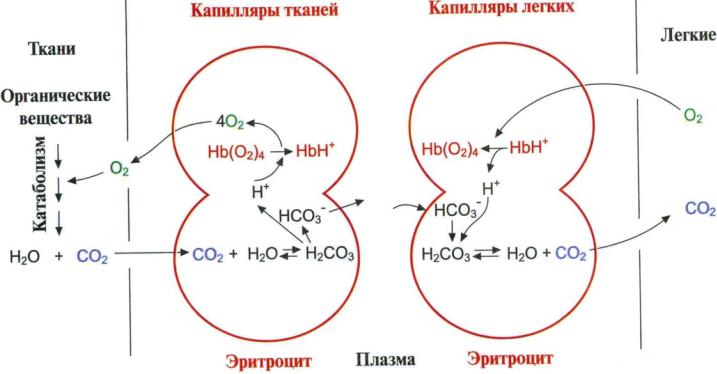
На способность Hb отдавать O2 в тканях сильно влияет наличие регуляторов, к которым относятся H+, CO2 и 2,3-бифосфоглицерат (2,3-БФГ).
Эффект Бора
Основные функции гемоглобина:
1)транспорт O2 из легких в ткани;
2)транспорт CO2 и избытка H+ из тканей обратно в легкие.
Эффект Бора – увеличение освобождения кислорода гемоглобином в зависимости от концентрации протонов.
Влияние 2,3-БФГ на сродство Hb к O2.
- |
O |
|
|
|
|
|
- |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
O |
|
P |
|
O |
|
CH2 |
|
|
|
CH |
COO |
||||
|
|
|
|
||||||||||||
|
O- |
|
|
|
|
|
|
||||||||
|
O |
|
|||||||||||||
|
|
|
|
|
|
|
|
-O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
O |
|||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
O- 2,3-Бифосфоглицерат
2,3-БФГ – вещество, которое синтезируется в эритроцитах из промежуточного продукта гликолиза – 1,3-бифосфоглицерата.
2,3-БФГ в норме присутствует в эритроцитах ~ в той же концентрации, что и Hb.
2,3-БФГ присоединяется к Hb в специальном участке (центральной полости), расположенном между 4 протомерами.
2,3-БФГ может присоединяться только к дезоксигемоглобину.
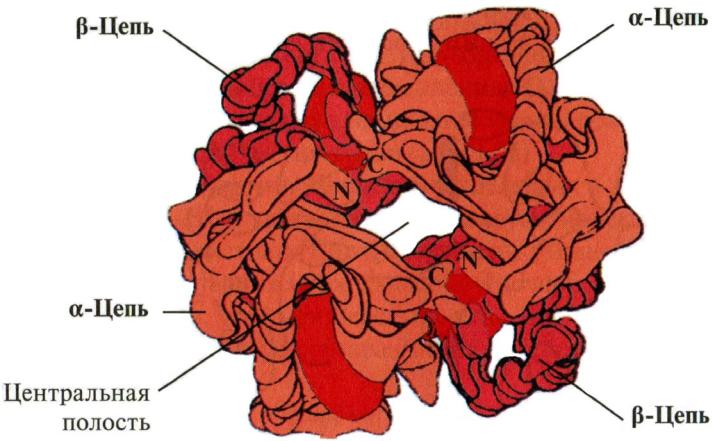
Олигомерная структура гемоглобина (схема из малинового учебника):

В капиллярах легких, где высокое ПД O2 – Hb соединяется с O2 => происходит сужение полости между протомерами Hb, что приводит к вытеснению
2,3-БФГ из Hb.
И Hb практически не связан с 2,3-БФГ.
В капиллярах тканей, где ниже парциальное давление O2, 2,3-БФГ присоединяется к дезоксигемоглобину => ↓ его сродство к O2 =>
облегчается переход O2 в ткани.
Hb(O2)4 + 2,3-БФГ Ткани Hb.2,3-БФГ + 4O2
Легкие
Концентрация 2,3-БФГ может увеличиваться при адаптации организма к гипоксии (высокогорье, обструктивная эмфизема легких).
Это снижает сродство Hb к O2 и увеличивает количество O2, транспортируемого в ткани.
2,3-БФГ присоединяется к Hb не в том участке, к которому присоединяется O2, а в другом.
Такой лиганд называется: аллостерический. Центр, к которому присоединяется аллостерический лиганд, называется: аллостерический центр.

Аллостерические белки:
Аллостерические белки:
1)Олигомерные белки, состоящие из 2-х или более субъединиц – регуляторной и каталитической.
2)Имеют 2 пространственно разделенных центра, расположенные в разных субъединицах:
С – каталитическая субъединица.
Содержит активный центр, к которому присоединяется – главный лиганд белка.
R – регуляторная субъединица.
Содержит регуляторный (аллостерический центр), к которому присоединяется – лигандэффектор.
Эффекторы делятся на: активаторы (A) и ингибиторы (I).
Они влияют на сродство АЦ белка к его главному лиганду.
A – увеличивают сродство; I – уменьшают.
