

21
Проламины,глютелины
Проламины, глютелины – растительные белки, богатые глютаминовой кислотой (до 43%) и гидрофобными аминокислотами, в частности, пролином (до 10 – 15%). В силу особенностей аминокислотного состава проламины и глютелины не растворимы в воде и солевых растворах, но растворимы в 70% этиловом спирте. Проламины и глютелины являются пищевыми белками злаковых культур, составляя так называемые глютеновые белки. К глютеновым белкам относятся секалин (рожь), глиадин (пшеница), гордеин (ячмень), авенин (овёс). В детском возрасте может наблюдаться непереносимость глютеновых белков, к которым в лимфоидных клетках кишечника вырабатываются антитела. Развивается глютеновая энтеропатия, снижается активность кишечных ферментов. В связи с этим, злаковые отвары детям рекомендуется вводить после 4-х месячного возраста. Не содержат глютеновых белков рис и кукуруза.
Протеиноиды
Протеиноиды (белковоподобные) – фибриллярные, водонерастворимые белки опорных тканей (костей, хрящей, сухожилий, связок). Они представлены коллагеном, эластином, кератином, фиброином.
Коллаген (рождающий клей) – широко распространённый в организме белок, составляет около трети всех белков организма. Входит в состав костей, хрящей, зубов, сухожилий и других видов соединительной ткани.
К особенностям аминокислотного состава коллагена относится, прежде всего, высокое содержание глицина (1/3 всех аминокислот), пролина (1/4 всех аминокислот), лейцина. В составе коллагена присутствуют редкие аминокислоты гидроксипролин и гидроксилизин, но отсутствуют циклические аминокислоты.
Полипептидные цепи коллагена содержит около 1000 аминокислот. Различают несколько видов коллагена в зависимости от сочетания в нём различных видов полипептидных цепей. К фибриллообразующим видам коллагена относятся коллаген первого типа (преобладает в коже), коллаген второго типа (преобладает в хрящах) и коллаген третьего типа (преобладает в сосудах). У новорожденных детей основная масса коллагена представлена III типом, у взрослых людейII и I типами.
Вторичная структура коллагена представляет особую «ломаную» альфа-спираль, в витке которой укладывается 3,3 аминокислоты. Шаг спирали равен 0,29 нм.
Три полипептидные цепи коллагена уложены в виде тройного закрученного каната, фиксированного водородными связями, и образуют структурную единицу коллагенового волокна – тропоколлаген. Тропоколлагеновые структуры размещаются параллельными, смещёнными по длине рядами, фиксированными ковалентными связями, и формируют коллагеновое волокно. В промежутках между тропоколлагеном в костной ткани откладывается кальций. Коллагеновые волокна содержат в своём составе углеводы, которые стабилизируют коллагеновые пучки.
Кератины - белки волос, ногтей. Они не растворимы в растворах солей, кислот, щелочей. В составе кератинов имеется фракция, которая содержит

22
большое количество серосодеоржащих аминокислот (до 7 – 12%), образующих дисульфидные мостики, придающие высокую прочность этим белкам. Молекулярная масса кератинов очень высока, достигает 2 000 000 д. Кератины могут иметь α– структуру и β- структуру. В α - кератинах три α - спирали объединяются в суперспираль, формирующую протофибриллы. Протофибриллы объединяются в профибриллы, затем в макрофибриллы. Примером β - кератинов является фиброин шёлка.
Эластин – белок эластических волокон, связок, сухожилий. Эластин не растворим в воде, не способен к набуханию. В эластине высока доля глицина, валина, лейцина (до 25 – 30%). Эластин способен растягиваться под действием нагрузки и восстанавливать свои размеры после снятия нагрузки. Эластичность связана с присутствием в эластине большого количества межцепочечных сшивок при участии аминокислоты лизина. Две цепи образуют связь лизил – норлейцин, четыре цепи образуют связь – десмозин.
1.10.2. Сложные белки (протеиды)
К сложным белкам (протеидам) относят белки, в которых помимо белковой части содержатся небелковые вещества (простетические группы).
Сложные белки классифицируют по химическому составу их простетической группы.
Выделяют следующие группы сложных белков:
1.хромопротеиды;
2.нуклеопротеиды;
3.липопротеиды;
4.гликопротеиды;
5.фосфопротеиды;
6.металлопротеиды
Хромопротеиды
Хромопротеиды содержат в качестве простетической группы окрашенные небелковые соединения. В группе хромопротеидов выделяют гемопротеиды и флавопротеды.
Вгемопоротеидах простетической группой является гем – органическое, железосодержащее вещество, придающее белку красный цвет. Гем соединяется
сбелком глобином за счёт координационных и гидрофобных связей. Примерами гемопротеидов являются белок эритроцитов гемоглобин, белок мышц миоглобин, тканевые белки цитохромы, ферменты каталаза, пероксидаза. Гемопротеиды участвуют в переносе кислорода и в окислительных процессах в тканях.
Вфлавопротеидах содержится простетическая группа жёлтого цвета. В качестве простетической группы могут быть представлены нуклеотиды ФАД, ФМН. К флавопротеидам относится фермент сукцинатдегидрогеназа. Некоторые флавопротеиды содержат в своём составе металлы – металлофлавопротеиды. Флавопротеиды участвуют в окислительных процессах в организме.
Нуклеопротеиды
Нуклеопротеиды состоят из белковой части и нуклеиновых кислот: ДНК

23
или РНК. В ядре локализованы дезоксирибонуклеопротеиды, в цитозоле – рибонуклеопротеиды. Белки в нуклепротеидах ядра представлены в основном гистонами. Белковая и небелковые части нуклеопротеидов связаны ионными и гидрофобными связями. При полном гидролизе нуклеопротеидов образуются аминокислоты, фосфорная кислота, углевод и пуриновые или пиримидиновые азотистые основания. Нуклеопротеиды участвуют в хранении и воспроизведении генетической информации.
Липопротеиды
Липопротеиды в качестве простетической группы содержат различные липиды (триацилглицерины, фосфолипиды, холестерин и др.). Между белком и липидом формируются гидрофобные и ионные связи. Липопротеиды принято делить на структурные, входящие в состав клеточных мембран, и транспортные, осуществляющие перенос липидов кровью. Транспортные липопротеиды представляют собой сферические частицы, внутри которых находятся гидрофобные жиры, а на поверхности – фосфолипиды и гидрофильные белки. Примером липопротеида может служить фактор свёртывания крови – тромбопластин.
Фосфопротеиды
Фосфопротеиды содержат остатки фосфорной кислоты, соединённые с радикалами остатков серина, реже треонина белковой части сложноэфирными связями. Присоединение фосфорной кислоты к белку может носить обратимый характер и сопровождаться формированием или разрывом ионных связей фосфорной кислоты и заряженных групп белка, что меняет структуру и биологическую активность фосфопротеида. К фосфопротеидам относятся структурные белки костной ткани, казеиноген молока, ововителлин белка куриного яйца, некоторые ферменты (фосфорилаза, гликогенсинтетаза, ТАГ-липаза).
Гликопротеиды
Гликопротеиды содержат, как правило, прочно присоединенные гликозидными связями остатки углеводов (моносахаридов, олигосахаридов). Гликопротеиды обычно имеют мозаичную структуру, в которой чередуются углеводные и белковые фрагменты.
Углеводная часть придаёт специфичность гликопротеидам и определяет их устойчивость к тканевым ферментам. Гликопротеиды широко представлены в организме человека. Они содержатся как в тканях, так и в биологических жидкостях. Муцин слюны содержит в своём составе до 15% маннозы и галактозы. Гликопротеидами являются некоторые гормоны, например, гонадотропины гипофиза. Некоторые транспортные белки крови относятся к гликопротеидам (трансферрин). Гликопротеидом является фактор свёртывания крови фибриноген, Все виды иммуноглобулинов содержат углеводные фрагменты. Углеводы придают специфичность тканевым рецепторам. Адгезивные белки (фибронектин, ламинин), будучи гликопротеидами, обеспечивают взаимодействие клеток, волокон, гликозаминогликанов соединительной ткани.
Металлопротеиды
Металлопротеиды – сложные белки, в состав которых входят металлы.

24
Например, гемосидерин и ферритин содержат железо, фермент алкогольдегидрогеназа содержит цинк.
В последнее время предложена классификация белков на семейства - группы близких по структуре и функциям белков, имеющие гомологичные последовательности аминокислот. Например, выделяют семейство сериновых протеаз, содержащих в активном центре аминокислоту серин и участвующих в расщеплении различных белков. В это семейство входят трипсин, химотрипсин, эластаза, многие ферменты свёртывания крови (тромбин), антисвёртывающей системы (фибринолизин). Семейство иммуноглобулинов включает все виды основных и минорных иммуноглобулинов. Иммуноглобулины имеют вилкообразную структуру, состоящую из двух тяжелых (Н) цепей и двух лёгких цепей (L). Иммуноглобулины, в свою очередь, входят в состав суперсемейства, включающего иммуноглобулины, рецепторы к Т-антигенам, белки гистиосовместимости.
2. СТРУКТУРА, СВОЙСТВА И МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
2.1. Краткая история ферментологии Экспериментальное изучение ферментов в 19 веке совпало по времени с
изучением процессов дрожжевого брожения, что нашло отражение в терминах «ферменты» и «энзимы». Название ферменты возникло от латинского слова fermentatio – брожение. Термин энзимы произошёл от понятия en zyme - из дрожжей. Вначале этим названиям придавали разный смысл, но в настоящее время они являются синонимами.
Первая ферментативная реакция осахаривания крахмала солодом была исследована отечественным учёным К.С. Кирхгоффом в 1814 году. Впоследствии были предприняты попытки выделения ферментов из дрожжевых клеток (Э. Бюхнер, 1897 год). В начале ХХ века Л. Михаэлис и М. Ментен разработали теорию ферментативного катализа. В 1926 году Д. Самнер впервые выделил очищенный препарат фермента уреазы в кристаллическом состоянии. В 1966 году Б. Меррифилду удалось осуществить искусственный синтез фермента РНК-азы.
2.2. Структура ферментов Ферменты – это высокоспециализированные белки, способные повышать
скорость реакции в живых организмах. Ферменты - биологические катализаторы.
Все ферменты являются белками, как правило, глобулярными. Они могут относиться как к простым, так и к сложным белкам. Белковая часть фермента может состоять из одной полипептидной цепи и относиться к мономерным белкам (например, пепсин). Ряд ферментов являются олигомерными белками, включают в свой состав несколько протомеров или субъединиц. Протомеры, объединяясь в олигомерную структуру, соединяются самопроизвольно непрочными нековалентными связями. В процессе объединения (кооперации) происходят структурные изменения отдельных протомеров, в результате чего активность фермента заметно возрастает. Отделение (диссоциация)

25
протомеров и их объединение в олигомерный белок является механизмом регуляции активности ферментов.
Субъединицы (протомеры) в олигомерах могут быть или одинаковыми, или отличающимися по первичной - третичной структуре (конформации). В случае соединения различных протомеров в олигомерную структуру фермента возникают множественные формы одного и того же фермента – изоферменты.
Изоферменты катализируют одну и ту же реакцию, но отличаются по набору субъединиц, физико-химическим свойствам, электрофоретической подвижности, по сродству к субстратам, активаторам, ингибиторам. Например, лактатдегидрогеназа (ЛДГ) – фермент, окисляющий молочную кислоту в пировиноградную кислоту, является тетрамером. Он состоит из четырёх протомеров двух типов. Один вид протомеров обозначается Н (выделен из сердечной мышцы), второй протомер обозначается М (выделен из скелетной мускулатуры). Возможно 5 сочетаний этих протомеров в составе ЛДГ: Н4, Н3М, Н2М2,Н1М3,М4 соответственно ЛДГ1, ЛДГ2,ЛДГ3,ЛДГ4, ЛДГ5.
Биологическая роль изоферментов.
∙Изоферменты обеспечивают протекание химических реакций в соответствии с условиями в разных органах. Так, изофермент ЛДГ1 – обладает высоким сродством к кислороду, поэтому он активен в тканях с высокой скоростью окислительных реакций (эритроциты, миокард). Изофермент ЛДГ5 активен в присутствии высокой концентрации лактата, наиболее характерен для ткани печени.
∙Выраженная органоспецифичность изоферментов используется для диагностики заболеваний различных органов.
∙Изоферменты изменяют свою активность с возрастом. Так, у плода при недостатке кислорода преобладает ЛДГ3, а с увеличением возраста и
увеличением поступления кислорода возрастает доля ЛДГ2.
Если фермент является сложным белком, то он состоит из белковой и небелковой части. Белковая часть является высокомолекулярной, термолябильной частью фермента и называется апоферментом. Он имеет своеобразную структуру и определяет специфичность ферментов.
Небелковая часть фермента называется кофактором (коферментом). Кофактором чаще всего являются ионы металлов, которые могут прочно связываться с апоферментом (например, Zn в ферменте карбоангидразе, Сu в ферменте цитохромоксидазе). Коферменты обычно являются органическими веществами, менее прочно связанными с апоферментом. Коферментами являются, в частности, нуклеотиды НАД, ФАД. Кофермент – низкомолекулярная, термостабильная часть фермента. Его роль заключается в том, что он определяет пространственную укладку (конформацию) апофермента, и определяет его активность. Некоторые кофакторы могут переносить электроны, функциональные группы, участвовать в образовании дополнительных связей между ферментом и субстратом.
В функциональном отношении в ферменте принято выделять два важных участка в молекуле фермента: активный центр и аллостерический участок.
Активный центр – это участок молекулы фермента, который взаимодействует с субстратом и участвует в каталитическом процессе.
26
Активный центр фермента образован радикалами аминокислот, удалённых друг от друга в первичной структуре. Активный центр имеет трёхмерную укладку, чаще всего в его составе выявляются реакционноспособные
-ОН группы серина
-SH – цистеина
-NH2 лизина
-γ-СООН глютаминовой кислоты
Схема активного центра фермента
Вактивном центре различают две зоны – зону связывания с субстратом и каталитическую зону.
Зона связывания обычно имеет жёсткую пространственную структуру, к которой комплементарно присоединяется субстрат реакции. Например, трипсин расщепляет белки в участках, богатых положительно заряженной аминокислотой лизином, так как в его зоне связывания содержатся остатки отрицательно заряженных аспарагиновой и глютаминовой кислот.
Каталитическая зона - это участок активного центра, непосредственно воздействующий на субстрат и осуществляющий каталитическую функцию. Эта зона более подвижна, в ней возможно изменение взаиморасположения функциональных групп.
Вряде ферментов (чаще олигомерных) кроме активного центра присутствует аллостерический участок – участок молекулы фермента, удалённый от активного центра и взаимодействующий не с субстратом, а с дополнительными веществами (регуляторами, эффекторами). В аллостерических ферментах в одной субъединице может находиться активный центр, в другой - аллостерический участок. Аллостерические ферменты изменяют свою активность следующим образом: эффектор (активатор, ингибитор) действует на аллостерическую субъединицу и изменяет её структуру. Затем изменение конформации аллостерической субъединицы по принципу кооперативных изменений опосредованно меняет структуру каталитической субъединицы, что сопровождается изменение активности фермента.
2.3.Механизм действия ферментов
Ферменты обладают рядом общекаталитических свойств:
∙не смещают каталитическое равновесие;
∙не расходуются в процессе реакции;
∙катализируют только термодинамически реальные реакции. Такими реакциями являются те, в которых исходный энергетический запас молекул больше, чем финальный.

27
В ходе реакции преодолевается высокий энергетический барьер. Разница между энергией этого порога и исходным энергетическим уровнем (Е2 – Е0) - энергия активации (Еа)
Скорость ферментативных реакций определяется энергией активации и рядом других факторов.
Константа скорости химической реакции рассчитывается по уравнению:
К - константа скорости реакции; Р – пространственный (стерический) коэффициент;
Z – количество взаимодействующих молекул; Еа – энергия активации;
R – газовая постоянная;
Т – универсальная абсолютная температура; е – основание натуральных логарифмов.
В данном уравнении Z, е, R, T – постоянные величины, а Р и Еа - переменные. Причём, между скоростью реакции и стерическим коэффициентом зависимость прямая, а между скоростью и энергией активации – обратная и степенная зависимость (чем ниже Еа, тем выше скорость реакции).
Механизм действия ферментов сводится к увеличению ферментами стерического коэффициента и уменьшению энергии активации.
Снижение ферментами энергии активации
Например, энергия расщепления Н2О2 без ферментов и катализаторов – 18 000 ккал на моль. Если в качестве катализатора используется платина при высокой температуре, энергия активации снижается до 12 000 ккал/моль. При участии фермента каталазы энергия активации составляет лишь 2 000 ккал/моль.
Уменьшение Еа происходит в результате образования промежуточных фермент-субстратных комплексов по схеме: F+S <=> FS-комплекс → F + продукты реакции. Впервые возможность образования ферментсубстратных комплексов была доказана Л. Михаэлисом, М. Ментеном. Впоследствии многие фермент-субстратные
комплексы были выделены. Для объяснения высокой избирательности ферментов при взаимодействии с субстратом предложена теория «ключа и замка» Э Фишера. Согласно ей, фермент взаимодействует с субстратом только при абсолютном соответствии их друг другу (комплементарность) наподобие ключа и замка. Данная теория объясняла специфичность ферментов, но не раскрывала механизм их воздействия на субстрат. Позже разработана теория
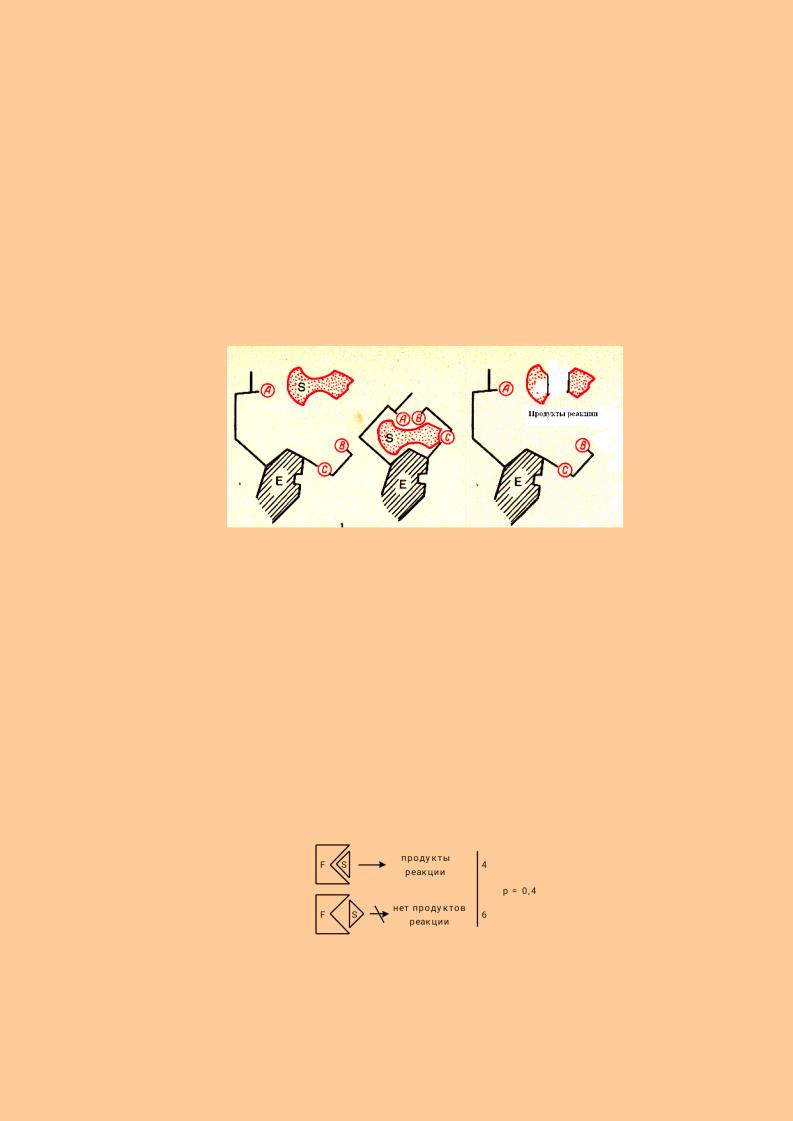
28
индуцированного соответствия фермента и субстрата - теория Д. Кошланда (теория «резиновой перчатки»). Её суть состоит в следующем: активный центр фермента сформирован и содержит все функциональные группы ещё до взаимодействия с субстратом (положение 1 на рисунке). Однако эти функциональные группы находятся в неактивном состоянии. Субстрат при присоединении к ферменту индуцирует изменение положения, структуры радикалов в активном центре фермента. В результате активный центр фермента под действием субстрата переходит в активное состояние и, в свою очередь, начинает воздействовать на субстрат, т.е. происходит взаимодействие активного центра фермента и субстрата (положение 2 на рисунке). Вследствие этого субстрат переходит в нестабильное, неустойчивое состояние, что ведёт к уменьшению энергии активации и образованию продуктов реакции с переходом структуры активного центра в исходное состояние (положение 3 на рисунке).
1 |
2 |
3 |
Взаимодействие фермента и субстрата может заключаться в реакциях нуклеофильного замещения, электрофильного замещения, дегидратации субстрата. Возможно также кратковременное ковалентное взаимодействие функциональных групп фермента с субстратом. В основном происходит геометрическая переориентация функциональных групп активного центра.
Увеличение ферментами стерического коэффициента
Стерический коэффициент вводится для реакций, в которых участвуют крупные молекулы, имеющие пространственную структуру. Стерический коэффициент показывает долю удачных пространственно соответствующих столкновений активных молекул. Например, он равен 0,4, если 4 из 10 столкновений активных молекул привели к образованию продукта реакции.
Ферменты увеличивают стерический коэффициент, так как они изменяют строение молекулы субстрата в фермент - субстратном комплексе, в результате чего комплементарность фермента и субстрата возрастает. Кроме того, ферменты за счёт своих активных центров упорядочивают расположение

29
молекул субстрата в пространстве (до взаимодействия с ферментом молекулы субстрата располагаются хаотично) и облегчают протекание реакции.
2.4. Номенклатура ферментов Ферменты имеют несколько типов названий.
1)Тривиальные названия (трипсин, пепсин).
2)Рабочая номенклатура. В данном названии фермента присутствует окончание – аза, которое прибавляется:
∙к названию субстрата (сахараза, амилаза);
∙к виду связи, на которую действует фермент (пептидаза, гликозидаза);
∙к типу реакции, процесса (синтетаза, гидролаза).
3)У каждого фермента есть классификационное название, в котором отражается тип реакции, вид субстрата и кофермента. Например: ЛДГ – L лактат-НАД+ - оксидоредуктаза.
2.5.Классификация ферментов
Классификация ферментов разработана в 1961 году. Согласно классификации каждый фермент расположен в определённом классе, подклассе, подподклассе и имеет порядковый номер. В связи с этим каждый фермент имеет цифровой шифр, в котором первая цифра обозначает класс, вторая – подкласс, третья – подподкласс, четвертая – порядковый номер (ЛДГ: 1.1.1.27.). Все ферменты классифицируются на 6 классов:
1.Оксидоредуктазы.
2.Трансферазы.
3.Гидролазы.
4.Лиазы.
5.Изомеразы.
6.Синтетазы (лигазы).
Оксидоредуктазы
Ферменты, катализирующие окислительно - востановительные процессы. Общий вид реакции: Аок + Ввос = Авост + Вок. Этот класс ферментов включает несколько подклассов:
1.Дегидрогиназы, катализируют реакции путём отщепления водорода от окисляемого вещества. Они могут быть аэробными (переносят водород на кислород) и анаэробными (переносят водород не на кислород, а на какое-то другое вещество).
2.Оксигеназы - ферменты катализирующие окисление путём присоединения кислорода к окисляемому веществу. Если присоединяется один атом кислорода, участвуют монооксигеназы, если два атома кислорода – диоксигеназы.
3.Пероксидазы – ферменты, катализирующие окисление веществ с участием пероксидов.
Трансферазы
Ферменты, осуществляющие внутримолекулярный и межмолекулярный перенос функциональных групп с одного вещества на другое по схеме: АВ + С = А
+ВС. Подклассы трансфераз выделяют в зависимости от вида переносимых

30
групп: аминотрансферазы, метилтрансферазы, сульфотрансферазы, ацилтрансферазы (переносят остатки жирных кислот), фосфотрансферазы (переносят остатки фосфорной кислоты).
Гидролазы
Ферменты данного класса катализируют разрыв химической связи с присоединением воды по месту разрыва, то есть реакции гидролиза по схеме: АВ + НОН = АН + ВОН. Подклассы гидролаз выделяют в зависимости от вида разрываемых связей: пептидазы расщепляют пептидные связи (пепсин), гликозидазы - гликозидные связи (амилаза), эстеразы – сложноэфирные связи (липаза).
Лиазы
Лиазы катализируют разрыв химической связи без присоединения воды по месту разрыва. При этом в субстратах образуются двойные связи по схеме: АВ = А + В. Подклассы лиаз зависят от того, между какими атомами разрывается связь и какие вещества образуются. Альдолазы катализируют разрыв связи между двумя атомами углерода (например, фруктоза 1,6-ди-фосфатальдолаза «разрезает» фруктозу на две фосфотриозы). К лиазам относят ферменты декарбоксилазы (отщепляют углекислый газ), дегидратазы («вырезают» молекулы воды).
Изомеразы
Изомеразы катализируют взаимопревращения различных изомеров. Например, фосфогексоизимераза переводит эфиры фруктозы в эфиры глюкозы. К подклассам изомераз относятся мутазы (фосфоглюкомутаза переводит глюкозо- 1- фосфат в глюкозо-6-фосфат), эпимеразы (например, переводят рибозу в ксилулозу), таутомеразы
Синтетазы (лигазы).
Ферменты данного класса катализируют реакции синтеза новых веществ за счёт энергии АТФ по схеме: А + В + АТФ = АВ. Например, глютаминсинтетаза катализирует взаимодействие глютаминовой кислоты с NH3, при участии АТФ с образованием глютамина.
2.6. Свойства ферментов Ферменты, помимо общих свойств с неорганическими катализаторами
имеют определённые отличия от неорганических катализаторов. К ним относятся: более высокая активность, более высокая специфичность, более мягкие условия для катализа, способность к регуляции активности.
2.6.1. Высокая каталитическая активность ферментов Ферменты отличаются высокой каталитической активностью. Например,
одна молекула карбоангидразы за одну минуту катализирует образование (или расщепление) 36 миллионов молекул угольной кислоты (Н2СО3). Высокая активность ферментов объясняется механизмом их действия: они уменьшают энергию активации и увеличивают пространственный (стерический коэффициент). Высокая активность ферментов имеет важное биологическое значение, состоящее в том, что они обеспечивают высокую скорость химических реакций в организме.
