
4 курс / Дерматовенерология / Клиническая_дерматология_и_венерология_2020_06
.pdfВ помощь практическому врачу |
Guidelines for practitioner |
—специфические инфекционные (сифилитические, туберкулезные, при лейшманиозе и т.д.);
—язвы при врожденных пороках развития сосудов (гемангиомы и т.д.).
Язвы также могут формироваться после воздействия физических факторов (ионизирующее излучение, сдавление (пролежни), высокие и низкие температуры (ожоги и отморожения), самоповреждение (аутоагрессия), травматическое или послеоперационное воздействие, глубокие пиодермии и т.д.)
упациентов с сопутствующими нарушениями микроциркуляции, иннервации, иммунодефицитом и т.д. [11].
Тяжесть и прогноз язвенного процесса во многом зависят от локализации, размера и глубины дефекта, степени выраженности микроциркуляторных изменений в окружающих тканях, а также от инфицирования язвы. При характеристике язвенного дефекта описывают дно, края и отделяемое. Особое внимание уделяется глубине и площади язвы. Так, в зависимости от глубины деструкции тканей выделяют:
—поверхностную язву в пределах дермы;
—повреждение тканей, достигающее подкожной жировой клетчатки;
—язву, распространяющуюся на субфасциальные структуры, пенетрирующую в полость сустава или внутренние органы.
Размеры язвы могут быть различными: от малых, площадью до 5 см2, до гигантских (˃50 см2).
Эпидемиология
От 1 до 4% населения в мире страдают хроническими язвами нижних конечностей [7, 9]. У 70% пациентов язвы рецидивируют. В России около 2,5 млн человек имеют хронические язвы нижних конечностей [12]. С возрастом распространенность заболевания возрастает и к 65 годам в среднем достигает 5%. Отмечено, что среди пожилых людей, страдающих хроническими язвами нижних конечностей, преобладают одинокие и малообеспеченные. Трофические язвы выявляются с одинаковой частотой у мужчин и женщин, однако отмечено, что мужчины реже обращаются за медицинской помощью, что отражается на официальных эпидемиологических данных. Хроническая венозная недостаточность является самой частой причиной развития трофических язв.
В исследованиях отмечены следующие факторы риска развития длительно незаживающих ран/ язв [13]:
1)длительность существования язвы >3—6 мес;
2)размер язвы >10 см2;
3)нарушение двигательной активности паци-
ентов;
4)злоупотребление алкоголем;
5)боль в области язвы;
6)психосоциальные проблемы (одинокие, малообеспеченные, депрессивные и т.д.);
7)мужской пол;
8)наличие сопутствующих хронических заболеваний (сахарный диабет, гипертония).
Отмечается прямая корреляция между общим состоянием здоровья пациента и скоростью заживления язв [13]. В ведении пациентов с длительно не заживающими язвами/ранами необходим мультидисциплинарный подход [6].
Патофизиология язв
Язва представляет собой динамически меняющееся образование, которое характеризуется определенными функциональным и структурным процессами, проходящими непосредственно как в самой зоне повреждения, так и в окружающих тканях. Повреждения, вызванные внешними (химическими, физическими, механическими) и/или внутренними (нарушением микроциркуляции) факторами, могут нарушать непрерывность кожного барьера и приводить к гипоксии тканей и присоединению микробной колонизации [14]. Обширные повреждения, связанные с тяжелой травмой, могут сопровождаться системной иммуносупрессией, раневой инфекцией, приводя к сепсису и даже смерти. Источником микробной колонизации является не только экзогенная флора («уличная флора» и нозокомиальные и госпитальные штаммы), но и нормальная микробиота кожи и слизистых оболочек индивидуума после нарушения ее привычного баланса.
Стадии раневого процесса
Заживление кожного дефекта — сложный процесс, который включает упорядоченную и своевременную последовательность событий, разделенную на 3 дифференциальные фазы: 1) свертывания и воспаления, 2) пролиферации и формирования тканей, 3) созревания и ремоделирования. Эти фазы не разделены, а, скорее, продолжают друг друга и влияют друг на друга. Течение острых ран можно описать строгой последовательностью фаз раневого процесса, которые приводят в итоге к успешной эпителизации и восстановлению кожного дефекта [9].
Фаза коагуляции и воспаления развивается сразу же после травмы. Цель происходящих в коже изменений — остановить и минимизировать негативные последствия повреждения. Характеризуется адгезией тромбоцитов к поврежденным сосудам, свертыванием крови и активизацией иммунитета. Тромбоциты сразу же начнут вырабатывать тромбоцитарный фактор роста (PDGF) и трансформирующие факторы роста α1 и α2 (TGF-α1, TGF-α2), участвовать в привлечении воспалительных клеток [15]. На ранних стадиях местные дендритные клетки экспрессируют toll-подобные рецепторы (TLR), которые распознают ассоциированные с патогеном молекулярные паттерны (PAMPs) колонизирующих микробов. Это взаимодействие приводит к врожденной иммун-
Russian Journal of Clinical Dermatology and Venereology 2020, Vol. 19, No. 6 |
907 |

В помощь практическому врачу Guidelines for practitioner
ной активации, характеризуемой значительным ре- |
са (сосудистая патология, малоподвижность, тяже- |
крутированием нейтрофилов и моноцитов к месту |
лая травма или же повторные травмы в одной и той |
повреждения [16]. Активные формы кислорода, вы- |
же анатомической зоне, постоянное сдавление тка- |
деляемые скоплением лейкоцитов в ране, оказывают |
ней и хронический отек, формирование инфекци- |
антимикробное действие, активируется система ком- |
онными агентами биопленок и др.), и системные |
племента [17]. Начальные изменения сопровождают- |
факторы (например, сахарный диабет, ожирение, |
ся трансформацией моноцитов в макрофаги и мигра- |
гипертония, хронические воспалительные заболе- |
цией в рану фибробластов, лейкоцитов, кератиноци- |
вания и др.), которые нарушают процессы репара- |
тов и эндотелиальных клеток [18]. |
ции раны [16, 22]. |
В дальнейшем происходит активизация адап- |
Особенности раневого процесса хронических |
тивного иммунитета с участием Т- и В-лимфоцитов |
|
и сложного каскада цитокинов и хемокинов [19]. |
ран/язв |
Данные изменения в ране приводят ко второй |
Хронические раны/язвы отличаются от острых |
фазе пролиферации и формированию ткани, которая |
тем, что их заживление не происходит в физиоло- |
включает в себя 3 важных этапа: повторную эпите- |
гически упорядоченной последовательности собы- |
лизацию, ангиогенез и развитие грануляционной |
тий: оно значительно замедляется и в большинстве |
ткани. Цитокины и факторы роста индуцируют ре- |
случаев формируется порочный воспалительно-ин- |
эпителизацию путем активации фибробластов, ке- |
фекционный круг [6]. Длительно незаживающие ра- |
ратиноцитов, эпителиальных и стволовых клеток. |
ны отличаются от острых (заживающих) ран мор- |
Фибробласты продуцируют коллаген и другие моле- |
фологическими, клиническими, биохимическими |
кулы, которые формируют новый внеклеточный мат- |
и микробиологическими признаками. Соотношение |
рикс, стимулирующий адгезию, рост и дифференци- |
факторов повреждения и репарации в тканях нару- |
ровку клеток [15, 17]. |
шается, что приводит к остановке динамических ре- |
Внеклеточный матрикс состоит из фибронекти- |
генеративных механизмов на начальных стадиях ра- |
на, фибрина, гиалуроновой кислоты и коллагена III |
невого процесса: чаще всего на стадии воспаления |
типа, который позже замещается коллагеном I ти- |
или грануляции и не способствует заживлению ра- |
па [9]. В нормальном процессе регенерации крово- |
ны [15]. Исследования показали, что митотическая |
снабжение играет ключевую роль. Ангиогенез кон- |
активность в хронических ранах очень низкая, а фиб- |
тролируется множественными эндотелиальными |
робласты менее чувствительны к PDGF и трансфор- |
факторами роста, такими как фактор роста тром- |
мирующему фактору роста бета (TGF-β) [6, 9]. Еще |
боцитов (PDGF), сосудистый эндотелиальный фак- |
одной характерной чертой хронических ран являет- |
тор роста (VEGF), фактор роста фибробластов бе- |
ся снижение ангиогенеза и, следовательно, наруше- |
та (FGF-β) и гранулоцитарно-макрофагальный ко- |
ние микроциркуляции, которое приводит к гипок- |
лониестимулирующий фактор (GM-CSF), которые |
сии тканей [6, 15]. |
стимулируют развитие новых кровеносных сосудов, |
MMPs участвуют во всех фазах раневого про- |
улучшая оксигенацию развивающейся ткани [17]. |
цесса, и нарушение баланса между разными типами |
В конце этой фазы фибробласты дифференциру- |
MMPs также может способствовать хронизации яз- |
ются в миофибробласты или подвергаются апоп- |
венного процесса. При хронических язвах отмечает- |
тозу [6, 20]. |
ся усиление экспрессии ММР 3-го и 13-го, а также |
Фаза созревания и ремоделирования тканей мо- |
2-го и 9-го типов [6]. |
жет длиться несколько месяцев и даже лет. В этой |
Еще одним фактором, влияющим на стагна- |
фазе под воздействием матриксных металлопроте- |
цию процесса заживления, является повышенная |
иназ (MMPs) коллаген III типа постепенно замеща- |
концентрация железа, возникающая в результате |
ется фибробластами зрелого рубца на коллаген I ти- |
разрушения эритроцитов и митохондриальной дис- |
па. Активность MMPs регулируется тканевыми ин- |
функции [15]. |
гибиторами MMPs (TIMPs) и другими факторами |
Суммируя вышесказанное, можно отметить, что |
ремоделирования [14]. В этой фазе существенную |
отличительной чертой хронических ран является не- |
роль играет клеточный апоптоз [21]. При нарушении |
достаточная биодоступность разнообразных фак- |
апоптотического процесса развивается патологиче- |
торов роста, критически важных для нормально- |
ское заживление и формируются гипертрофические |
го восстановления поврежденных тканей. Дефицит |
рубцы или келоиды. |
этих факторов, вероятно, обусловлен нарушением |
Нарушение регенерационных процессов может |
их доставки микроциркуляторным руслом, а так- |
быть вызвано множеством потенциальных сопут- |
же снижением их синтеза и/или чрезмерным разру- |
ствующих причин, которые приводят к стагнации |
шением в ране. Такие исследования обосновывают |
раневого процесса. Так, выделяют местные нега- |
назначение в терапевтических схемах лечения хро- |
тивные факторы, влияющие на оксигенацию тканей |
нических ран/язв экзогенных факторов роста (реге- |
и длительность течения воспалительного процес- |
неранты) [15, 23]. |
908 |
Клиническая дерматология и венерология 2020, Т. 19, № 6 |
В помощь практическому врачу |
Guidelines for practitioner |
Микробная колонизация и заживление ран
С давних пор исследователей интересовал вопрос: наличие бактерий в ране — это фактор, стимулирующий заживление, или, наоборот, препятствующий регенерации? В исследовании репаративных процессов (M. Canesso и соавт., 2014) было доказано, что полное отсутствие комменсальной микробиоты у мышей положительно влияет на регенеративные процессы в ранах, которые заживают значительно быстрее, чем при наличии микробной контаминации, и первичным натяжением. При стерильных ранах отмечается незначительное скопление нейтрофилов, увеличение количества стимулирующих заживление макрофагов и усиление ангиогенеза в ране [24].
Дальнейшие многочисленные исследования доказывают негативное влияние микроорганизмов на процесс заживления язвы: чем выше степень микробной контаминации и ярче проявляется вирулентность микроорганизмов, тем медленнее заживает язва [6, 25—29].
Наличие специфических патогенов — важный факт пролонгирования заживления, так как отмечается усиление продукции протеаз и разрушение факторов роста; разрушение экстрацеллюлярного матрикса (фибронектин, плазминоген); усиление тканевой гипоксии.
Клиническими признаками инфекционного воспаления в язве являются боль, гиперемия краев раны, обильное отделяемое гноя и/или раневого экссудата, нарушение заживления, общее септическое состояние. С учетом того, что чаще всего раны колонизируются многочисленными видами бактерий
игрибов, невозможно точно предсказать их индивидуальное влияние на заживление ран [6]. В язвах бактерии могут существовать как в планктонном, так
ив биопленочном состоянии. Бактериальный состав различных типов образцов хронических ран включает в себя большое количество разнообразных видов микроорганизмов. Наиболее часто из хронических язв выделяют Staphylococcus spp. (в основном S. aureus и S. epidermidis) и P. aeruginosa. Отмечено, что коинфекция P. aeruginosa и S. aureus приводит к значительной стагнации язвы по сравнению с одиночными видами контаминации [30, 31].
Значение полимикробных инфекций для заживления язв все больше осознается, особенно в контексте биопленок, включающих как потенциальные патогены, так и комменсальную флору [32]. A. Hotterbeekx и соавт. (2017) описали копатогенность S. aureus с P. aeruginosa, которая базируется на феномене блокирования и сопротивления ингибированию, что и объясняет повышенную резистентность. Несмотря на то что у этих двух микробов отмечается отчетливая конкуренция за пространство и питательные вещества, в хронических ранах эти бактерии могут адаптироваться к присутствию друг друга
иразвить синергические эффекты [33]. Значительно реже из длительно незаживающих ран выделяют другие патогенные и условно-патогенные микроорганизмы: Escherichia coli, Klebsiella spp., Proteus spp., Enterobacter spp., Morganella morganii, Citrobacter freundii, Serratia marcescens и Providencia spp., Enterococcus spp., Streptococcus spp., и редко — Corynebacterium spp. или Acinetobacter baumannii [10, 34, 35].
При воздействии неблагоприятных факторов, нарушающих оптимальное развитие и размножение свободно плавающих (планктонных) бактерий, микроорганизмы формируют биопленки. Биопленки — это структурно и динамически сложные биологические системы, которые определяются как трехмерные микробные консорциумы, где микроорганизмы тесно прикреплены к тканям или друг к другу в пределах экзополисахаридной матрицы [36, 37].
Органическое вещество, окружающее микроорганизмы, имеет смешанное происхождение: бактериальное (полисахариды, белки, ДНК, РНК, липиды)
ивключающее в себя компоненты тканей хозяина (ДНК, РНК, фибрин, тромбоциты, иммуноглобулины) [7].
Отмечено, что полимикробные биопленки более ухудшают заживление ран, чем мономикробные, что, наиболее вероятно, обусловлено синергическими взаимодействиями между бактериями, экспрессирующими различные фенотипы вирулентности.
Таким образом, длительность течения язвенного процесса напрямую коррелирует со степенью колонизации мультирезистентными грамотрицательными бактериями [10, 19], повышением доли анаэробных бактерий в раневой микробиоте [38, 39], а также с наличием моноили полимикробных биопленок [6, 40]. С учетом значимой роли в патогенезе хронического воспаления бактериальной контаминации важным направлением лечения длительно незаживающих ран/язв является противомикробная терапия.
Принципы лечения ран и язв
До 1960-х годов прошлого столетия считалось, что рана должна быть сухой и закрытой, чтобы предотвратить развитие инфекции. В 1962 г. G. Winter установил, что эпителизация ран ускоряется в 2 раза во влажной среде по сравнению с заживлением под струпом (под коркой). Его знаменательная статья опубликована в журнале Nature, в которой он продемонстрировал, что, вопреки общепринятому мнению, раны заживают быстрее, если остаются влажными [41].
Последующие исследования многократно подчеркивали значение влажной среды для заживления ран.
Суммируя основные принципы лечения, можно отметить, что обработка раневой поверхности, местное применение антибиотиков и/или других про-
Russian Journal of Clinical Dermatology and Venereology 2020, Vol. 19, No. 6 |
909 |
В помощь практическому врачу |
Guidelines for practitioner |
тивомикробных веществ, а также стимуляция заживления являются стандартными и неотъемлемыми методами в борьбе с раневой инфекцией и уходе за ранами и язвами.
Применение мази Левомеколь в терапии длительно незаживающих язв и ран
История мази Левомеколь началась в 1970-х годах. В Харьковском фармацевтическом институте группа ученых под руководством проф. И.М. Перцева активно занималась различными биофармацевтическими исследованиями. Испытания мази Левомеколь проводились на кафедре хирургии Харьковской медицинской академии последипломного образования, а позже — в Институте хирургии им. А.В. Вишневского АМН СССР. Спустя несколько месяцев И.М. Перцеву сообщили, что результаты испытания оправдали ожидания исследователей. До создания Левомеколя в мировой медицине не было эффективных средств для местного лечения ран первой фазы воспаления.
Серийное производство препарата началось
в1985 г. на Горьковском химико-фармацевтиче- ском заводе (ныне предприятие «Нижфарм», входящее в международную группу STADA). За 35 лет триумфального шествия по фармацевтическому рынку вначале в СССР, а затем и в постсоветском пространстве мазь Левомеколь помогла сотням тысяч людей, пострадавших в результате различных травм и массовых стихийных и боевых бедствий (землетрясение
вСпитаке (Армения) в 1988 г., раненые во время афганской войны и др.).
Следуя выводам последних исследований, посвященных раневому процессу, идеальное терапевтическое средство для лечения ран и язв должно создавать и поддерживать в раневом дефекте влажную среду и обладать антимикробным, иммуномодулирующим и регенеративным свойствами [23, 42]. Мазь Левомеколь, в состав которой входят действующие (диоксометилтетрагидропиримидин (метилурацил) и хлорамфеникол) и вспомогательные (ма- крогол-1500 и макрогол-400) вещества, полностью соответствует требованиям, предъявляемым к универсальному наружному средству для терапии язв различного генеза.
Мазь Левомеколь разработана по принципам биологической фармацеи, которая изучает биологическое действие лекарственных препаратов в зависимости от фармацевтических факторов, физико-хи- мических свойств лекарственных и вспомогательных веществ, формы, технологии изготовления. Биофармацея оценивает активность лекарственного средства с конкретными вспомогательными веществами,
врастворителе, имитирующем биологические среды организма. Так, макрогол (полиэтиленгликоль), который в мази является вспомогательным веществом, по сути представляет собой важнейший осмотиче-
ский компонент, который поддерживает влажную раневую среду, так необходимую для активизации процессов очищения и заживления раны. Макрогол представляет собой высокомолекулярное вещество, длинные линейные полимеры которого с помощью водородных связей способны удерживать молекулы воды. Макрогол влияет на диаметр и геометрию водной поры, встроенной в бислойную фосфолипидную мембрану белкового канала, и может блокировать проводимость ионных каналов [43].
Хлорамфеникол оказывает бактериостатическое действие. Механизм противомикробного действия связан с нарушением синтеза белков микроорганизмов за счет блокирования пептидилтрансферазной активности путем связывания с 23S рРНК 50S субъединицы рибосомы бактерий. Активен в отношении как грамположительных (Staphylococcus spp., Streptococcus spp.), так и грамотрицательных (Neisseria gonorrhoeae, Neisseria meningitidis, Escherichia coli, Haemophilus influenzae, Salmonella spp., Shigella spp., Klebsiella spp., Serratiaspp, Yersinia spp., Proteus spp., Rickettsia spp.) бактерий, активен также в отношении некоторых крупных вирусов [44]. Устойчивость микроорганизмов к хлорамфениколу развивается относительно медленно.
Метилурацил усиливает рост и размножение клеток, улучшая течение регенерации в поврежденных тканях, ускоряет заживление ран, язв, ожогов, повышает сопротивляемость организма инфекциям.
Мазь Левомеколь — это комбинированный препарат для местного применения, оказывает противовоспалительное, противомикробное и регенерирующее действие, а также легко проникает вглубь тканей без повреждения биологических мембран, стимулируя процессы регенерации. В присутствии гноя и некротических масс антибактериальное действие сохраняется.
Показания к применению: гнойные раны (в том числе инфицированные смешанной микрофлорой) в первой (гнойно-некротической) фазе раневого процесса. Мазь Левомеколь применяют после туалета (дебридмента) раны путем пропитывания стерильных марлевых салфеток и рыхлого заполнения раневого дефекта. Рекомендуется проводить перевязки ежедневно, 1 раз в день, до полного очищения раны от гнойно-некротических масс. При больших раневых поверхностях суточная доза мази в пересчете на хлорамфеникол не должна превышать 3 г. Противопоказания: повышенная чувствительность к компонентам препарата, возраст пациента до 1 года.
Собственные наблюдения
Пациентка М., 97 лет, обратилась к дерматологу амбулаторно 27.02.2020 с жалобами на длительно незаживающую язву левой голени. Из анамнеза известно, что трофическая язва появилась у пациентки после травматизации кожи при проведении ЭКГ меди-
910 |
Клиническая дерматология и венерология 2020, Т. 19, № 6 |
В помощь практическому врачу |
|
Guidelines for practitioner |
|
|
|
|
|
|
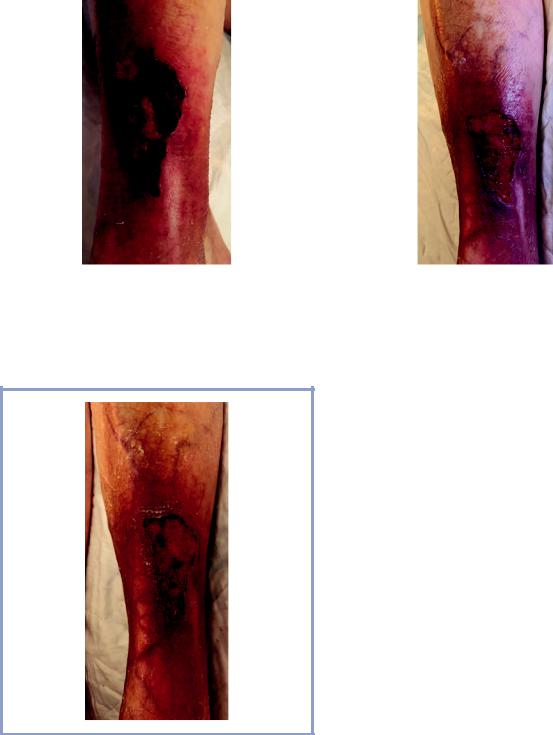
Рис. 1. Длительно незаживающая рана (трофическая язва) левой голени больной М., 97 лет, до лечения.
Fig. 1. Long-term non-healing wound (trophic ulcer) of the left leg of patient M., 97 years old before treatment.
Рис. 2. Та же пациентка на 10-й день после очищения раны от гной- но-некротических масс и применения повязок с мазью Левомеколь.
Fig. 2. The same patient on the 10th day after cleansing the wound from purulent-necrotic masses and applying dressings with Levomekol ointment.
Рис. 3. Та же пациентка на 20-й день применения повязок с мазью Левомеколь.
Fig. 3. The same patient on the 20th day of applying dressings with
Levomekol ointment.
цинским персоналом бригады скорой медицинской помощи. Субъективно беспокоила умеренная болезненность в области язвы. Самостоятельно исполь-
зовала серебросодержащую мазь без видимого положительного эффекта. Страдает гипертонической болезнью II степени с риском сердечно-сосудистых осложнений III степени. Постоянно принимает препараты никотиновой кислоты, диуретики и аспирин в стандартных дозировках.
При осмотре: на передней поверхности голени язва неправильной формы размером 11,0×6,0 см с четкими границами, в краевой зоне некрозы. Язва неглубокая, дно покрыто фибрином и некротическими массами. Кожа вокруг раны умеренно гиперемирована, сухая, с пурпурозными высыпаниями (рис. 1). Пальпация в области язвы болезненная.
Диагноз: длительно не заживающая рана (трофическая язва) посттравматического генеза левой голени.
Назначено амбулаторное лечение. Первый этап терапии (5 дней) включал в себя очищение дна и краев язвы от гнойно-некротических масс хирургическим способом и протеолитическими ферментами (химотрипсин), туалет язвы ежедневно проводили раствором антисептика (пронтосан). На втором этапе терапии с целью дальнейшего очищения раневой поверхности, уменьшения бактериальной нагрузки и ускорения заживления раны пациентке ежедневно назначали повязки с мазью Левомеколь. Для защиты окружающей кожи от мацерации вокруг раны применяли цинкосодержащие средства (крем судокрем), для увлажнения кожи голени — питательный крем (липобейз). Повязки с мазью Левомеколь фиксировали пластырем омнификс. Через 10 дней язва полностью очистилась, активизировался рост гра-
Russian Journal of Clinical Dermatology and Venereology 2020, Vol. 19, No. 6 |
911 |

В помощь практическому врачу |
|
Guidelines for practitioner |
|
|
|
|
|
|
Рис. 4. Та же пациентка через 40 дней после начала лечения мазью Левомеколь.
Fig. 4. The same patient 40 days after the start of treatment with
Levomekol ointment.
Рис. 5. Та же пациентка через 60 дней после начала лечения мазью Левомеколь.
Fig. 5. The same patient 60 days after the start of treatment with
Levomekol ointment.
нуляций (рис. 2). На 20-й день терапии размеры яз- |
жание влажной среды в ране, так как она способ- |
вы несколько уменьшились (до 10,0×5,5 см) за счет |
ствует активизации факторов роста и энзимов, не- |
краевой эпитализации (рис. 3). Сокращение площа- |
обходимых для очищения от гнойно-некротических |
ди язвы практически на 50% отмечено через 40 дней |
масс и эпителизации кожного дефекта. Мазь Лево- |
от начала лечения (рис. 4), а полное заживление — |
меколь — комбинированный препарат для местного |
на 60-й день терапии (рис. 5). |
применения, который обладает выраженным проти- |
|
вовоспалительным, антимикробным, иммуномоду- |
Заключение |
лирующим и регенерирующим свойствами. Осмо- |
|
тический компонент мази Левомеколь способству- |
Местное лечение длительно незаживающих ран/ |
ет созданию и поддержанию влажной среды в ране, |
язв направлено на борьбу с инфекцией, остановку |
при которой размножение бактерий происходит мед- |
кровоточивости, уменьшение выраженности боли, |
леннее, а заживление раневого процесса — быстрее. |
абсорбцию избыточного экссудата и стимуляцию |
|
заживления. Ученые доказали, что для успешного |
Авторы заявляют об отсутствии конфликта интересов. |
заживления трофических язв необходимо поддер- |
The authors declare no conflict of interest. |
ЛИТЕРАТУРА/REFERENCES
1.Спасокукоцкий С.И. Избранные труды. М.: 1948;2. Spasokukotskii SI. Izbrannye trudy. M.: 1948;2. (In Russ.).
2.Дерматовенерология: учебник для медицинских вузов: учебник для студентов медицинских вузов. А.В. Самцов, В.В. Барбинов. Санкт-Пе- тербург: СпецЛит; 2008.
Dermatovenerologiya: uchebnik dlya meditsinskikh vuzov: uchebnik dlya studentov meditsinskikh vuzov. AV Samtsov, VV Barbinov. Sankt-Peterburg: SpetsLit; 2008. (In Russ.).
3.Кожные и венерические болезни: Руководство для врачей. В 4 т. Т. 3. Под ред. Ю.К. Скрипкина. М.: Медицина; 1996.
Kozhnye i venericheskie bolezni: Rukovodstvo dlya vrachei. V 4 tomakh. T. 3. Pod red. YuK Skripkina. M.: Meditsina; 1996. (In Russ.).
4.Руфанов И.Г. Общая хирургия. 6-е изд. Москва: Медгиз; 1957. Rufanov IG. Obshchaya khirurgiya. 6-e izd. Moskva: Medgiz; 1957. (In Russ.).
5.Толстых П.И., Тамразова О.Б., Павленко В.В., Кулешов И.Д. Длительно не заживающие раны и язвы нижних конечностей (патогенез, клиника, лечение). М.: Дипак; 2009.
Tolstykh PI, Tamrazova OB, Pavlenko VV, Kuleshov ID. Dlitel’no ne zazhivayushchie rany i yazvy nizhnikh konechnostei (patogenez, klinika, lechenie). M.: Dipak; 2009. (In Russ.).
6.Sebastian C, Madalina MM, Gabriela PL, Calin G, Ioan PM. Considerations on the pathogenesis of chronic venous ulcers — Review. Infectio.ro. 2015;44:19-24.
912 |
Клиническая дерматология и венерология 2020, Т. 19, № 6 |
В помощь практическому врачу |
Guidelines for practitioner |
7.Mihai MM, Preda M, Lungu I, Gestal MC, Popa MI, Holban AM.Nanocoatings for Chronic Wound Repair-Modulation of Microbial Colonization and Biofilm Formation. Int J Mol Sci. 2018 Apr 12;19(4). pii: E1179. https://doi.org/10.3390/ijms19041179
8.Kahle B, Hermanns HJ, Gallenkemper G. Evidence-based treat-ment of chronic leg ulcers. Dtsch Arztebl Int. 2011;108(14):231-237.
leg ulcers: a 10-year comparison from a German wound care center. J Dtsch Dermatol Ges. 2014;12(12):1121-1127.
28.Körber A, Schmid EN, Buer J, Klode J, Schadendorf D, Dissemond J. Bacterial colonization of chronic leg ulcers: current results ompared with data 5 years ago in a specialized dermatology department. J Eur Acad Dermatol Venereol. 2010;24(9):1017-1025.
9.Rahim K, Saleha S, Zhu X, Huo L, Basit A, Franco OL. Bacterial Contri29. Percival SL. Importance of biofilm formation in surgical infection. Br. J.
bution in Chronicity of Wounds. Microb. Ecol. 2017;73:710-721.
10.Mihai MM, Holban AM, Giurcăneanu C, Popa LG, Buzea M, Filipov M, Lazăr V, Chifiriuc MC, Popa MI. Identification and phe-notypic characterization of the most frequent bacterial etiologies in chronic skin ulcers. Rom J Morphol Embryol. 2014;55(4):1401-1408.
Surg. 2017;104:e85-e94.
30.Pastar I, Nusbaum AG, Gil J, Patel SB, Chen J, Valdes J, Stojadinovic O, Plano LR, Tomic-Canic M, Davis SC. Interactions of methicillin resistant Staphylococcus aureusUSA300 and Pseudomonas aeruginosa in polymicrobial wound infection. PLoS ONE. 2013;8:e56846.
11.Оболенский В.Н., Родоман Г.В., Никитин В.Г., Карев М.А. Трофиче31. Dalton T, Dowd SE, Wolcott RD, Sun Y, Watters C, Griswold JA, Rum-
ские язвы нижних конечностей — обзор проблемы. РМЖ. Хирургия. 2009;17(25):1647-1662.
Obolenskii VN, Rodoman GV, Nikitin VG, Karev MA. Trophic ulcers of the lower extremities — review of the problem. RMZh. Khirurgiya. 2009;17(25): 1647-1662. (In Russ.).
12.Савельев В.С. Флебология. М.: Медицина; 2001. Savel’ev VS. Flebologiya. M.: Meditsina; 2001. (In Russ.).
13.Daeschlein G. Antimicrobial and antiseptic strategies in wound management. Int Wound J. 2013;10 Suppl 1:9-14.
14.Kirker KR, James GA. In vitro studies evaluating the effects of biofilms on wound-healing cells: A review. APMIS. 2017;125:344-352.
15.Demidova-Rice TN, Hamblin MR, Herman IM. Acute and impaired wound healing: Pathophysiology and current methods for drug delivery, part 1: Normal and chronic wounds: Biology, causes, and approaches to care. Adv. Skin Wound Care. 2012;25:304-314.
16.Tsiouris CG, Tsiouri MG. Human microflora, probiotics and wound healing. Wound Med. 2017;19:33-38.
17.Jahromi MAM, Zangabad PS, Basri SMM, Zangabad KS, Ghamarypour A, Aref AR, Karimi M, Hamblin MR. Nanomedicine and advanced technologies for burns: Preventing infection and facilitating wound healing. Adv. Drug Deliv. Rev. 2018;123:33-64.
baugh KP. An in vivo polymicrobial biofilm wound infection model to study interspecies interactions. PLoS ONE. 2011;6:e27317.
32.Shettigar K, Jain S, Bhat DV, Acharya R, Ramachandra L, Satyamoorthy K, Murali TS. Virulence determinants in clinical Staphylococcus aureus from monomicrobial and polymicrobial infections of diabetic foot ulcers. J. Med. Microbiol. 2016;65:1392-1404.
33.Hotterbeekx A, Kumar-Singh S, Goossens H, Malhotra-Kumar S. In vivo and In vitro Interactions between Pseudomonas aeruginosa and Staphylococcus spp. Front. Cell. Infect. Microbiol. 2017;7:106.
34.Bessa LJ, Fazii P, di Giulio M, Cellini L. Bacterial isolates from infected wounds and their antibiotic susceptibility pattern: Some remarks about wound infection. Int. Wound J. 2015;12:47-52.
35.Mihai MM, Popa MI, Popa LG, Ion AV, Calugareanu A, Solomon I, Giurcaneanu C. Antibiotics resistance phenotypes of the bacterial strains isolated from leg ulcers during 5 years in a dermatology department. Acta Dermatovenerol. 2017;62:7-23.
36.Omar A, Wright JB, Schultz G, Burrell R, Nadworny P. Microbial Biofilms and Chronic Wounds. Microorganisms. 2017;5:9. https://doi.org/10.3390/microorganisms5010009
37.Hall-Stoodley L, Costerton JW, Stoodley P. Bacterial biofilms: From the natural environment to infectious diseases. Nat. Rev. Microbiol. 2004;2:95-108.
18.Gurtner GC, Werner S, Barrandon Y, Longaker MT. Wound repair and re38. Rhoads DD, Wolcott RD, Sun Y, Dowd SE. Comparison of culture and mo-
generation. Nature. 2008;453:314-321.
19.Mihai MM, Holban AM, Giurcaneanu C, Popa LG, Oanea RM, Lazar V, Chifiriuc MC, Popa M, Popa MI. Microbial biofilms: impact on the pathogenesis of periodontitis, cystic fibrosis, chronic wounds and medical de- vice-related infections. Curr Top Med Chem. 2015;15(16):1552-1576.
20.Leone AM, Valgimigli M, Giannico MB, Zaccone V, Perfetti M, D’Amario D, Rebuzzi AG, Crea F. From bone marrow to the arterial wall: The ongoing tale of endothelial progenitor cells. Eur. Heart J. 2009;30:890-899.
21.Rai NK, Tripathi K, Sharma D, Shukla VK. Apoptosis: A basic physiologic process in wound healing. Int. J. Low. Extrem. Wounds. 2005;4:138-144.
22.Guo S, Dipietro LA. Factors affecting wound healing. J. Dent. Res. 2010; 89:219-229.
23.Bertesteanu S, Triaridis S, Stankovic M, Lazar V, Chifiriuc MC, Vlad M, Grigore R. Polymicrobial wound infections: Pathophysiology and current therapeutic approaches. Int. J. Pharm. 2014;463:119-126.
24.Canesso MC, Vieira AT, Castro TB, Schirmer BG, Cisalpino D, Martins FS, Rachid MA, Nicoli JR, Teixeira MM, Barcelos LS. Skin wound healing is accelerated and scarless in the absence of commensal microbiota. J. Immunol. 2014;193:5171-5180.
25.Bowler PG. Antibiotic resistance and biofilm tolerance: a combined threat in the treatment of chronic infections. J Wound Care. 2018 May 2;27(5):273-277.
26.Georgescu M, Măruţescu L, Trifu V, Marinescu V, Toropoc I, Chiriţă DA, Poenaru M, Dărmănescu MS, Costache D, Chifiriuc MC. The profile of chronic skin wound microbiota in hospitalized dermatology patients. Biointerface Res Appl Chem. 2014;4(6):885-890.
27.Jockenhöfer F, Chapot V, Stoffels-Weindorf M, Körber A, Klode J, Buer J, Küpper B, Roesch A, Dissemond J. Bacterial spectrum colonizing chronic
lecular identification of bacteria in chronic wounds. Int J Mol Sci. 2012; 13(3):2535-2550.
39.Han A, Zenilman JM, Melendez JH, Shirtliff ME, Agostinho A, James G, Stewart PS, Mongodin EF, Rao D, Rickard AH, Lazarus GS. The importance of a multifaceted approach to characterizing the microbial flora of chronic wounds. Wound Repair Regen. 2011;19:532-541.
40.Romling U, Balsalobre C. Biofilm infections, their resilience to therapy and innovative treatment strategies. J Intern Med. 2012;272(6):541-561.
41.Winter G. Formation of the Scab and the Rate of Epithelization of Superficial Wounds in the Skin of the Young Domestic Pig. Nature. 1962;193:293-294. https://doi.org/10.1038/193293a0
42.Yin R, Dai T, Avci P, Jorge A, de Melo W, Vecchio D, Huang Y, Gupta A, Hamblin M. Light based anti-infectives: Ultraviolet C irradiation, photodynamic therapy, blue light, and beyond. Curr. Opin. Pharmacol. 2013;13:731762.
https://doi.org/10.1016/j.coph.2013.08.009 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
43.Muratkhodjaev JN, Krasilnikov OV, Merzliak PG, Sabirov RZ, Ternovsky VI. A simple method for the determination of the pore radius of ion channels in planar lipid bilayer membranes. FEMS Microbiology: journal. 1992; 105:93-100.
44.Heal CF, Buettner PG, Cruickshank R, Graham D, Browning S, Pendergast J, Drobetz H, Gluer R, Lisec C. Does single application of topical chloramphenicol to high risk sutured wounds reduce incidence of wound infection after minor surgery? Prospective randomised placebo controlled double blind trial. BMJ. 2009 Jan 15;338:a2812. https://doi.org/10.1136/bmj.a2812
Поступила 27.10.2020
Received 27.10.2020
Принята в печать 18.11.2020
Accepted 18.11.2020
Russian Journal of Clinical Dermatology and Venereology 2020, Vol. 19, No. 6 |
913 |
Обмен опытом |
Exchange of experience |
Клиническая дерматология и венерология |
Russian Journal of Clinical Dermatology and Venereology = |
2020, Т. 19, № 6, с. 914-918 |
Klinicheskaya dermatologiya i venerologiya 2020, Vol. 19, No. 6, pp. 914-918 |
https://doi.org/10.17116/klinderma202019061914 |
https://doi.org/10.17116/klinderma202019061914 |
Холодная атмосферная плазма в комплексной терапии акне
© В.Н. КОРОТКИЙ, В.Ю. УДЖУХУ, А.А. КУБЫЛИНСКИЙ, А.А. КАРАМОВА
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России,
Москва, Россия
РЕЗЮМЕ
Одной из актуальных задач современной дерматокосметологии является разработка высокоэффективных и безопасных методов те-
рапии акне.
Цель исследования. Изучение клинической эффективности, безопасности применения и механизмов терапевтического действия хо-
лодной атмосферной плазмы при лечении больных акне.
Материал и методы. Исследования проведены у 75 пациентов с акне в возрасте от 16 до 25 лет. Методом рандомизации больные раз-
делены на 3 группы по 25 человек. Больным 1-й группы проводили монотерапию холодной атмосферной плазмой, во 2-й группе при-
меняли наружные средства: адапален, бензоила пероксид и клиндамицин, больным 3-й группы назначали комплексную терапию холодной атмосферной плазмой и наружными средствами. У больных 1-й группы до и после лечения изучены видовой и количествен-
ный состав микрофлоры кожи, интенсивность продукции кожного сала, состояние микроциркуляторного русла, а также степень
гидратации и pH кожи.
Результаты. Положительный эффект от лечения отмечен у большинства пациентов. Наиболее быстро клинические проявления забо-
левания купировались при комплексной терапии. У больных 1-й группы после курса монотерапии холодной атмосферной плазмой наблюдалось исчезновение с кожи коринобактерий, зеленящего стрептококка, неферментирующих грамотрицательных бактерий и дрож-
жеподобных грибов; количество Propionibacterium acnes уменьшилось более чем в 3 раза, Staphylococcus aureus и Staphylococcus epidermidis — более чем в 2 раза. Кроме того, применение холодной атмосферной плазмы способствовало уменьшению выработки кож-
ного сала, нормализации пассивного кровотока и снижению pH кожи.
Заключение. Клиническая эффективность лечения акне холодной атмосферной плазмой обусловлена ее способностью элиминиро-
вать патогенную и условно-патогенную флору, уменьшать продукцию кожного сала, улучшать состояние микроциркуляторного русла и восстанавливать слабокислый pH кожи. Комплексная терапия акне, включающая применение холодной атмосферной плазмы и наружных средств, характеризуется значительной клинической эффективностью и высоким уровнем безопасности.
Ключевые слова: акне, холодная атмосферная плазма, микрофлора кожи, микроциркуляторное русло кожи.
Короткий В.Н. — https://orcid.org/0000-0002-6502-1596 Уджуху В.Ю. — https://orcid.org/0000-0002-3351-9138 Кубылинский А.А. — https://orcid.org/0000-0002-4645-8215 Карамова А.А. — https://orcid.org/0000-0003-0331-5668
Автор, ответственный за переписку: Уджуху В.Ю. — e-mail: sovet140011@mail.ru
КАК ЦИТИРОВАТЬ:
Короткий В.Н., Уджуху В.Ю., Кубылинский А.А., Карамова А.А. Холодная атмосферная плазма в комплексной терапии акне. Клиническая дерматология и венерология. 2020;19(6):914–918. https://doi.org/10.17116/klinderma202019061914
Cold atmospheric plasma in complex acne therapy
© V.N. KOROTKIY, V.YU. UDZHUKHU, A.A. KUBYLINSKIY, A.A. KARAMOVA
Russian National Research Medical University named after N.I. Pirogov, Moscow, Russia
ABSTRACT
One of the urgent problem of modern dermatocosmetology is the development of highly effective and safe methods of acne therapy.
The Purpose. Study of the clinical efficacy, safety of use and mechanisms of therapeutic action of cold atmospheric plasma in treatment of patients with acne.
Material and methods. The studies were conducted in 75 acne patients aged 16 to 25 years. Patients were randomized into 3 groups of 25 people each. Patients of the 1st group received monotherapy with cold atmospheric plasma, in the 2nd group external agents were used: adapalene, benzoyl peroxide and clindamycin, patients of the 3rd group were prescribed complex therapy with cold atmospheric plasma and external agents. In patients of group 1, before and after treatment, species and quantitative composition of skin microflora, intensity of sebum production, state of microvasculature, and degree of hydration and pH of skin were studied.
Results. The positive effect of treatment was noted of majority of patients. Clinical manifestations of disease were most quickly relive with complex therapy. In patients of 1st group, after a course of monotherapy with cold atmospheric plasma, disappearance of corynobacteria, green streptococcus, non-fermenting gram-negative bacteria and yeast-like fungi from the skin was observed; the number of Propionibacterium acnes decreased more than 3 times, Staphylococcus aureus and Staphylococcus epidermidis — more than 2 times. In addition, use of cold atmospheric plasma contributed to a decrease in sebum production, normalization of passive blood flow and decrease skin pH.
Conclusion. Clinical effectiveness of acne treatment with cold atmospheric plasma is due to its ability to eliminate pathogenic and conditionally pathogenic flora, reduce sebum production, improve the state of the microvasculature, and restore subacidic skin pH. Complex acne therapy, including the use of cold atmospheric plasma and external agents, is characterized by significant clinical efficacy and high level of safety.
Keywords: acne, cold atmospheric plasma, skin microflora, microvasculature of the skin.
914 |
Клиническая дерматология и венерология 2020, Т. 19, № 6 |

Обмен опытом |
Exchange of experience |
Korotkiy V.N. — https://orcid.org/0000-0002-6502-1596
Udzhukhu V.Yu. — https://orcid.org/0000-0002-3351-9138
Kubylinskiy A.A. — https://orcid.org/0000-0002-4645-8215
Karamova A.A. — https://orcid.org/0000-0003-0331-5668
Corresponding author: Udzhukhu V.Yu. — e-mail: sovet140011@mail.ru
TO CITE THIS ARTICLE:
Korotkiy VN, Udzhukhu VYu, Kubylinskiy AA, Karamova AA. Cold atmospheric plasma in complex acne therapy. Russian Journal of Clinical Dermatology and Venereology = Klinicheskaya dermatologiya i venerologiya. 2020;19(6):914–918. (In Russ.). https://doi. org/10.17116/klinderma202019061914
Введение
Изучение акне — одна из наиболее актуальных задач современной дерматокосметологии [1, 2]. В настоящее время акне выявляют у 70–80% подростков и лиц в возрасте 18–25 лет [3, 4]. В последние годы отмечается тенденция к более тяжелому течению акне с наличием глубоких болезненных узло- вато-кистозных образований. При длительном течении заболевания нередко возникают депрессия и социальная дезадаптация пациентов, существенно снижается их качество жизни [5]. Анализ данных российских и зарубежных авторов свидетельствует о том, что акне возникают вследствие гиперкератинизации фолликулярного канала и воспаления в перифолликулярных зонах, обусловленного интенсивной колонизацией разнообразной микрофлорой, включая Propionibacterium acnes (P. acnes). Показано большое значение генетической предрасположенности, различных нарушений гормонального статуса, дисбаланса иммунной системы (как врожденного, так и адаптивного иммунитета), приводящего к усиленной выработке провоспалительных интерлейкинов [6]. Нередко акне возникают на фоне себореи, характеризующейся нарушениями продукции кожного сала.
Целью лечебных мероприятий при таком дерматозе является уменьшение воспаления, колонизации P. acnes, образования кожного сала и влияния андрогенов на сальные железы [7]. Тактика лечения акне зависит от степени тяжести заболевания. При легкой степени акне назначают только наружную терапию, при средней степени наружные средства в ряде случаев сочетают с системной терапией, при тяжелой степени проводят системную терапию, включающую антибактериальные препараты (в основном тетрациклины) и ретиноиды [8, 9]. Доказана способность ретиноидов значительно уменьшать секрецию кожного сала (в том числе вследствие уменьшения размеров сальных желез) и уровень обсемененности кожи P. acnes [9]. Однако наличие противопоказаний к назначению системных ретиноидов, а также возможность развития серьезных побочных, в том числе тератогенных эффектов значительно сужают их практическое
применение [10]. Данные литературы свидетельствуют об эффективности антибактериальной терапии акне. Вместе с тем в последние годы отмечается возрастающая антибиотикорезистентность P. acnes, приводящая к значительному снижению степени терапевтического ответа. Наружная терапия акне отличается значительным разнообразием [8]. Широко применяются средства, восстанавливающие слабокислотный pH кожи и снижающие обсемененность кожи и ее придатков микрофлорой [8]. В наружной терапии часто используют ретиноиды, обладающие комедонолитическим свойством, антибиотики (тетрациклины, эритромицин и клиндамицин) и себостатики [10].
Цель исследования — изучение клинической эффективности, безопасности применения и механизмов терапевтического действия холодной атмосферной плазмы при лечении больных акне.
Материал и методы
Работа проведена на базе филиала «Черемушкинский» Московского научно-практического центра дерматовенерологии и косметологии Департамента здравоохранения Москвы. От всех пациентов получено письменное информированное согласие на участие в исследовании. Критерии включения больных в исследование: мужской или женский пол, возраст от 16 до 25 лет, клинические проявления акне легкой или средней степени тяжести, длительность заболевания не менее 3 мес. Критерии исключения: тяжелые хронические заболевания, туберкулез, ВИЧ, сифилис, онкологические заболевания, терапия системными ретиноидами.
Всего под наблюдением находились 75 больных акне в возрасте от 16 до 25 лет (средний возраст 18,3±2,3 года), из них 35 (46,7%) юношей и 40 (53,3%) девушек. Длительность заболевания составляла в среднем 3,4±1,2 года. Методом рандомизации пациенты разделены на три группы по 25 человек. Больным 1-й группы проводили монотерапию холодной атмосферной плазмой с применением аппарата «Гелиос» производства «НПЦ «ПЛАЗМА» (Россия). При легкой степени тяжести акне назначали 15 ежедневных процедур лечения
Russian Journal of Clinical Dermatology and Venereology 2020, Vol. 19, No. 6 |
915 |
Обмен опытом |
Exchange of experience |
холодной атмосферной плазмой (с экспозицией по 20 с на 1 см2 кожи), при средней степени тяжести проводили 20 аналогичных процедур. Во 2-й группе пациентов осуществляли лечение наружными средствами: гелями адапалена и бензоила пероксида или клиндамицина и бензоила пероксида, которые наносили на кожу, предварительно очищенную гелем для умывания, ежедневно в течение 8 нед. Больным 3-й группы назначали комплексную терапию, включавшую воздействия холодной атмосферной плазмой и нанесение на кожу гелей адапалена и бензоила пероксида или клиндамицина и бензоила пероксида в течение 8 нед.
Увсех пациентов до и после лечения оценивали степень тяжести заболевания и качество жизни, которые определяли с помощью дерматологического индекса акне (ДИА) и опросника «Дерматологический индекс качества жизни» (ДИКЖ, Finlay, 1994).
Оценку эффективности терапии осуществляли по общепринятой градации: клиническое выздоровление — полный регресс патологического процесса, значительное улучшение — регресс патологических элементов более чем на 75%, улучшение — разрешение элементов не менее чем на 30%, отсутствие эффекта — разрешение элементов менее чем на 30%.
Убольных 1-й группы, получавших монотерапию холодной атмосферной плазмой, до и после лечения изучены видовой и количественный состав микрофлоры кожи, интенсивность секреции кожного сала, состояние микроциркуляторного русла, а также степень гидратации и pH кожи. Верификацию видового состава микрофлоры осуществляли путем микроскопии исследуемого материала, взятого из высыпаний (окраска по Грамму). Степень микробной обсемененности определяли методом секторного посева на агаре Schalder с необходимыми для культивирования облигатно-анаэробных микроорганизмов добавками. Измерение секреции кожного сала выполняли с использованием себометра SM 810 (Германия). Состояние микроциркуляторного русла в пораженной коже исследовали методом лазерной допплеровской флоуметрии с использованием анализатора капиллярного кровотока «ЛАКК-01» НПП «ЛАЗМА» (Москва, Россия). Гидратацию и pH кожи определяли 1 раз в неделю на протяжении 4 нед с помощью корнеометра СМ825 (принцип измерения: емкостное сопротивление, единицы измерения: условные (корнеометрические) единицы, частота, на которой проводились измерения: 0,9–1,2 МГц) и pH-метра PH 98110 (КНР).
Статистическую обработку полученных данных проводили методом вариационной статистики с помощью статистической программы IBM SPSS Statistics 24.0.0.0, Microsoft Excel для Office 365 MSO (16.0.12430.20112), 32-разрядная версия. Достоверность различий средних арифметических значений оценивали с применением критерия Уилкоксона—
Манна—Уитни (Wilcoxon—Mann—Whitney test). При сравнении частотных показателей применяли критерий χ2 или точный критерий Фишера. При оценке количественных показателей зависимых групп применяли регрессионный анализ по Фридману. Различия считали статистически достоверными при p<0,05.
Результаты и обсуждение
Изучение данных анамнеза больных и особенностей клинического течения акне показало, что заболевание обычно начиналось с появления на коже на фоне повышенного салоотделения многочисленных открытых и закрытых комедонов, которые трансформировалась в папулы, а затем вследствие воспалительной деструкции фолликулов возникали пустулы. У большинства пациентов наблюдался полиморфизм высыпаний — на коже имелись комедоны, папулы и пустулы. Патологический процесс локализовался преимущественно на коже лица (лоб, нос, верхняя часть подбородка), у 8 пациентов со средней степенью тяжести заболевания высыпания отмечены на верхней части груди и спины. У 38% наблюдавшихся пациентов установлена легкая степень тяжести акне (4,9±0,18 балла), у 62% пациентов — средняя (8,7±0,6 балла).
Среднее значение ДИКЖ составило 5,9±1,2 балла, что позволило сделать вывод об умеренной степени негативного влияния акне на качество жизни пациентов. Степень тяжести патологического процесса, длительность заболевания и возраст больных существенно не влияли на величину ДИКЖ. В то же время у лиц женского пола среднее значение ДИКЖ (6,7±1,4 балла) было выше, чем у юношей (4,4±0,9 балла).
Положительные сдвиги в течение заболевания у большинства пациентов всех групп выявлялись уже
впервые дни проводимой терапии. На фоне уменьшения клинических проявлений жирной себореи значительно снижалось количество открытых и закрытых комедонов, а также папул и пустул. В последующем прослеживалась устойчивая положительная динамика в течении патологического процесса, характеризовавшаяся регрессом высыпаний. Наиболее быстро клинические проявления заболевания купировались при комплексном применении холодной атмосферной плазмы и средств наружной терапии (3-я группа больных). Так, в ряде случаев полный регресс высыпаний наблюдался уже на 8–10-й день терапии.
Оценка результатов лечения показала, что
в1-й группе у 8 (32%) пациентов достигнуто клиническое выздоровление, у 8 (32%) — значительное улучшение, у 7 (28%) — улучшение, у 2 (8%) клинический эффект отсутствовал. Во 2-й группе у 9 (36%) пациентов наступило клиническое выздоровление,
916 |
Клиническая дерматология и венерология 2020, Т. 19, № 6 |
