
6 курс / Клинические и лабораторные анализы / Клиническая_лабораторная_диагностика_Учебник_В_В_Долгова_2016
.pdfграфиков осуществляется автоматически. Для каждого прибора необходимо проводить свою калибровку.
Метод сравнения стандартного и опытного образца. Этот метод определения концентрации является наиболее приемлемым, так как анализируемая и калибровочная пробы обрабатываются в одинаковых условиях. Поэтому при больших сериях исследований калибровочную пробу рекомендуют исследовать в начале серии и примерно через каждые 20
анализируемых проб, определяя отношение сст / Аст или фактор (F).
Расчет по стандарту обозначается в том случае, если используется уравнение сi = Аi сст / Аст
Расчет по фактору – это тот случай, когда используется уравнение c=А F.
Следует помнить, что в опытной и стандартной пробах должно обрабатываться одинаковый объем образца. Данный метод расчета справедлив только на линейном диапазоне зависимости абсорбции от концентрации.
Измерение по конечной точке (end point method). Реакция,
сопровождающаяся изменением фотометрического сигнала, развивается за некоторый период времени и достигает определенного конечного состояния,
так называемой конечной точки. Изменение сигнала как функция времени представлено на рис. 2.4. При измерении по конечной точке уровень сигнала соответствует количеству продуктов реакции в инкубационной среде после фиксированного времени инкубации. Абсорбция измеряется после окончания реакции при стабильном значении сигнала.
111
Абсорбция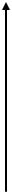
Конечная точка
буфер проба
реактив
А = Аобщ – Абланка
Бланк по рабочему раствору
Бланк по кювете
в р е м я
Рис. 2.4. Измерение по конечной точке. Стрелками показаны моменты внесения буфера, реактива и биологической пробы, в качестве которой может быть сыворотка, плазма, моча и другая биологическая жидкость
Для исключения систематического влияния на результаты измерения внешних факторов (вне пробы), в частности буфера, реактива используют схему с измерением бланка. Как правило, бланк определяется по готовому к употребления реактиву. Абсорбция пробы (Апробы) рассчитывается по
соотношению Апробы Аконечной точки Абланка
При измерении по конечной точке с бланком рекомендуется составлять рабочую таблицу. Примером может служить табл. 2.1, составленная для определения аналита с использованием стандартного раствора.
Измерение скорости изменения абсорбции. В клинической биохимии фотометрические измерения в большинстве случаев проводятся непосредственно при протекании биохимических реакций, в процессе которых потребляются субстраты, повышаются продукты реакций или меняются ко-факторы реакций.
Тест Варбурга (УФ-тест) является одним из самых распространенным оптических тестов. Тест Варбурга основан на том, что один из продуктов дегидрогеназной реакции – восстановленная форма никотинамидадениндинуклеотид или его фосфат (НАДН или НАДФН) –
имеет максимум поглощения при длине волны 340 нм, а их окисленные формы при этой длине волны практически не поглощают (рис. 2.5). УФ-тест
112
Рекомендовано к покупке и прочтению разделом по физиологии человека сайта https://meduniver.com/

может быть использован для определения скоростей тех реакций, в которых не участвуют НАД или НАДФ, но образующиеся продукты в сопряженных ферментативных реакциях приводят к окислению НАДН или восстановлению НАД (непрямой оптический тест Варбурга).
Таблица 2.1
Рабочая таблица для определения концентрации аналита методом измерения с бланком по рабочему реактиву
|
|
Бланк |
|
|
|
Стандарт |
Проба |
||
Рабочий раствор |
1 мл |
|
|
|
1 мл |
1 мл |
|||
Дистиллированная вода |
10 мкл |
|
|
|
|
– |
– |
||
Стандарт |
– |
|
|
|
10 мкл |
– |
|||
Проба |
– |
|
|
|
|
– |
10 мкл |
||
Перемешать, измерить оптическую плотность через 5 мин инкубации |
|||||||||
Содержание аналита в пробе ( Спробы) рассчитывается по соотношению |
|||||||||
|
|
Спробы |
|
Апробы Абланка |
|
|
|||
|
|
Астандарта |
Абланка |
|
|||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.5. Спектры поглощения НАД+ и НАД Н. Восстановление НАД+ до НАД Н прослеживается при 340 нм – при этой длине волны имеется максимум поглощения НАД Н, а НАД+ не поглощает свет
При кинетическом определении вычисляют изменение экстинкции за 1
мин и рассчитывают активность по формуле: |
A |
V 1000 |
|
|
E |
|
, где А – |
|
l v |
мин |
|||||||
|
|
|
|
|||||
активность фермента, измеряемая в международных единицах (МЕ или Ед или U), определяется как количество фермента, которое катализирует превращение 1 микромоля (мкмоль) субстрата в 1 минуту. Каталитическая
113
активность фермента выражается числом единиц, рассчитанных для 1 литра биологической жидкости (Ед/л).
V – объем реакционной смеси, мл;
1000 – коэффициент перерасчета на 1 л сыворотки;
– коэффициент миллимолярной экстинкции НАДН в реакции
6,22 л/(ммоль см);
l – длина оптического пути (1 см);
v – объем пробы (сыворотки крови или другого материала), мл;
E – изменение экстинции за 1 мин.
Результат арифметических вычислений для первой дроби формулы
является фактором (F). Значение фактора вводится в программу фотометра или биохимического анализатора, в результате активность фермента
рассчитывают следующим образом: A F E / мин . При определении
активности ферментов с использованием диагностических наборов известен используемый хромоген (следовательно, известен его коэффициент молярной экстинкции), установлены объем реакционной среды и объем образца,
измерение проводится в кювете с длиной оптического пути 1 см. Поэтому расчет активности фермента проводится по фактору (F), умноженному на
E/мин. Фактор приводится в инструкциях для разных температур инкубации. В современных программируемых фотометрах и биохимических анализаторах все расчеты программируются, и результаты получаются в конечном виде.
Иммунохимические фотометрические методы анализа.
Иммунохимические методы исследования – это совокупность диагностических методов, основанных на специфическом взаимодействии антигенов и антител с образованием иммунных комплексов. Ключевым принципом иммунохимических методов является участие на разных стадиях проведения лабораторного анализа иммуноглобулинов (моно- и
поликлональных антител) и антигенов, входящих в состав тест-систем для
114
Рекомендовано к покупке и прочтению разделом по физиологии человека сайта https://meduniver.com/
лабораторных исследований. Один из компонентов реакционной смеси является определяемым веществом (образец), другой (компонент иммунной системы, находящийся в составе реагентов) обладает специфичностью по отношению к определяемому веществу и является узнающим. На протекание иммунохимических реакций влияют общие неспецифические условия
(лабораторная посуда, качество воды), специфические для данной системы характеристики (свойства и размер антигена, класс антител), а также условия проведения теста и качество реагентов (среда реакции, состав реагентов, рН,
температура), характер связи специальной метки с образовавшимся иммунным комплексом. Современные иммунохимические методы способны в процессе анализа выявлять как один аналит (определять один показатель),
так и несколько диагностических показателей (мультиплексный анализ).
В зависимости от механизма проведения и учета результатов реакции образования иммунных комплексов, иммунохимические методы исследования подразделяют:
Методы без использования специальных меток для выявления результата. К иммунохимическим методам без использования специальных меток относят методы турбидиметрии и нефелометрии.
Иммунохимические методы с применением специальных меток для выявления результата. Благодаря высокой чувствительности и специфичности, эти методы широко применяются в клинической лабораторной диагностике. В зависимости от типа метки выделяют:
иммуноферментный анализ (ИФА), иммунофлюоресценцию (ИФЛ),
иммунохемилюминисценцию (ИХЛ), радиоиммунный анализ (РИА).
Турбидиметрия и нефелометрия. Если поместить мутный раствор в кювету фотометрического прибора, то световой поток, проходя через кювету,
будет поглощаться, частично проходить через кювету, не изменяя направления (трансмиссия), частично рассеиваться, отклоняясь под разными углами. Трансмиссия и рассеивание света зависят от длины волны светового
потока, его частоты, интенсивности, а также от свойства рассеивающей
115
среды: размера частиц, их формы, количества, способности к поляризации.
Если в процессе измерения размер частиц в растворе будет меняться
(например, в результате взаимодействия антиген-антитело), то будет соответственно меняться поток проходящего и интенсивность рассеянного света. Методы турбидиметрии и нефелометрии можно автоматизировать, что делает возможным получение результата анализа в течение нескольких минут.
Нефелометрия и турбидиметрия – методы количественного иммунохимического анализа, основанные на измерении интенсивности света,
рассеянного дисперсной системой (Ir ) (нефелометрия) или прошедшего через нее (турбидиметрия) (It ) (рис. 2.6).
Турбидиметрия – измерение прошедшего через кювету потока светового пучка. В качестве турбидиметра можно использовать большинство фотометров и биохимических анализаторов, в которых имеется возможность построения нелинейной калибровочной кривой. Закон Бугера-Ламберта –
Бера для прошедшего потока записывается: It Io 10 |
tC , |
где t – молярный |
коэффициент мутности раствора или турбидиметрия, |
Io |
– интенсивность |
падающего на кювету света, С – концентрация исследуемого вещества.
Таким образом, интенсивность пучка (плотность потока) параллельных
лучей света при прохождении через кювету меняется по экспоненциальному закону.
Турбидиметрия применяется для анализа взвесей, суспензий и других мутных сред. В клинико-лабораторной практике используют иммунотурбидиметрические исследования, основанные на регистрации образования иммунных комплексов антиген-антитело, сопровождающихся образованием соответствующего преципитата, для повышения мутности применяют латексные частицы, на которые сорбируют антитела.
116
Рекомендовано к покупке и прочтению разделом по физиологии человека сайта https://meduniver.com/
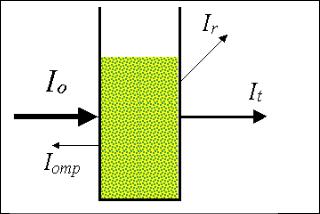
Рис. 2.6. Схема нефелометрии и турбидиметрии. Турбидиметрия – измерение прошедшего светового потока через мутный раствор (It ), нефелометрия – измерение рассеянного света, которое может регистрироваться под разными углами (Ir )
Особенностью турбидиметрических определений является построение калибровочного графика с использованием не менее пяти концентраций, так как калибровочный график имеет нелинейный характер. Калибровочный график (стандартная кривая, рис. 2.7) строится для каждого аналита, для каждого прибора, при любом изменении условий регистрации и периодически по мере проведения исследований. При серийных исследованиях в стандартных условиях допускается корректировка кривой на основании измерения одного из стандартов. Это основано на наблюдении о том, что характерный вид стандартной кривой не меняется из-за влияния систематических факторов, а происходит параллельный сдвиг всей кривой.
В этих случаях производят пересчет кривой, так, чтобы она шла параллельно первичной кривой, но проходила бы через новую точку. Для построения стандартной кривой используются стандарты, которые поставляются в составе соответствующего тест-набора.
117

сигнал
Станд. 3
Станд. 2
Станд.6
Ст.1
Станд.5
Станд.4
Концентрация антигена
Рис. 2.7. Стандартная кривая, характерная для определения индивидуальных белков турбидиметрическим и нефелометрическим методами. Для построения кривой требуется по крайней мере 5 стандартных растворов антигена
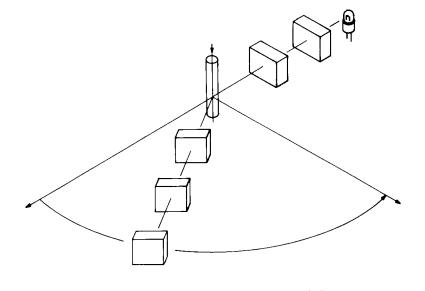
Нефелометрия – измерение рассеянного света, позволяющее определять характер и концентрацию рассеивающих частиц. Нефелометр – прибор, измеряющий рассеянный свет. На рис. 2.8 представлена принципиальная схема нефелометра. Измерение светорассеивания под разными углами (как правило, используются измерение малоуглового рассеивания) дает информацию о размерах частиц в растворе. Если известны размеры частиц рассеивающего вещества, то возможно по интенсивности рассеянного света при фиксированном угле измерения определить концентрацию вещества. Методы, основанные на взаимодействии антиген-
антитело, высокоспецифичны, поэтому практически во всех случаях известно, что измеряется. Исходя из этого, приборы для нефелометрии программируются под измерение определенных специфических компонентов биологической жидкости, интенсивность рассеянного света этом случае отражает количество (концентрацию) исследуемого антигена. В
нефелометрах часто используют лазерные источники излучения. Лазер имеет высокую интенсивность излучения, строгую направленность излучения и
118
Рекомендовано к покупке и прочтению разделом по физиологии человека сайта https://meduniver.com/
фиксированную длину волны, поэтому когерентная природа лазерного луча
делает его идеальным для нефелометрических измерений.
|
|
|
|
|
|
Кювета с образцом |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
лампа |
|
|
|||||||||||||
|
|
|
|
|
|
|
биожидкости |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
оптические |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
линзы |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
монохроматор |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
оптические |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
линзы |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
0о |
|
|
|
|
|
|
|
|
|
|
|
|
|
90о |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
фильтр детектора |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Б |
|
|
|
||||
|
|
|
|
|
|
|
|
детектор |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Угол измерения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
рассеивания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
А |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.8. Принципиальная схема нефелометра. А – нефелометр, регистрирующий малоугловое рассеивание, Б – нефелометр, регистрирующий рассеивание под углом 90о, В – турбидиметр
Иммуноферментный анализ. Иммуноферментный анализ (ИФА) –
один из наиболее надежных видов иммунохимического анализа,
высокочувствительный, экономически выгодный метод, применяемый для качественного и количественного анализа антител и антигенов. Для выявления образующегося комплекса антигена и антител используют в качестве метки фермент или фермент-зависимое вещество. Метод
характеризуется относительной простотой проведения реакции,
возможностью приборного учета результатов и автоматизации всех этапов анализа. В основе метода ИФА лежит оценка результатов иммунной реакции антигена с антителом. Полученный комплекс определяется следующим образом: в реакционную смесь вводится коньюгат, который включает ферментную метку, а также добавляют специальный хромогенный субстрат.
Фермент, взаимодействуя с субстратом, изменяет его окраску. Учет
119
результатов проводят фотометрически. Существует несколько модификаций
метода ИФА
Гетерогенный (твердофазный) ИФА в микропланшетном формате
получил наибольшее распространение в тест-системах для лабораторных исследований. В качестве твердой фазы используется поверхность лунок полистиролового планшета, на которую адсорбированы входящие в состав тест-системы известные антигены или антитела (иммуносорбент). В ходе специфической реакции иммуносорбента с определяемыми в исследуемом образце антителами (АТ) или антигенами (АГ) образуются иммунные комплексы, которые оказываются фиксированными на твердой фазе.
Субстанции, не участвующие в реакции, и избыточное количество реагентов удаляются при многократной промывке. По механизму реакции среди гетерогенных методов различают конкурентный и неконкурентный.
Непрямой неконкурентный гетерогенный ИФА представлен несколькими этапами (рис. 2.9):
1. На твердой поверхности пластиковой лунки сорбирован антиген
(АГ). В лунку вносится исследуемый биологический материал, чаще всего сыворотка крови пациента.
2.Исследуемые антитела (АТ) во время инкубации связываются с антигеном, сорбированным на планшете. Несвязавшиеся белки удаляют отмыванием.
3.В лунку вносят конъюгат – то есть АТ с заранее прикрепленным к ним ферментом, например пероксидазой, способные связаться с АТ человека,
закрепившимися на иммуносорбенте. Если в ячейке имеются образовавшиеся на первой стадии процесса иммунные комплексы, то конъюгат соединяется с определяемыми антителами во время второй инкубации. Несвязавшийся конъюгат остается в жидкой фазе и удаляется отмыванием.
120
Рекомендовано к покупке и прочтению разделом по физиологии человека сайта https://meduniver.com/
