
4 курс / Оториноларингология / Иммуноцитологические_исследования_в_оториноларингологии_Арефьева
.pdf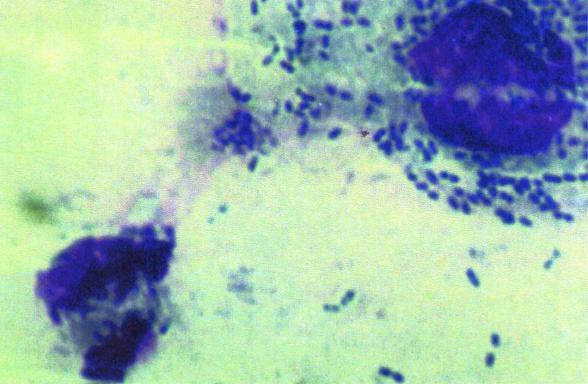
Рис.21. Клетки плоского эпителия, покрытые микроорганизмами (х630)
40
3. РОЛЬ НЕБНЫХ МИНДАЛИН В ФОРМИРОВАНИИ
МЕСТНОГО ИММУНИТЕТА СЛИЗИСТЫХ
ОБОЛОЧЕК НОСА И ГЛОТКИ
В последние десятилетия появилось много данных о важной роли структур лимфоидного кольца глотки в обеспечении иммунитета слизистых оболочек верхних дыхательных путей (Хмельницкая Н.М., 1983; Завгород-
няя Е.Г., 1988; Карась А.Ф., Елисеева Т.А., 1991; Быкова В.П., 1999; Забо-
лотный Д.И. с соавт., 1999). Одними из наиболее изученных структур являются небные миндалины.
Во взрослом организме небные миндалины представлены двумя те-
лами овальной формы, расположенными по обеим сторонам глотки между небными дужками. Они локализуются на пересечении воздухоносных и пи-
щепроводных путей, где особенно велика вероятность массивного антиген-
ного воздействия. Функция небных миндалин оценивается как стратегиче-
ская, способствующая созданию региональной иммунологической защиты.
Небные миндалины относятся к лимфоэпителиальным органам, име-
ющим много общего с лимфатическими узлами, – их паренхима также представлена фолликулярной и диффузной тканью, однако они не имеют замкнутой капсулы и афферентных лимфатических сосудов. Антигенная стимуляция лимфоцитов осуществляется за счет антигенов, поступающих через покровный эпителий слизистых оболочек (Быкова В.П.,1997).
Структурные особенности небных миндалин свидетельствуют об их более активном состоянии в период роста и полового созревания ребенка,
чем во взрослом и старческом возрасте. Слабое развитие небных миндалин в детском возрасте может указывать на некоторые типы врожденного им-
мунодефицита (Kotyza F., Slipka J., 1988).
Зевная поверхность небных миндалин покрыта многослойным плос-
ким неороговевающим эпителием, который, погружаясь в подлежащую
41
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
лимфоидную ткань, образует в каждой небной миндалине 10–20 первич-
ных крипт. Они, вдаваясь в прилежащую лимфоидную ткань, образуют вто-
ричные крипты (Завгородняя E.Г., 1988).
Паренхима небных миндалин состоит из фолликулярной В-зависи-
мой зоны, занимающей 1/3 всей площади лимфоидной ткани и экстрафол-
ликулярной Т-зависимой зоны, составляющей остальные 2/3 площади
(Быкова В.П., 1997). В-зависимая зона представлена лимфатическими узелками – первичными и вторичными фолликулами. Во вторичных лим-
фатических фолликулах осуществляются клональная пролиферация и лифференцировка эффекторных В-клеток. Т-зависимая зона образована диффузной лимфоидной тканью, окружающей многочисленные венулы с высоким эндотелием. Через стенку посткапиллярных венул происходит ге-
матотканевой обмен лимфоцитов.
Ткань небных миндалин содержит В- и Т-клеточные популяции лим-
фоцитов, при этом преобладающей является В-клеточная популяция
(около 50% всего клеточного состава). Т-клетки составляют около 25%. В
миндалинах в результате кооперации Т- и В-лимфоцитов В-клетки спо-
собны дифференцироваться в продуценты иммуноглобулинов (Завгород-
няя Е.Г., 1988).
Изучение структуры небных миндалин дало возможность выделить в них морфофункциональную единицу – криптолимфон. Каждый крипто-
лимфон образован лимфатическим фолликулом с герминативным центром,
субэпителиальной диффузной лимфоидной тканью и зоной лимфоэпите-
лиального симбиоза на участке криптального эпителия, проецируемого на данный фолликул (Быкова В.П., 1997).
Содержимое крипт является источником постоянной антигенной сти-
муляции и, соответственно, постоянной иммунологической информации,
необходимой для поддержания иммунологического гомеостаза организма.
Parkinson R. (1951) назвал миндалины «своеобразными естественными вак-
цинными лабораториями».
42
Эпителий, выстилающий крипты, имеет внутри эпителиальные ходы.
С их помощью лимфоциты, образовавшиеся в зародышевых центрах лим-
фоидных фолликулов миндалин, могут вступать в контакт с антигеном в просвете крипт, а затем возвращаться в межфолликулярную лимфоидную ткань, тем самым способствуя формированию иммунологических реакций
(Хмельницкая Н.М., 1983), (рис. 22, 23).
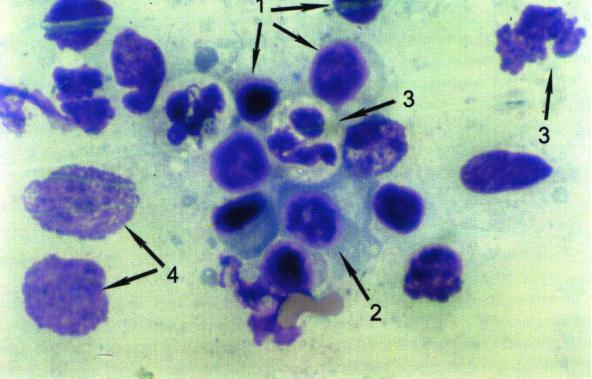
Рис. 22. Цитограмма содержимого лакун больного с гипертрофией небных миндалин (х630): 1 – лимфоциты; 2 – плазмоцит; 3 – нейтрофилы;
4 – деструктированные клетки плоского эпителия
43
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
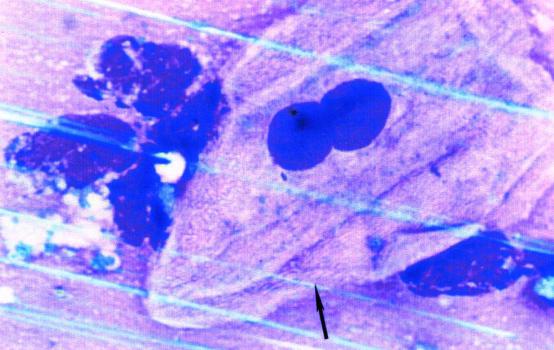
Рис. 23. Цитограмма содержимого лакун небных миндалин.
Эпителиальная двуядерная клетка (х630)
По мнению Быковой В.П. (1997), основной функцией лимфоэпители-
альных органов является генерация и диссеминация В-клеток памяти. По-
следние из гемоциркуляции поступают в места окончательной локализации
(слизистые оболочки), где впоследствии при наличии некоего вторичного сигнала дифференцируются в зрелые иммунопродуценты.
Лимфоидная ткань, благодаря перманентной рециркуляции лимфо-
цитов, носит характер обновляемой клеточной популяции. Лимфоциты по мере созревания вступают в лимфо- и гемоциркуляцию (Nowara E., Pabst R., 1986).
При этом отмечается избирательность миграции, получившая назва-
ние «хоуминга», который проявляется в том, что лимфоциты, рожденные в лимфоэпителиальных органах, заселяют «свои» регионы, то есть близлежа-
щие слизистые оболочки. Подобная избирательность связана с приобрете-
нием постмитотическими эффекторными лимфоцитами каких-то новых свойств, которые могут сообщить лимфоциту только местное микроокру-
жение (Быкова В.П., 1997).
44
Лимфоциты, рожденные в небных миндалинах, заселяют слизистые оболочки дыхательных путей (Быкова В.П., 1999).
Наличие в небных миндалинах патогенной флоры без морфологиче-
ских признаков воспаления может быть объяснено высокой активностью местной противоинфекционной защиты, осуществляющейся, прежде всего,
с помощью антител, относящихся практически ко всем классам иммуногло-
булинов, где основную защитную роль выполняют секреторные формы
IgA.
45
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
4. АПОПТОЗ И ВОСПАЛЕНИЕ
Известно, что смерть клетки может наступить либо через апоптоз,
либо через некроз (Paus R. et al., 1995).
Апоптоз, или программированная гибель клеток, есть процесс клеточной элиминации (рис. 24, 24а). У взрослых индивидуумов аппоптоз направлен на поддержание гомеостаза за счет удаления ненужных клеток, представляюших потенциальную опасность для организма (мутантные и аутореактивные клетки, клетки, инфицированные вирусами и др.) (Пев-
ницкнй Л.А., 1996).
Апоптоз запускается в ответ на:
1)воздействие специфических внешних стимулов, таких как фактор некроза опухоли, FAS, интерферон и др.;
2)необратимое повреждение клеточных структур, не сопровождающееся нарушением клеточной мембраны (радиация, химиотерапия, токсическое воздействие);
3)воздействие внутриклеточных индукторов апоптоза (старение
клетки);
4)отсутствие постоянного воздействия внешних антиапоптических стимулов (Казначеев К.С., 1999).
Некроз возникает в результате прямого воздействия патогенного фактора, нарушающего целостность мембраны клетки (рис. 25), что приводит к массивному выбросу индукторов воспаления и к миграции иммунных клеток к очагу поражения. В результате в зоне повреждения клетки развиваются септическое или асептическое воспаления. При этом происходят характерные изменения, как в ядре, так и в цитоплазме. Ядро сморщивается, наблюдается конденсация хроматина, затем он распадается на глыбки и растворяется. В цитоплазме происходят денатурация и коагуляция белков. Мембранные структуры распадаются. Нарушаются окислительно-восстано- вительные процессы и синтез АТФ в митохондриях, и вся клетка начинает страдать от нехватки энергии (Коршунов A.M., Преображенская И.С.,
1998).
В отличие от некроза апоптоз является физиологическим процессом клеточного «самоубийства», адаптивным механизмом, поддерживающим ди-
намическое равновесие между клеточной пролиферацией и элиминацией.
46
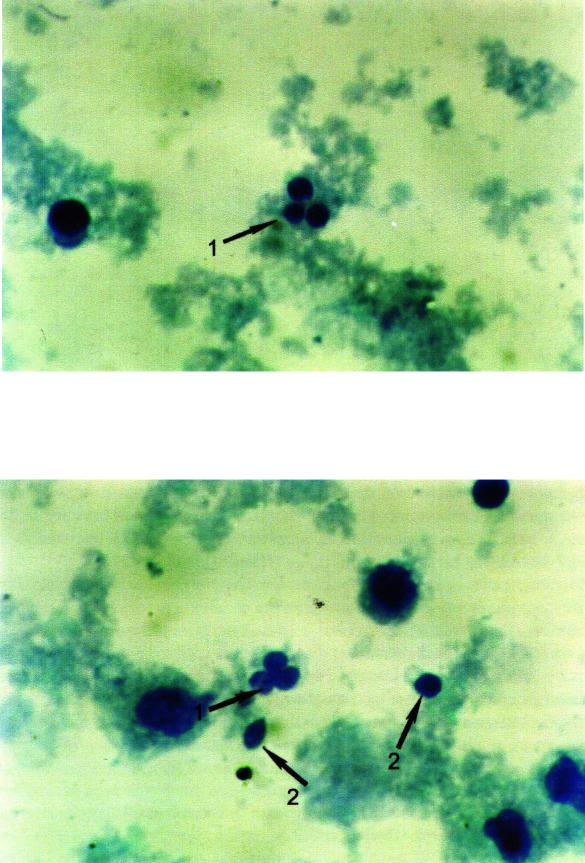
Рис. 24. Физиологическая (программированная)
гибель нейтрофила – апоптоз (х630)
Рис. 24 а. Физиологическая (программированная) гибель нейтрофила
(х630): 1– апоптоз; 2 – апоптические тельца
47
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Рис. 25. Патологическая гибель клеток (нейтрофилов) через некроз (х630)
В нормальных тканях при физиологических условиях апоптозу подвержено небольшое количество клеток в противоположность некротической гибели, захватывающей обычно обширные клеточные территории (Певниц-
кий Л.А., 1996).
Морфологически апоптоз характеризуется рядом признаков, отличающих его от некроза. Ранние проявления апоптоза состоят в утрате межклеточных контактов, конденсации цитоплазмы и хроматина (уменьшение объема клетки), который затем распадается на фрагменты. В конечной стадии апоптоза клетка разрушается с образованием мембранассоциированных апоптических тел, содержащих интактные цитоплазматические органеллы и фрагменты ядра. Лизосомальные фрагменты и цитокины при этом не поступают в окружающую среду, и это существенно ограничивает возможность развития воспалительной реакции при апоптозе. Разрушение клетки (фрагментация) происходит в течение нескольких минут, а весь процесс завершается за несколько часов. Апоптические тельца фагоцитируются и быстро разрушаются внутри фагоцитирующих клеток (Певницкий Л.А.,
1996).
48
В отличие от некроза фагоцитоз при апоптозе осуществляется не только соседними клетками мононуклеарно-фагоцитарной системы, но и эпителиальными, эндотелиальными и даже опухолевыми клетками
(Vermes I., Haanen С, 1994).
При некрозе фагоцитоз в основном происходит за счет «профессиональных» макрофагов, мигрирующих в очаг воспаления (Певницкий Л.А.,
1996).
Апоптоз вовлечен в механизм развития большого количества заболеваний у человека. Предполагается, что опухолевый рост является результатом дисбаланса между пролиферацией клеток и программированной кле-
точной смертью (Sarraf C.E., Bowen I.D., 1986).
При изучении апоптоза нейтрофилов выявлено, что в нормальных условиях (вне очагов воспаления) отмирание нейтрофилов происходит незаметно. Нейтрофилы, вступившие на путь апоптоза, теряют способность к стимулиндуцированной амебоидной активности, поглощению, хемотаксису, респираторному взрыву, секреторной дегрануляции. Усиление апоптоза нейтрофилов вызывают фактор некроза опухоли, перекись водорода, гепарин, протеолитические ферменты, гипертермия, фагоцитоз бактерий, УФ-облучение и др. Антиапоптозным эффектом обладают цитокины, стимулирующие миелопоэз, некоторые хемокины, лейкотриен В-4, фактор активации тромбоцитов, глюкокортикоидные гормоны, антиоксиданты и др. (Маянский А.Н., Маянский Н.А., 1999).
На состоянии внесосудистых нейтрофилов отражается их функциональная активность. Адгезия, трансэндотелиальная миграция и экстравазальная среда оказывают существенное влияние на процессы апоптоза нейтрофилов (Маянский А.Н., Маянский Н.А., 1999; Маянский Н.А., 2000). Это способствует рациональному использованию их эффекторного потенциала, продлевая период активной жизнедеятельности (в зоне воспаления) или усиливая апоптоз (если ситуация не выходит за рамки гомеостаза). И то и другое выглядит как адаптивная мера.
49
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
