
3 курс / Фармакология / Синтез_и_изучение_свойств_новых_материалов_с_противоопухолевой
.pdf31
ГЛАВА 2. НАНОФОРМЫ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
В последнее десятилетие двадцатого века произошёл «бум» исследований,
связанных изучением различных наноструктур. Это произошло, главным образом, в
результате значительного прогресса в разработке способов получения наноматериалов. К настоящему времени синтезированы новые производные ряда фуллеренов, наноалмазов, графена, углеродных нанотрубкок, альбумина и липосом
[44–51]. Идеальный наноноситель не должен оказывать вредного воздействия на нормальные клетки, но должен удовлетворять требованиям стабильности,
биосовместимости in vivo и способности высвобождать лекарственное средство в зависимости от внешних условий (pH, температура). В начале 2005 г. для клинического применения была одобрена альбуминовая форма противоопухолевого препарата паклитаксел. Паклитаксел загружается в наночастицы альбумина с использованием процесса эмульгирования под высоким давлением. Было показано,
что эта растворимая форма паклитаксела не только устраняет побочные эффекты
[52], но также обеспечивает некоторые дополнительные преимущества: улучшает эффективность доставки лекарственного средства из кровотока к опухоли и позволяет вводить более высокие дозы лекарственного средства [52].
В исследовании доставки ингибитора протеазы ВИЧ-1, антиретровирусного агента, ингибирующего цикл репликации ВИЧ-1 CGP 70726 [53] использовались рН-
чувствительные наночастицы, изготовленные из сополимера метакриловой кислоты и этилакрилата [54]. Наночастицы были синтезированы путём эмульгирования раствора сополимера и смеси CGP 70726 с бензиловым спиртом. Полученный наноматериал вводили лабораторным животным перорально и наблюдали эффективное высвобождение лекарственного средства, что было подтверждено анализом образцов плазмы.
Перспективным направлением в области создания таргетных препаратов является использование углеродных наноструктур. Например, наноматериалы на основе графена имеют большой потенциал применения в различных областях: в
биоимиджинге [55], при разработке биосенсоров [56], в противогрибковой [56] и
противовирусной терапии [59]. Графен обладает уникальной структурой, состоящей

32
из атомов углерода в состоянии sp2-гибридизации, образующих двумерные нанослои
[51]. Существует ряд подходов позволяющих получать наноматериалы на основе графена [52],[55–58].
Анализ литературы позволяет выявить ряд работ, посвящённых синтезу конъюгатов на основе GO с различными цитостатическими препаратами (Табл. 2.1) [58–70]. Представленные литературные данные позволяют выделить следующие преимущества создания конъюгатов на основе GO:
1) возможность применения различных подходов к синтезу конъюгатов
(ковалентная [65] и нековалентная [66] модификации);
2)возможность варьирования процента загрузки цитостатиков, а также возможность проведения одновременной загрузки двух и более цитостатиков, а также синтеза конъюгатов, содержащих цитостатические препараты и вектор для адресной доставки [68];
3)более высокая эффективность терапевтического действия и меньшая токсичность
[69,70].
Табл. 2.1. Конъюгаты на основе GO с различными цитостатическими препаратами.
Конъюгат |
Характеристики |
Ссылка |
|
|
|
|
|
Паклитаксел- |
Выживаемость клеток линии эндометриоидной |
|
|
GO-фолиевая |
|
||
аденокарциномы яичников (A2780) при введении |
[65] |
||
кислота (pGO- |
|||
pGO-FA-PTX менее 30 % |
|
||
FA-PTX) |
|
||
|
|
||
|
Выживаемость клеток линии аденокарциномы |
|
|
Цисплатин-GO |
яичника (SKOV3) составляла 10 % при |
|
|
|
концентрации 25 мг·л−1 |
|
|
|
Выживаемость клеток линий фиброза печени (LX2), |
[66] |
|
Карбоплатин- |
|
||
и SKOV3 при концентрациях конъюгата от 60 |
|
||
GO |
|
||
мг·л−1до 250 мг·л−1 была менее 20 % |
|
||
|
|
||
Хлорамбуцил- |
|
|
|
GOфолиевая |
Выживаемость клеток линии MCF-7 составляла |
[67] |
|
кислота |
28 % при концентрации CLB-FAGGO 500 мг·л−1 |
||
|
(CLB-FAGGO)
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
|
33 |
|
|
|
|
|
|
Доксорубицин- |
Значения IC50 для клеточных линий РС3 и A2780 |
|
|
GO |
[68] |
||
составили 0,84 мкМ и 1,55 мкМ, соответственно |
|||
(GO-DOX) |
|
||
|
|
||
|
Значения IC50 для клеточных линий фибробластов |
|
|
|
лёгкого (HEL299) и А549 составили 6,36 ± 1,20 и |
|
|
Гемцитабин-GO |
9,72 ± 0,37 мкМ, соответственно. |
|
|
Подкожная инъекция GEM-rGO мышам с |
[69] |
||
GEM-rGO |
|||
ксенотрансплантатами A549 приводила к |
|
||
|
|
||
|
ингибированию роста опухоли в два раза более |
|
|
|
эффективно, чем свободный гемцитабин |
|
|
Тамоксифен- |
Значение IC50 для клеточной линий MCF-7 |
[70] |
|
GO |
составило 108 мг·л−1 |
||
|
|||
|
|
|
Низкая гемосовместимость немодифицированных графенов с компонентами крови и токсичность усложняют применение данных наноструктур в медицине. В
работе [71] представлены результаты исследования влияния водных дисперсий GO
на показатели крови. Показано, что уровень общего билирубина у лабораторных крыс, получавших дисперсию GO (C = 500 мг·кг−1) повышался по сравнению с контролем, а уровень липопротеинов высокой плотности значительно снижался.
Однако у крыс, получавших дисперсии GO с C = 50 или 150 мг·кг−1 показатели уровня общего билирубина оставались в норме. В исследуемых образцах крови не было обнаружено существенных изменений других анализируемых показателей
(например, холестерин, креатинин и др.). При гистологическом изучении печени крыс, получавших дисперсию GO (C = 50 мг·кг−1) были выявлены её незначительные морфологические изменения, а после увеличения концентрации дисперсии GO (до
C = 500 мг·кг−1) у крыс обнаружено массивное очаговое скопление частиц в области капсулы печени. У крыс, получавших GO в дозе 150 мг·кг−1, наблюдался мультифокальный нефрит в почках. Авторы установили, что функционализация GO
проводит к увеличению гемосовместимости и снижению токсичности его водных дисперсий.
Авторы работы [72] показали возможность использования GO для адресной доставки лекарств на примере GO, функционализированного 1,3,5-триазином
(Схема 2.1). GO функционализировали триаминотриазином (ТАТ) с использованием

34
тионилхлорида для получения конъюгата 1.57. Стратегия синтеза, представленная на Схеме 1.22, включает стадию образования хлорангидридов и позволяет осуществлять контролируемую функционализацию графена с помощью различных молекул. GO, функционализированный TAT, был инкапсулирован с использованием альгината путём равномерного диспергирования конъюгата 1.57.
Схема 2.1
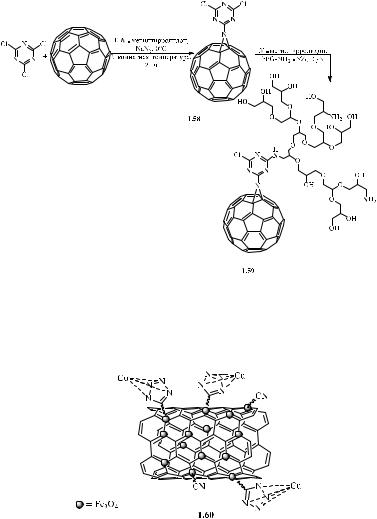
Стремясь уменьшить токсичность и увеличить эффективность противоопухолевого действия 2,4,6-тризамещённых 1,3,5-триазинов в работе [73]
авторы успешно осуществили функционализацию фуллерена С60 2,4,6-трихлор- 1,3,5-триазином (Схема 2.2) через стадию образования азафуллероида 1.58 и
последующего замещения хлора 1.59. При исследовании биологической активности
1.58, 1.59, и возможности применения данных веществ как флуоресцентных зондов с помощью конфокальной лазерной сканирующей микроскопии была показана перспективность применения данных веществ для визуализации опухолевых клеток
[73].
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
35
Схема 2.2
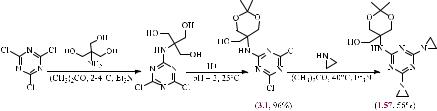
В работе [74] был описан способ получения конъюгата с использованием реакции 1,3-диполярного присоединения между CN-производными однослойных углеродных нанотрубок (УНТ) и тетразол-содержащими комплексами Cu(II) (Рис.
2.1).
Рис. 2.1. Конъюгат УНТ с тетразол-содержащими комплексами Cu(II).
Авторы данного исследования показали, что зона ингибирования роста бактерий E. coli и S. aureus при добавлении наноматериала (0,01 г) составила около
16 и 20 мм, что свидетельствует о его значительной антибактериальной эффективности.
36
Таким образом, из представленных в обзоре литературы данных можно заключить, что 2,4,6-тризамещённые 1,3,5-триазины проявляют различные виды биологической активности, включая противоопухолевую активность. Интересным методом формирования активных скаффолдов на основе 1,3,5-триазинов является введение гетероциклов (получение гибридных молекул), который позволяет также варьировать заместители и свойства конечных структур. Проблемы возникновения резистентности и пролонгированности действия полученных структур возможно решить конъюгацией 2,4,6-тризамещённых 1,3,5-триазинов с различными наноносителями. Стоит отметить, что в разработке противоопухолевых соединений введение в структуру 1,3,5-триазина тетразольного цикла и изучение наноконъюгатов 1,3,5-триазинов практически не применялось, поэтому получение вышеперечисленных структур можно считать крайне перспективным.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
37
ГЛАВА 3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
3.1. Синтез соединения 1.57
Рассматривая варианты модификации методики синтеза [5-[[4,6-
бис(азиридин-1-ил)-1,3,5-триазин-2-ил]-амино]-2,2-диметил-1,3-диоксан-5-ил]-
метанола 1.57 было проведено исследование возможности замещения атома хлора в ТХТ в реакции с трис(гидроксиметил)аминометаном и возможности циклизации полученного триола в диоксановый фрагмент.
Показано, что при охлаждении реакционной смеси в водно-ацетоновом растворе происходило образование 2-((4,6-дихлоро-1,3,5-триазин-2-ил)амино)-2-
(гидроксиметил)пропан-1,3-диола (3.1). Последующая стадия циклизации проходила в присутствии трифторметансульфокислоты, при добавлении которой выход целевого продукта составил 96 % (Схема 3.1). Замещение 2-го и 4-го атомов хлора на азиридин проводили в ацетоне в присутствии основания. Замещение третьего атома хлора в данных условиях было затруднено и реакционную смесь выдерживали сутки при 40 °C. Продукт очищали методом колоночной хроматографии (хлороформ : метанол = 9:1).
Схема 3.1
Данные масс-спектрометрии и спектроскопии ЯМР подтвердили состав и строение соединений 1.57 и 3.1. Сигналы протонов азиридиновых групп находятся в диапазоне 2,33–2,36 м. д., а сигналы 1,42–1,44 м. д. подтверждают наличие двух СН3-групп в диоксановом фрагменте. Строение соединений 1.57 и 3.1
дополнительно подтверждено методом РСА (Рис. 3.1 и 3.2). Геометрия триазинового
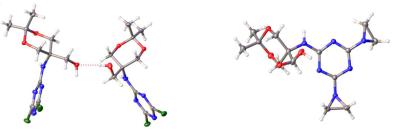
38
фрагмента соединений 1.57 и 3.1 близка к геометрии аналогичных соединений [75].
В кристаллической решётке пара молекул соединения 3.1, связываясь двумя межмолекулярными водородными связями между атомами H3 O1, образуя димер.
Фрагменты во 2,4,6-положениях соединений 1.57 и 3.1 развёрнуты относительно
1,3,5-триазинового цикла на угол от 60 до 90 градусов.
Рис. 3.1. Структура соединения 3.1 |
Рис. 3.2. Структура соединения 1.57 |
3.2.Синтез гибридного триазинилтетразола
3.2.1.Синтез исходных тетразолсодержащих производных
Тетразолильная группа, как уже было отмечено, является общепризнанным фармакофором, использующимся при конструировании соединений-лидеров с оптимальным фармакокинетическим профилем. Способность эндоциклических атомов азота тетразольного цикла образовывать водородные связи, участвующие в образовании устойчивых фермент-субстратных комплексов, является значимым фактором, обуславливающим метаболическую активность тетразолсодержащих субстратов. Помимо этого, следует также отметить, что тетразолы проявляют относительно низкую токсичность по сравнению с их линейными аналогами — азидами [76]. Так следующем этапе работы были синтезированы арилтетразолы,
которые использовались в качестве прекурсоров для синтеза гибридных триазинил-
тетразолов.
Наиболее популярные методы синтеза 5-замещённых тетразолов основаны на реакциях нитрилов с солями и другими производными азотистоводородной кислоты. Успешно используются в лабораторных и промышленных синтезах 5-
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

39
замещённых тетразолов из нитрилов традиционные методы с использованием различных азидов. Процесс 1,3-диполярного циклоприсоединения азида диметиламмония к нитрилу сопровождается синхронным образованием двух ковалентных связей: C–N и N–N, за счёт единовременного перекрывания молекулярных орбиталей атомов азота азидного диполя и атомов углерода и азота нитрильной группы, что обеспечивает формирование тетразолильного цикла [26,77].
Но стоит отметить, что в результате такого взаимодействия образуется непосредственно не сам NH-тетразол 3.2, а его диметиламмониевая соль, по этой причине для выделения конечного продукта 3.2 проводят подкисление раствором соляной кислоты до pH 1–2 (Схема 3.2).
Схема 3.2
Состав и структуру 5-фенил-NH-тетразола доказывали методами масс-
спектрометрии (HRESI+-MS), а также 1H, 13C{1H} ЯМР-спектроскопии.
Характерным сигналом, подтверждающим наличие тетразолильного цикла, является химический сдвиг атома углерода гетероцикла в диапазоне δ = 149,2–156,8 м. д.,
изменяющегося в зависимости от 5-R-заместителя. В случае соединения 3.2 атома углерода тетразола имеет химический сдвиг δ = 156,2 м. д.
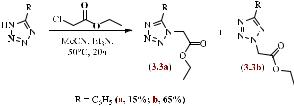
Для синтеза этиловых эфиров 5-фенил-тетразол-1-ил и 5-фенил-тетразол-2-
илуксусных кислот полученные ранее 5-фенил-NH-тетразол 3.2 алкилировали этиловым эфиром хлоруксусной кислоты в среде ацетонитрила в присутствии основания — триэтиламина. Реакция протекала в течение 20 ч при ~ 50 °C (Схема
3.3). В результате образовывалась смесь изомеров 3.3ab — тетразол-1-ил и тетразол- 2-илуксусных кислот. Полученные данные хорошо согласуются с литературными
[78–80]. Соединение 3.3b перекристаллизовывали из изопропилового спирта и использовали в дальнейшем для следующих стадий синтеза.
40
Схема 3.3
Состав и структура соединения 3.3b была доказана методами масс спектрометрии (HRESI+-MS), а также 1H, 13C{1H} ЯМР-спектроскопии.
Подтверждением структуры является наличие характеристичных сигналов,
соответствующих сложноэфирной группе. Например, сигнал атома углерода карбонильной группы (С=O) для этилового эфира 5-(4-гидроксифенил)-2Н-
тетразол-2-илуксусной кислоты 3.3b имеет значение 171,5 м. д. Также важным моментом является отличие структуры региоизомеров, которое наглядно отображается на спектрах ЯМР. Так, например, у соединений 3.3а и 3.3b ярко выражено различие химических сдвигов атомов углерода тетразолильного цикла,
если для N(1)-изомера δ = 153,2 м. д., то для N(2)-изомера δ = 162,6 м. д. Также отличия наблюдаются в 1H ЯМР спектрах: значение сигнала N(1)-CH2 соответствует
5,49 м. д., а N(2)-СH2 — 5,72 м. д.
Далее полученный эфир 3.3b подвергался гидролизу в водном растворе NaOH
в течение 3–5 ч с образованием тетразолилуксусной кислоты 3.4 (Схема 3.4).
Конечный продукт выделяли подкислением раствора разбавленной соляной кислотой до pH 2–3, получая белые кристаллы 3.4. Полученная таким образом тетразолилуксусная кислота представляла собой индивидуальное соединение,
которое было использовано для дальнейших синтезов без дополнительной очистки.
В подтверждение полноты гидролиза и селективности образования продукта были получены спектры 13C{1H} ЯМР, где полностью отсутствовали сигналы,
соответствующие эфирными группам (CH2CH3) δ = 3,49 м. д и 62,6 м. д, при этом появился соответствующий сигнал гидроксильной группы δ = 11,02 м. д.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
