
1savel_ev_v_s_red_80_lektsiy_po_khirurgii
.pdfХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ИШЕМИЧЕСКОИ БОЛЕЗНИ СЕРДЦА - ИСТОРИЯ И СОВРЕМЕННОСТЬ
Р.С. Акчурин
Смертность от сердечно-сосудистых заболеваний составляет основную часть в общей системе смертнос ти 8 мире. В нашей стране наблюдается прогрессив ный рост этого показателя. Актуальность проблемы эффективного лечения ишемической болезни сердца (ИБС) очень высока и является предметом изучения как хирургов, так и терапевтов. Хирургический метод лечения — так называемая прямая реваскуляризация миокарда — приобретает все большую популярность в качестве альтернативного медикаментозному. Крупные исследования показали, что метод предпочтителен при выборе способа лечения наиболее тяжелого континген та больных, а именно с критическим многососудистым поражением коронарного русла, вовлечением ствола левой коронарной артерии, снижением сократительной функции левого желудочка сердца. В этих случаях опе рация не только улучшает показатели выживаемости, но и качество жизни, физическую активность пациентов.
Исторические вехи
Эпоха хирургии ИБС берет начало с Alexis Carrel (1872—1944 гг.), который определил связь между воз никновением стенокардии и стенозами коронарных артерий. Первое мнение о том, что хирургическое вме шательство может улучшить коронарный кровоток при атеросклеротическом поражении коронарных артерий, высказал профессор физиологии Парижского универ ситета Ф. Франк (Francois Franck) в 1899 г. Он полагал, что резекция шейного симпатического сплетения при ведет к освобождению от стенокардии. Данная опе рация была описана и реализована однофамильцами R.O. White и J.B. White. Больные после операции не испытывали ощущений, характерных для выраженной ишемии, однако часто погибали от ишемической фиб рилляции желудочков и остановки сердца.
iСтечением времени осуществлялись попытки и мес-
•тной денервации сердца — резекция предаортального
t сплетения (Fauteux et al., 1946), которая так же не дала должного результата. Одним из главных недостатков всех вышеперечисленных процедур был чрезвычай но высокий риск хирургического вмешательства при отсутствии устранения морфологического субстрата
и реального увеличения миокардиального кровотока опосредованным путем.
В середине 1920-х годов участие хирургов в лечении стенокардии ограничивалось тиреоидэктомией(Boas et a l , 1926) с целью снижения нагрузки на миокард левого желудочка сердца.
Следующие операции ставили перед собой целью увеличение миокардиального кровотока за счет усиле ния коллатерального кровообращения между коронар ными и средостенными артериями (Beck et al., 1935). Идея данных операций заключалась в создании выра женных сращений между миокардом желудочков серд ца и средостением. С этой целью после удаления пери карда в полость средостения вводили материалы, обла дающие высокой воспалительной активностью (тальк, песок, асбестол, фенол, гипертонический раствор салицилата натрия и ивалоновую губку). При выполнении этих процедур увеличение миокардиального кровотока не было существенным. Также не были эффективными и попытки перемещения в грудную полость множествен ных аутотрансплантатов — большой и малой грудных мышц, желудка, печени, селезенки, медиастинального жира, большого сальника (на сосудистой ножке или как свободный трансплантат), легких, тонкого кишечника, с сопутствующей перикардэктомией или без нее. Все вышеперечисленные операции не приносили должного результата. Идея создания дополнительного коллате рального русла с помощью имплантации внутренней грудной артерии (ВГА) в миокард (операция Винберга, 1945) не имела успеха, хотя экспериментально было доказано, что при введении в ВГА контрастного вещест ва последнее заполняет коронарные артерии.
В 1957 г. С. Bailey описал эндартерэктомию из коронарной артерии. В том же году она была также использована и W. Longmire. Это были первые попытки прямого вмешательства на коронарном русле. Впервые подключично-коронарное шунтирование с использова нием внутренней грудной артерии в эксперименте было выполнено отечественным хирургом В.П Демиховым в 1953 г., а в 1964 г. В.И. Колесов впервые успешно выпол нил и внедрил в клиническую практику маммарокоронарный анастомоз. Понимание ценности внутренней грудной артерии в качестве кондуита пришло позже.
41
Сердечно-сосудистая хирургия
В.И. Колесов, работая в 1960-х годах в Институте им. И.П. Павлова в Ленинграде, описал группу боль ных, у которых ВГА была использована для коронарной реваскуляризации без ИК. Frank Spencer провел интен сивную серию экспериментов с использованием ВГА для восстановления коронарного кровообращения у собак. После завершения экспериментов на животных и микроскопического изучения материала в 1965 г. George Green внедрил эту технику в клиническую прак тику. Floyd Loop с сотрудниками из клиники Кливленда использовал ВГА в операциях на коронарных артериях у большой группы больных и опубликовал концепту альную работу о значительном благоприятном влиянии маммарного шунтирования передней нисходящей арте рии (ПНА) на выживаемость больных.
Michael De Bakey и Edward Garrett в 1964 г. после неудачной эндартерэктомии из передней нисходящей артерии использовали аортокоронарный венозный шунт. Пациент выжил, и при контрольном обследовании через 8 лет шунт оставался проходимым. Этот эпизод считается первым успешным случаем клинического применения аортокоронарного шунтирования (АКШ). Параллельно с В.И. Колесовым одно из первых КШ с использованием техники анастомоза конец-в-конец без применения искусственного кровообращения было выполнено David Sabiston 4 апреля 1962 г. К сожале нию, в раннем послеоперационном периоде развилось фатальное осложнение. В 1967 г. R. Favoloro предло жил новое направление коронарной хирургии — опе рацию аутовенозного аортокоронарного шунтирова ния. Именно операция аутовенозного АКШ длительное время была основным методом хирургического лечения И6С. Так, по данным A.S. Geha и А.Е. Вайе, в 1974 г. не более 6% хирургов использовали ВГА для коронарного шунтирования, а спустя 5 лет их число не превышало 13%. Обусловлено это было тем, что ранние результаты прямой реваскуляризации миокарда с использованием аутовенозного материала были удовлетворительными, а технически аутовенозное шунтирование проще аутоартериального. Между тем с накоплением опыта хирур гического лечения ИБС выяснилось, что отдаленные результаты аутовенозного шунтирования далеки от идеальных. До 20% аутовенозных шунтов окклюзируются в течение 1 года после операции, к 10 годам про ходимыми остаются около 50% шунтов, причем более чем в половине из них отмечаются значимые стенозы. Это привело к появлению большой группы пациентов с рецидивом стенокардии вследствие окклюзии аутове нозных шунтов, требующей повторного хирургического лечения ИБС. В то же время состоятельность ВГА-шун- тов через 10 лет после операции в среднем составляет
93%. Неоспоримые преимущества использования ВГА перед аутовенозным материалом получены по многим показателям, включая продолжительность жизни паци ентов после операции, частоту позднего инфаркта мио карда, частоту повторных операций и госпитализаций, связанных с рецидивом стенокардии.
Выбор трансплантата для КШ исключительно важен, поскольку от него во многом зависит ближайшая и отдаленная проходимость шунтов и, соответственно, сердечная заболеваемость и смертность. В течение пос ледних 15 лет стандартным трансплантатом является внутренняя грудная артерия in situ и большая подкож ная вена (БПВ). В начале 1980-х годов было доказано, что венозные шунты подвержены гиперплазии инти мы и атеросклеротическим изменениям. В 1985 г. Н. Earner и соавт., на основании 12-летнего наблюдения 1000 пациентов, пришли к выводу о преимуществе маммарных шунтов. Через 1 год после вмешательства сохра нялась проходимость 95% маммарных шунтов и 93,4% венозных. Через 5 и 10 лет проходимость маммарных шунтов составила 88 и 83%, а венозных — только 74 и 41% соответственно. Впервые результаты использования обеих маммарных артерий для коронарной реваскуля ризации были доложены Н. Earner в 1974 г. Несмотря на очевидные преимущества маммарных шунтов перед венозными в непосредственной и отдаленной прохо димости, первоначальный энтузиазм по поводу билате рального маммаро-коронарного шунтирования (БиМКШ) несколько угас на фоне большого числа послеопераци онных осложнений, включающих послеоперационное кровотечение, медиастинит, продленную искусственную вентиляцию легких. Тем не менее в нескольких последу ющих крупных исследованиях была продемонстрирована эффективность и безопасность БиМКШ в периоперационном периоде и в отдаленные сроки. Единственной нерешенной проблемой БиМКШ на сегодняшний день является повышенный риск возникновения медиастинитов. Согласно статистическим данным, эта опасность чаще реализуется у больных диабетом, тучных пациентов и после длительной ИВЛ. Сравнивая отдаленные клини ческие результаты БиМКШ и одностороннего МКШ можно отметить следующие преимущества первого: меньший риск рецидива стенокардии, повторного ИМ и необходи мости в повторной реваскуляризации, а также тенден цию к увеличению выживаемости.
A. Carpentier и соавт. в 1973 г. впервые пред ложили использовать лучевую артерию для коро нарного шунтирования. Однако эта технология не нашла широкой поддержки, поскольку появились сообщения о 30% частоте окклюзии таких шунтов. Интерес к ее применению возобновился в 1989 г.,
Хирургическое печение ишемической болезни сердца — история и сопременность
когда были обнаружены проходимые радиальные шунты у пациентов, прооперированных 13—18 лет назад. Лучевая артерия — это артерия мышечного типа, с толстой стенкой, средний внутренний диаметр которой равен 2,5 мм, а длина — около 20 см. Она склонна спазмироваться при механической стимуля ции, для профилактики этого осложнения во время операции обычно используют антагонисты кальция. Представляется, что максимально щадящие манипу ляции и выделение лучевой артерии в комплексе с окружающими ее венами и жировой клетчаткой могут привести к улучшению результатов. В исследование R. Brodman и соавт. включены 175 пациентов, которым были наложены 229 радиальных шунтов (в том числе в 54 случаях билатеральные радиальные шунты). 12-недельная проходимость шунтов составила 95%. По количеству периоперационных ИМ и летальности результаты не отличались от стандартного КШ. Не отмечено серьезных осложнений со стороны верх ней конечности: ишемии, гематом либо инфицирова ния раны. В 2,6% случаев наблюдалась преходящая парестезия предплечья длительностью от 1 дня до 4 недель. С. Асаг и соавт. недавно опубликовали результаты 5-летнего наблюдения 100 пациентов, у которых в процессе КШ была использована луче вая артерия. Проходимость шунтов составила 84%. В сопоставимой группе пациентов 5-летняя проходи мость маммарных шунтов равна 90%. Таким образом, представленные выше наблюдения позволяют прийти к выводу, что лучевая артерия является безопасным и надежным кондуитом для коронарной реваскуляризации.
Начиная с 1987 г. появилось значительное коли чество сообщений об успешном применении правой желудочно-сальниковой артерии (ПЖСА) в коронар ной хирургии. По данным исследований,атеросклеротическое поражение этой артерии встречается редко, ее диаметр в большинстве случаев достаточен для коронарной хирургии, а длина возможного трансплан тата на ножке позволяет шунтировать практически все ветви коронарных артерий. Доступ обеспечива ется расширением разреза срединной стернотомии до пупка и выделением артерии, начиная от большой кривизны желудка. Длина a. gactroepiploica dextra. на ножке, начиная от устья гастродуоденальной артерии, достигает 25 см и больше. С увеличением клинического опыта было доказано, что использова ние ПЖСА не увеличивает риск оперативного вмеша тельства и ранние результаты ее применения много обещающие (проходимость шунтов в ранние сроки составляет 90%). Нижняя эпигастральная артерия
(a. epigactrica inferior) в виде свободного шунта используется для КШ с 1990 г. Для выделения этой артерии применяется парамедианный доступ с пос ледующей ретракцией прямой мышцы живота. Может быть получен свободный шунт длиной до 16 см, начи ная от устья подвздошной артерии. Проходимость шунтов в раннем послеоперационном периоде соста вила 98%. Однако опыт использования данного транс плантата невелик, а отдаленные результаты отсутс твуют. В связи с этим данный трансплантат считается «резервным», а к его использованию целесообразно прибегать в случае невозможности применения выше указанных аутоартерий.
В коронарной хирургии применялись также гомо логичные венозные шунты из v. saphena, законсерви рованные методом глубокой заморозки, и гомологич ные шунты из пупочной вены, обработанные глутаральдегидом. Поскольку проходимость таких шунтов в течение 3—13 месяцев не превышает 50%, их исполь зование не оправдано, если возможно применение других трансплантатов. Аналогичные показатели про ходимости в течение года (около 50%) получены и при использовании бычьей ВГА. Существуют синтетические шунты для КШ: дакроновые и политетрафторэтиленовые. Имеется несколько сообщений об успешном применении дакроновых шунтов. Во всех описанных случаях проксимальный анастомоз накладывался на восходящую аорту, а дистальный — на проксимальную часть шунтируемой артерии. Проходимость политетрафторэтиленовых шунтов не превышает 60% в тече ние 1 года.
Таким образом, к 90-м годам XX столетия сложилось новое направление в оперативном лечении ИБС — аутоартериальное коронарное шунтирование.
В концепцию множественного аутоартериального коронарного шунтирования в настоящий момент вклю чено использование внутренних грудных, лучевой, правой желудочно-сальниковой артерий и комбина ций из них при многососудистом поражении коронар ного русла. Изучение особенностей и результатов этих операций в настоящее время определяет перспективы развития коронарной хирургии. Именно рациональная тактика применения указанных трансплантатов опре деляет эффективность хирургического лечения ИБС. Микрохирургические методы позволяют предотвра тить интраоперационные ошибки. Атравматичность выделения аутоартериальных трансплантатов и при менение антиспастической терапии предотвращают развитие спазма в интра- и послеоперационном пери одах, что позволяет активно использовать аутоартерий в качестве коронарных шунтов.
43
Сердечно-ахудистс - • ..-..-:., я
Современное состояние проблемы
Показания к проведению коронарного шунтиро вания основываются на тяжести симптомов и степени поражения коронарного русла, функции левого желу дочка. Наличие гемодинамически значимого пораже ния (более 50%) основного ствола левой коронарной артерии (ЛКА), или эквивалента стволового поражения, проксимального поражения всех трех сосудов (более 70%) или других поражений с вовлечением проксималь ного отдела ПНА требует решения вопроса об операции. Статистически доказано, что при указанных поражени ях больные даже с маловыраженной клиникой имеют значительно лучшие перспективы при хирургическом лечении по сравнению с медикаментозным лечени ем. У пациентов с тяжелой стабильной стенокардией, рефрактерной к медикаментозной терапии, операция показана, кроме того, при одноили двухсосудистом поражении без значимого проксимального стеноза ПНА при наличии значительного объема жизнеспособного миокарда, положительных нагрузочных тестов и сни женной сократительной функции миокарда.
Целый ряд заболеваний, затрагивающих жизнен но важные функции, в терминальных стадиях могут обусловить противопоказания к операции. С другой стороны, сообщения последних лет об успешном хирур гическом лечении ИБС у пациентов, например с почеч ной недостаточностью, онкологическими процессами, тяжелым сахарным диабетом, заставляют в каждом индивидуальном случае тщательно взвешивать воз можный риск и эффективность операций. Преклонный возраст сам по себе не является противопоказанием к операции. Идеальным кандидатом для проведения операции прямой реваскуляризации является больной моложе 70 лет без сопутствующих заболеваний с с р а женными симптомами ишемичегкой болезни сердца, существенно ограничивающими его жизненную актив ность и не поддающимися адекватному контролю с помощью медикаментозной терапии, желающий вести
ниями, различной комбинацией атеросклеротических поражений. При этом на результаты лечения таких больных оказывают влияние не столько отработанная до стандарта рациональная хирургическая тактика и техника реваскуляризации миокарда, сколько методика защиты миокарда, наличие или отсутствие прекондиционирования миокарда, искусственное и вспомога тельное кровообращение, обоюдоострая по эффекту антикоагулянтная терапия и многие другие факторы. Вот почему попытки избежать всех побочных ослож нений привели к развитию в последние годы методик коронарного шунтирования без использования искус ственного кровообращения. При этом используются как обычная срединная стернотомия, так и различные мини-доступы. В настоящее время можно выделить следующие основные разновидности операции прямой реваскуляризации миокарда.
1. Стандартная операция коронарного шунти рования выполняется из срединной стернотомии с использованием ИК, на остановленном сердце. К пре имуществам панной методики необходимо отнести воз можность прецизионного выполнения анастомозов, осо бенно при использовании значительного оптического увеличения, и возможность полной реваскуляризации всех пораженных коронарных артерий. Как правило, данная «классическая» методика наиоолее комфортна для хирурга и позволяет ему быть уверенным в хорошем отдаленном результате. К отрицательным моментам относится негативное воздействие кардиоплегии на миокард, что особенно важно у пациентов с исходно сниженной сократительной спосооностью миокарда, а также неблагоприятное воздействие искусственного кровообращения как такового на функцию печени, почек, легких, ЦНС, что актуально в первую очередь у больных пожилого и старческою возраста.
Утяжеление контингента больных и расширение показаний к реваскуляризации миокарда, осооенно у пациентов с сочетанной патологией, сердечной подо статочностью, распространенным атеросклерозом, привело к тому, что, несмотря на улучшение техники
'• активный образ жизни, имеющий выраженные операции и анестезиологического пособии, частот.)
стенозы к нескольких коронарных арифиях и объек тивны" признаки ишемии миокарда. У таких больных можио ожидать значительного улучшения состояния по'-я" проведения операции.
Разработка и совершенствование различим/ мето дов искусственною кромюоращении '.'Л) и щип,1 миокард* обусловили динамично»' и -(ффемивное Ря 1 витие хирургtt-ifctKuio лечения ИМ'.. Одн.н-о ни успехи немедленно привлекли мю,м;« многочисленную кате горию ( ьны/ < (ижелыми сопутствующими )аболева-
послеоперационных осложнении, недущими из кото рых являются сердечная недоспи очногть, легочная недостаточность, нарушении менового кроиообрлцеНИИ, патология почек, коа., чньинн и кроьшечения, в последние годы остается на стабильном урони»;, i.e. само искусственное кровообращение постепенно пре вращается п фактор, ифмоэящий рлтви)ие коронарной хирургии.
?. Попытки и iбенпт. iHMituiHbu < ИК f><по*мемий приведи к (м лини*! и пш медник юды методики OPIAt
Хирургическое лечение ишемичесной болезни сердца — история и современность
Щ (off-pump coronary artery bypass) — коронарного шунтирования без использования искусственного кровообращения.
Для адекватного выполнения анастомоза шунта с коронарной артерией необходима иммобилизация участка миокарда в месте анастомоза. Это стало воз можным на работающем сердце лишь в последние 5—8 лет, когда были разработаны различные системы для иммобилизации миокарда в зоне выполнения анастомо за, а также способы ротации бьющегося сердца.
Операция ОРСАВ первоначально предполагалась к применению у пациентов с низкой фракцией сердечного выброса, выраженной патологией легких, почек, а также старше 75—80 лет, т.е. в случаях, когда опасность ослож нений, связанных с искусственным кровообращением, была наиболее высокой. Между тем по мере накопления клинического опыта расширялись показания к выполне нию такого вмешательства, вплоть до того, что некоторые хирурги в своей деятельности практически отказались от операций с остановкой сердца.
Операция ОРСАВ проводится из стандартной сре динной стернотомии. После подготовки аутовенозных и выделения аутоартериальных трансплантатов на ранорасширитель устанавливают различные системы иммобилизации миокарда (в настоящее время исполь зуются зарубежные системы типа «Octopus» или оте чественная — «Космея», которые за счет создаваемого разрежения как бы вывешивают миокард, делая его неподвижным, либо системы, иммобилизующие мио кард за счет прижатия его вилкообразным держате лем различной конструкции). Позиционируют сердце таким образом, чтобы стала доступной артерия, кото рую предполагается шунтировать, после чего иммобилизируют миокард в зоне предстоящего анастомоза. Проксимальнее и дистальнее анастомоза коронарную артерию перекрывают турникетами. На всех этих этапах тщательно следят за эффективностью гемодинамики.
На протяжении всей операции важна согласован ность действий хирурга и анестезиолога для обеспече ния стабильной гемодинамики и предотвращения ише мии миокарда. Целесообразно сохранение нормального или повышенного коронарного перфузионного дав ления, что особенно на этапах ротации сердца может потребовать введения вазопрессора (мезатон) и кон троля частоты сердечных сокращений (i-блокаторами. Заслуженное признание получила методика сочетанной общей и верхней грудной эпидуральной анестезии, поз воляющая более эффективно избегать эпизодов ише мии миокарда, блокировать развитие стрессовой реак ции организма на операционную травму и обеспечивать качественное послеоперационное обезболивание.
Особого внимания заслуживает вопрос монито ринга признаков ишемии миокарда. Информативность ЭКГ при дислокации сердца снижается. Клиническое значение имеют: визуальное наблюдение амплитуды сердечных сокращений, возникновение желудочковых нарушений ритма, чреспищеводная эхокардиография, контроль давления заклинивания легочной артерии. На первый план выходит создание таких гемодинамических условий, в которых возникновение ишемии миокарда маловероятно: сохранение синусового ритма, умеренной брадикардии, инфузия вазопрессора, пос ледовательность шунтирования коронарных артерий, в отдельных случаях — использование временных интракоронарных шунтов, плавная дислокация сердца и достаточная продолжительность промежутков между пережатиями коронарных артерий для восстановления оптимальной функции сердца.
После стабилизации миокарда вскрывают артерию и накладывают анастомоз. Последовательно шунтируют все пораженные артерии, накладывают проксимальные анастомозы шунтов с аортой.
Несмотря на, казалось бы, очевидные достоинства данной методики, судить о ее преимуществах в раз личных группах пациентов можно будет только после проведения длительных многоцентровых рандомизи рованных исследований. Вместе с тем первые резуль таты достаточно обнадеживающие. Методика позво ляет выполнение множественного (до 5 коронарных артерий) шунтирования, в том числе с использованием всех аутоартериальных трансплантатов. Обнаружено несколько меньшее повреждение клеток миокарда, чем при стандартной операции с ИК, снижается потреб ность в препаратах крови, уменьшается длительность пребывания в палате интенсивной терапии, общая про должительность и стоимость лечения. Противоречивы данные о положительном влиянии операции ОРСАВ на число почечных и дыхательных осложнений, а также на количество послеоперационных инсультов и общую летальность.
3. Минимально-инвазивное коронарное шунти рование (МИКШ) выполняется, как правило, из лево сторонней переднебоковой торакотомии, без исполь зования ИК, на работающем сердце. Необходимо отме тить, что показания, техника и особенности данного вмешательства разработаны отечественными учеными В.П. Демиховым и В.И. Колесовым в 1953 и 1964 гг., соответственно, и незаслуженно забыты на долгое время. Торакотомия длиной около 10 см выполняется в четвертом, реже в пятом или третьем межреберьях. Выделяется левая ВГА под прямым контролем зрения или с помощью торакоскопической техники. К преимущест-
45
Сердечно-сосудистая хирургия
вам методики можно отнести отсутствие негативных последствий ИК, малоинвазивный доступ, сокращение восстановительного периода. Недостатками методи ки служат невозможность проведения множественной реваскуляризации и известные сомнения в качестве анастомоза. Настораживает появление сообщений о статистически более значимой частоте стенозов ВГАкоронарного анастомоза и инфарктов миокарда при проведении МИКШ. Парадоксально, но, на наш взгляд, малоинвазивность вмешательства можно отнести как к преимуществам методики с точки зрения косметичности, так и к недостаткам, с точки зрения безопас ности пациента в случае осложнений в ходе операции. МИКШ и ангиопластика коронарных артерий («гибрид ная реваскуляризация») выполняется, как правило, при 2-сосудистом поражении коронарного русла. Через 1—7 дней после МИКШ проводится ангиопластика вто рой пораженной артерии, описано и обратное сочета ние. Методика объединяет преимущества и недостатки составляющих вмешательств. Отдаленные результаты еще не изучены.
4. Коронарное шунтирование «оконным» досту
пом (в англоязычной литературе получил название «port-access») проводится через несколько небольших разрезов под эндоскопическим контролем. Оно выпол няется в условиях искусственного кровообращения (канюлируются бедренные сосуды) и кардиоплегии. Для доставки кардиоплегических растворов, окклюзии аорты и декомпрессии левого желудочка используется система катетеров. К положительным моментам данной методики можно отнести возможность полной реваску ляризации, выполнение анастомозов на неподвижном сердце, отказ от выполнения срединной стернотомии, уменьшение травматичности вмешательства и сокра щение восстановительного периода. Недостатки мето дики — необходимость в периферической канюляции через дополнительные разрезы на бедре с соответству ющими осложнениями, удлинение времени операции, ИК и ишемии миокарда по сравнению с другими вариан тами коронарного шунтирования и высокая стоимость процедуры. Требуется дальнейшее изучение безопас ности и эффективности данной методики и оценка отдаленных результатов.
Выбор метода хирургического вмешательства
Понятие адекватной реваскуляризации далеко не полностью определяется количеством шунтов и дистальных анастомозов. Целый ряд факторов влияет на
результаты операций. Среди них важнейший — характер поражения коронарных артерий, включающий распро страненность процесса, диаметр сосудов, подлежащих шунтированию, степень их стенозирования и наличие состоятельного дистального русла, индивидуальные особенности коронарного кровоснабжения, сложив шиеся в результате атеросклеротического поражения, а также свойства используемых сосудистых трансплан татов. В настоящее время выбор сосудов для шунти рования и ориентировочная локализация анастомозов в достаточной мере стандартизованы. Для ПНА опти мальным считается использование левой ВГА на ножке, типичное место анастомоза на уровне середины ПНА, дистальнее отхождения диагональных ветвей. В этом месте артерия, как правило, проходит субэпикардиально и не скрыта жировой тканью и мышечными пере мычками. Часто подлежат шунтированию диагональные ветви. Как показали наши исследования, для указанно го бассейна и аутовенозные, и аутоартериальные транс плантаты демонстрируют хорошие результаты проходи мости, по крайней мере через год после вмешательства. Для правой коронарной артерии — лучшее место для анастомоза — несколько проксимальнее «креста» — области деления артерии на заднюю межжелудочковую и боковые ветви (ЗМЖВ). В случае поражения артерии в этой зоне обычно ограничиваются шунтированием ЗМЖВ в средней трети или, в редких случаях, при доминировании правой коронарной артерии, когда пос ледняя отдает мощную заднебоковую ветвь к левому желудочку, выполняют шунтирование обеих терминаль ных ветвей или эндартерэктомию из области «креста». По нашим данным, аутовенозные и аутоартериальные шунты к проксимальным отделам имеют хорошую про ходимость через год после операции. Состоятельность шунтов к дистальным отделам ПКА, а именно к задней межжелудочковой ветви, хуже для аутовенозных (75%) и аутоартериальных (85%) шунтов. При этом различия в годичной проходимости между различными транс плантатами недостоверны. В отношении огибающей артерии (ОА) и ее ветвей мнение опытных хирургов не всегда совпадает. Учитывая сообщения о худшей, по сравнению с другими артериями, проходимости шунтов к огибающей артерии (61—67%, по данным Crosby и соавт., 1981), часть авторов рекомендует шунтировать только одну крупную ветвь тупого края и терминаль ную ветвь ОА, считая, что шунты к мелким ветвям ОА увеличивают риск операции и не улучшают отдаленные результаты. Другая часть призывает к восстановлению всех пораженных сосудов. В отношении выбора транс плантата для бассейна ОА также возможен различный подход, поскольку существуют сообщения о неудовлет-
46
Хирургическое лечение ишснической болезни сердца — история и современность
верительных результатах реваскуляризации бассейнов ОА при некоторых вариантах аутоартериального шун тирования, включая множественное секвенциальное шунтирование или проведение ножки правой ВГА через поперечный синус перикарда. В качестве возможных причин неудовлетворительных результатов наиболее часто указываются неблагоприятные угловые смещения трансплантатов при секвенциальном шунтировании и малый диаметр реципиентных коронарных артерий. В связи с этим, логичным представляется предло жение использовать в данной позиции аутовенозные шунты, чтобы сохранить ауто-артериальный пласти ческий материал для возможных повторных операций по поводу рецидива стенокардии. Тем не менее в наших наблюдениях реваскуляризацию коронарных артерий заднедиафрагмальной зоны мы выполняли трансплантантами правой желудочно-сальниковой артерии на ножке и спожносоставными Y-образными конструкциями из обеих внутренних грудных артерий или с использованием лучевой артерии. Проведенное исследование показало преимущество указанных вариантов аутоартериального шунтирования задне диафрагмальной области миокарда по сравнению с аутовенозным. Так, проходимость дистальных анас томозов к ОА через год после операции составила для аутовенозных шунтов 74%, для аутоартериальных трансплантатов 92%.
Применение операционных микроскопов, микрохи рургической техники, использование ВГА на ножке и свободных трансплантатов из ВГА в качестве операций выбора, а также правой желудочно-сальниковой арте рии и аутовенозных шунтов для выполнения полной реваскуляризации миокарда позволяют решить практи чески все технические вопросы и перейти в настоящее время к функционально выгодной аутоартериальной реваскуляризации миокарда. Необходимо отметить, что левая внутренняя грудная артерия по-прежнему остает ся «золотым стандартом» хирургического лечения ИБС. Правая внутренняя грудная, лучевая и правая желудоч- но-сальниковая артерии также зарекомендовали себя надежными трансплантатами для прямой реваскуля ризации миокарда. Однако повседневное их исполь зование несколько ограничено такими факторами, как наличие сахарного диабета, ожирения, предполагаемо го продленного ИВЛ (для правой ВГА), язвенной болез ни желудка, предшествующих операций на верхнем этаже брюшной полости (для ПЖСА), наличие призна ков атеросклероза или положительной пробы Аллена (для лучевой артерии). Немалую роль здесь играет и вынужденное удлинение оперативного вмешательства с применением нескольких аутоартерий. Таким образом,
выбор следующих аутоартериальных трансплантатов после ЛВГА для множественного аутоартериального коронарного шунтирования целесообразно определять с учетом противопоказаний к их использованию в каж дом конкретном случае.
Результаты
При оценке результатов операции коронарного шун тирования следует осуществлять дифференцирован ный подход в зависимости от факторов, определяющих риск оперативного вмешательства в целом, а также вида операции. Следует сказать, что при выполнении оперативного вмешательства на коронарных артериях не следует отдавать предпочтение конкретным мето дикам, а учитывать общепринятые в мировой практике показания к тому или иному виду операции.
Клиническая характеристика оперированных паци ентов определяет риск оперативного вмешательства
ипослеоперационный прогноз больных. По данным нашего отделения, доля пациентов со стенокардией III
иIV функционального класса (по Канадской класси фикации) составляет до 95% от всех оперированных. Для наиболее оптимальной оценки результатов лече ния следует выделить среди оперированных пациентов группу с острым коронарным синдромом, куда включе ны больные с впервые выявленной и прогрессирующей стенокардией напряжения и покоя, динамикой ST-cer- мента в межприступный период, а также те, которым не удалось стабилизировать состояние с применением массивной антиангинальной терапии. В эту же группу отнесены пациенты с очаговым поражением миокарда, прооперированные на сроке до 2 месяцев после инфар кта миокарда.
Среди общей группы также следует отметить боль ных с сердечной недостаточностью, мультифокальным атеросклерозом, сахарным диабетом. По нашим данным, примерно в 20—25% случаев сахарный диабет сочета ется с мультифокальным атеросклерозом, что зачастую требует проведения сочетанного одноэтапного вмеша тельства на коронарных артериях и периферических сосудах (брахиоцефальные артерии и артерии ниж них конечностей) либо операции в несколько этапов. Среди сопутствующих заболеваний необходимо выде лить хронические обструктивные заболевания легких, артериальную гипертензию, хроническую почечную недостаточность. Таким образом, наличие в той или иной степени выраженных сопутствующих заболева ний определяет особенности предоперационной под готовки пациента, а также выбор тактики оперативного лечения.
47
Сердечно-сосудистая хирургия
При оценке техники операции коронарного шун тирования следует отметить, что вне зависимости от типа операции необходимо придерживаться принципа «полной» реваскуляризации. В этом отношении в миро вой практике накоплен огромный хирургический опыт, определяющий показания к шунтированию артерий в зависимости от диаметра, характера атеросклеротического поражения, а также показания к проведению эндартерэктомии из коронарных артерий.
Особое внимание следует уделять медикаментоз ной терапии пациентов с одномоментной реконструк цией периферических артерий, коронарной эндартерэктомией, а также протезированием или пластикой клапанов в сочетании с коронарным шунтированием. Определяющим моментом ведения таких пациентов в раннем послеоперационном периоде является назна чение терапии гепарином с последующим переходом на непрямые антикоагулянты.
По данным нашего отдела, общая послеопераци онная летальность составляет около 0,9%, в том числе летальность среди срочных операций — 6,5%, сочетанных операций — 2,4%. Уровень летальности при этом прежде всего определяется тяжестью клинического состояния пациентов, наличием сердечной недостаточ ности, тяжелых сопутствующих заболеваний.
Таким образом, результаты оперативного вмеша тельства на коронарных артериях зависят от многих факторов, среди которых наиболее значимыми являют ся: адекватный выбор тактики хирургического вмеша тельства с учетом всех факторов риска интра- и после операционного прогноза, выверенная тактика медика ментозной терапии в ближайшем послеоперационном периоде в зависимости от характера проведенной опе рации, слаженной работы всех участников операции и послеоперационного ведения больного. Следует иметь в виду, что с одной стороны качество проведенного вмешательства зависит от прецизионности техники хирурга, с другой — сама техника операции постоян но совершенствуется. В этом отношении важно быть
в курсе современного мирового опыта, как в области хирургии, так и анестезиологии и перфузиологии.
Литература
1.Демихов Д. П. Хирургическое лечение недостаточности коронарного кровообращения / Труды Всесоюзной сессии АМН совместно с Томским медицинским институтом. 1953, с. 170—177.
2.Колесов В.И. Прямые операции на венечных артериях сердца. Симпозиум по хирургическому лечению коронарной болезни. М., 1962, с. 52—53.
3.Beck C.S., Leighninger D.S. Operations for coronary artery disease. JAMA, 1954, v. 156, 1226 p.
4.Benetti £., Naselli G., Wood M., Ceffner L. Direct myocardial revascularization without extracorporeal circulation: experience in 700 patients. Chest. 1991, v. 100, p. 312—6.
5.Buffalo E., De Andrade C, Branco J. et al. Coronary artery bypassgrafting without cardiopulmonary bypass. Ann. Thorac. Surg., 1996, v. 61, p. 63—66.
6.Calaflore A., Di Giammarco G., Teodori G. et al. Left anterior descending coronary artery bypass grafting via a left anterior small thoracotomy without cardiopulmonary bypass. Ann. Thorac. Surg., 1996, v. 61, p. 1659—1665.
7.Carpentier A., Guermonprez J.L, Deloche A., Frechette C, DuBost С The aorta-to-coronary radial bypass graft: A technique avoiding pathological changes ingrafts. Ann. Thorac. Surg., 1973, v. 16, p. 11—121.
8.Favoloro R.G. Saphenous vein autograft replacement of severe segmental coronary artery occlusion. Operative technique. Ann. Thorac. Surg. 196—5, p. 334—9.
9.Schwartz D., Ribakove G., Gross! E. Single and multivessel port-access coronary artery grafting with cardioplegic arrest: technique and reproducibility. J. Thorac. Cardiovasc. Surg.
1997, f. 14, p. 46—52.
lO.Stanbrige R., Hadjinikolaou L Technical adjuncts in beating heart surgery comparison ofMIDCAB to off-pump sternotomy:
a metaanalysis. Eur. J. Cardio-Thorac Surg. 1999, v. 16 (Suppl. 2), p. 24—33.
48
ТРАНСПЛАНТАЦИЯ СЕРДЦА: НАСТОЯЩЕЕ И БУДУЩЕЕ
В. И. Шумаков
Прошло уже более 35 лет после первой клинической трансплантации сердца (ТС) в мире. По данным меж дународного регистра «сердце и легкие» за 2001 г., за этот период времени выполнено около 58 000 ТС. Среди заболеваний, при которых выполняли ТС, ишемическая болезнь сердца (ИБС) составила 44,3%, дилатационная кардиомиопатия (ДКМП) — 43,7%, приобретен ные пороки сердца — 3,6%, врожденные пороки сер дца — 1,5%, ретрансплантации сердца — 2% и другая патология — 4,9%. Выживаемость после ТС более 1 года составила 80%, 11,6 лет — 50%, при этом в 20% слу чаев длительность наблюдения достигла 15—17 лет. Максимальная продолжительность жизни после ТС составила 23 года, ежегодная летальность— 3—4%. С 1984 г. начато выполнение двухэтапных ТС, когда в отсутствие донорского органа у потенциального реци пиента применяют либо механическую замену функции сердца (механический «мост»), либо интенсивную кардиотоническую терапию симпатомиметическими пре паратами (фармакологический «мост»). Использование медикаментозного или механического «моста» позволя ет выполнить ТС вторым этапом у 62% больных, нужда ющихся в немедленной ТС. Выживаемость более 1 года при таком варианте лечения составляет 70%.
Первая успешная ТС в России выполнена 12 марта 1987 г. В.И. Шумаковым в НИИ трансплантологии и искусственных органов МЗ РФ (НИИТ и ИО МЗ РФ). Больная прожила с пересаженным сердцем 8,5 года, С этого времени в России выполнено 144 ортотопических ТС (НИИТ и ИО МЗ РФ— 116, Всероссийский научный центр хирургии — 25, Военно-медицинская академия им. СМ. Кирова — 3) и 2 пересадки комплекса сердце—лег кие (НИИТ и ИО МЗ РФ— 1 и Всероссийский кардиоло гический научный центр РАМН— 1), в клинике НИИТ и ИО МЗ РФ 92 ТС были одноэтапными, 23 — двухэтапными и 1 — повторная через 4,5 года после первичной ТС.
На основании обследования более 700 больных в конечной стадии застойной сердечной недостаточнос ти, обусловленной ДКМП (70,2%) и ИБС (29,8%), уста новлено, что показанием к ТС служит тяжелая застойная сердечная недостаточность III—IV функционального класса по шкале NYHA, рефрактерная к медикаментоз ной терапии. При определении показаний к ТС у боль
ных ИБС (ишемическая кардиомиопатия, постинфарк тные аневризмы левого желудочка) учитывают общую и локальную сократимость левого и правого желудочков, размеры и объемы полостей сердца, наличие жизне способного миокарда в зоне пораженных коронарных артерий, возможность адекватного ремоделирования левого желудочка и реваскуляризации стенозированных коронарных артерий.
К абсолютным противопоказаниям к ТС относят фиксированную легочную гипертензию с транслульмональным градиентом > 15 мм рт. ст. и легочным сосу дистым сопротивлением > 5 единиц Вуда, резистентную к фармакологическим пробам (нитропруссид натрия, добутамин, оксид азота), а также полиорганную недо статочность, активные инфекционные процессы, неко торые системные болезни, алкоголизм и наркоманию. Все остальные заболевания, которые регрессируют при терапевтическом и хирургическом лечении, относят к временным (относительным) противопоказаниям к ТС. После определения показаний и противопоказаний в лист ожидания ТС включается не более 25% больных.
Для объективного определения очередности выпол нения трансплантаций больным, находящимся в листе ожидания, разработана рабочая классификация (United Network for Organ Sharing — UNOS), согласно которой состояние пациентов делят на три статуса.
СТАТУС 1А — негликозидная инотропная или меха ническая поддержка (внутриаортальная баллонная контрпульсация, левожелудочковый, правожелудочковый или бивентрикулярный обход, искусственное сер дце), продолжающаяся менее 30 дней без улучшения клинического и гемодинамического состояния боль ного и сопровождающаяся различными осложнения ми (тромбоэмболии, инфекции, нарушения в системе механической поддержки, длительная искусственная вентиляция легких, сочетанное применение нескольких негликозидных инотропных препаратов в дозах выше терапевтических).
СТАТУС 1Б — механическая или медикаментозная поддержка более 30 дней без осложнений.
СТАТУС 2 — все остальные пациенты, ожидающие ТС. Анализ состояния потенциальных реципиентов, ожидающих ТС, показал, что у 407о из них возникают
49
Сердечно-сосудистая хирургия
тяжелые расстройства кровообращения: в 60% наблю дений — внезапная остановка сердца; в 12% — быстро прогрессирующая сердечная недостаточность с кардиогенным шоком; в 28% — медленно прогрессирующая недостаточность кровообращения.
У 48 больных до ТС использовали фармакологический «мост» с назначением негликозидных инотропных препа ратов в терапевтических дозах (добутамин до 5 мкг/кг/мин или допамин до 3 мкг/кг/мин от 1 до 4 месяцев). Из них 33 (68,7%) пациента погибли, не дождавшись ТС. 15 (31,3%) больным выполнили ТС. Выписано после ТС 78,8% боль ных. Выживаемость более 1 года составила 72,7%. Сроки наблюдения к настоящему моменту от 3 до 6 лет.
У 31 больного использовали механический «мост» — вспомогательное кровообращение или полную заме ну сердца (имплантация искусственного сердца). Показания к механическому «мосту» в настоящее время четко объективизированы: прогрессирующая сердеч ная недостаточность (систолическое артериальное дав ление менее 90 мм рт. ст., сердечный индекс менее 2 л/ мин/мг, давление в левом предсердии более 25 рт. ст.), рефрактерная к максимальной инотропной поддержке (добутамин до 30 мкг/кг/мин, допамин до 10 мкг/кг/мин, адреналин до 500 нг/кг/мин). При решении вопроса о начале механического «моста» должны быть исклю чены абсолютные противопоказания к выполнению последующей ТС (необратимая полиорганная недоста точность, инфекционные осложнения).
На первом этапе до ТС в 2 наблюдениях исполь зовали внутриаортальную баллонную контрпульсацию, в 16 — обход левого желудочка центробежным насосом «БИОПАМП», в 6 — бивентрикулярный обход сердца и в 7 — имплантацию искусственного сердца «ПОИСК ЮМ».
Двухэтапные ТС выполнили 10 больным: 1 реципи енту после внутриаортальной баллонной контрпуль сации в течение 5 суток, 8 больным — после обхо дов левого желудочка длительностью 1,5—55 суток и 1 — после имплантации искусственного сердца и его работы в течение 3,5 суток. В остальных наблюдениях диагностировали абсолютные противопоказания к ТС. 8 настоящее время сроки наблюдения реципиентов после двухэтапных ТС составляют до 60 месяцев.
В 2006 г. начато использование имплантируемого осевого насоса INC0R при медикаментозно рефрактер ной сердечной недостаточности.
В 1995—2002 гг. у 50% реципиентов перед ТС при менили либо медикаментозный, либо механический «мост».
В 59 наблюдениях забор донорского сердца выполня ли в клинике института, в 43 — трансплантат забирали дистанционно. У 65% доноров выполняли мультиорган-
ный забор (сердце, печень, почки). Для защиты транс плантата при заборе донорского сердца непосредственно в клинике использовали кристаллоидную кардиоплегию. Длительность ишемии трансплантата не превышала 80 мин. При дистанционном заборе применяли консер вирующий раствор внутриклеточного действия кустадиол. Длительность ишемии трансплантата в большинстве наблюдений не превышала 3,5 ч. В 3 случаях длитель ность ишемии достигала от 4 ч 30 мин до 5 ч 45 мин. Все трое реципиентов выписаны из клиники. Настоящие наблюдения являются доказательством того, что донорс кое сердце может переносить ишемию до б ч.
При 77 ТС использовали классическую атриальную хирургическую технику; при 6 — кава-кавальную мето дику и при 33 — модификацию кава-кавальной методи ки ТС, предложенную В.И. Шумаковым.
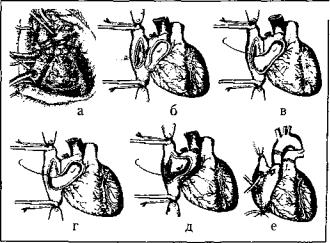
Модифицированную кава-кавальную ТС выполняли следующим образом (рис. 1). После удаления серд ца реципиента по классической методике и стенки левого предсердия так, чтобы оставалась только пло щадка, в которую впадают левые и правые легочные вены, создавали узкий «мостик» между полыми венами реципиента. Для этого расслаивали предсердия по межпредсердной перегородке, как это выполняют при доступе к митральному клапану слева. Глубину этого
Рис. 1. Методика трансплантации сердца академика В.И.Шумакова: а — рассечение и разделение межпредсер дной перегородки на уровне межпредсердной борозды; б — формирование «мостика» из задней стенки правого пред сердия реципиента: в — анастомоз между медиальным краем донорского сердца и медиальным краем сформированного «мостика» между полыми венами реципиента; г — анастомоз «конец и бок» между медиальным краем донорского пред сердия и ладней стенкой правого предсердия; д— анастомоз между латеральным краем донорского сердца и латеральным краем сформированного «мостика»; е— вид сердца после окончания подшивания трансплантата
50
