
Kratkii_kyrs_lekcii_po_himii
.pdf31
Е.А. Буйлова, Д.Р. Галиева
Лекция 9. Растворы. Способы выражения концентрации растворов. Свойства растворов
Ключевые слова: растворы, растворенное вещество, растворитель, растворимость, насыщенные и ненасыщенные растворы, массовая доля растворенного вещества, молярность, нормальность, моляльность, мольная доля, титр, осмотическое давление, понижение давления пара над раствором, эбулиоскопическая постоянная, криоскопическая постоянная.
Раствор - это твердая, жидкая или газообразная гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах. Всякий раствор состоит из растворенных веществ и растворителя, т. е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить дополнительное количество данного вещества, ненасыщенным.
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) - число единиц массы
(например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.∙100%)/mр-ра. Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность (См) - число моль (n) растворенного вещества,
содержащихся в 1 л раствора: См = n/V. Так, 2М H2SO4 обозначает раствор серной кислоты, в каждом литре которого содержится два моля H2SO4, 196 г.
3.Молярная концентрация эквивалента (нормальность) (СН): - число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4.Моляльность (Сm) - число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольномассовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5.Мольная доля (Ni) - отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2, где СН1, СН2 – молярные концентрации эквивалента (моль)
32
растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2
соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
Свойства растворов. Относительное понижение давления
насыщенного пара растворителя над раствором равно мольной доле растворённого вещества (закон Рауля, 1887 г.): N2 = [(Pо - P) / Pо], где N2 -
мольная доля растворённого вещества; P0 - давление насыщенного пара растворителя над чистым растворителем (кПа), P - давление насыщенного пара растворителя над раствором (кПа).
Односторонняя диффузия растворителя в раствор через полупроницаемую перегородку называется осмосом. Объём раствора в результате осмоса увеличивается, при этом возникает давление на стенки сосуда, в котором находится раствор. Это давление называется осмотическим
(Pосм,, кПа): Pосм = i∙См∙R∙T,
постоянная, T – температура, К
Изотонический коэффициент i (коэффициент Вант-Гоффа) -
поправочный коэффициент, отражающий увеличение числа частиц в растворах электролитов по сравнению с растворами неэлектролитов той же концентрации.
Криоскопия - физико-химический метод исследования жидких растворов нелетучих веществ, основанный на измерении понижения температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя. Понижение температуры ( tзам) замерзания раствора:
где К - криоскопическая постоянная растворителя - величина понижения температуры замерзания раствора, в котором содержится 1 моль растворенного вещества в 1 кг растворителя, Cm - моляльная концентрация раствора.
Эбуллиоскопия - метод изучения жидких растворов нелетучих веществ, основанный на измерении повышения температуры кипения раствора по сравнению с температурой кипения чистого растворителя. Повышение температуры кипения (Δtкип) раствора: Δtкип = i∙E∙Cm, где Е -
эбуллиоскопическая постоянная (константа) растворителя — величина повышения температуры кипения раствора, в котором содержится 1 моль растворенного вещества в 1
кг растворителя. Изотонический коэффициент (i) связан со степенью диссоциации (α) электролита соотношением α =[(i - 1) / (k - 1)], где k — число ионов, на которые распадается при диссоциации молекула электролита (для KCl k=2,
для ВаС12 и Na2SO4 k = 3 и т. д.).
Контрольные вопросы:
1.Из каких компонентов состоит раствор?
2.Какие растворы называются насыщенными?
3.Перечислите основные способы выражения концентрации растворов.
4.Что означают записи: 2,5 М NaOH, 0,1 н H2SO4?
Список рекомендуемой литературы:
1. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. -
М.: КНОРУС, 2009. - С. 217 - 236.
2. Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов - 7-е изд., испр. - М.: Высшая школа, 2006. - С. 204.
33
Е.А. Буйлова, Д.Р. Галиева
Лекция 10. Дисперсные системы. Поверхностные явления
Ключевые слова: дисперсионная среда, дисперсная фаза, адсорбция, поверхностноактивные вещества (ПАВ).
Дисперсные системы – гетерогенные системы, состоящие из сплошной непрерывной фазы – дисперсионной среды - и находящихся в ней раздробленных частиц того или иного размера и формы – дисперсной фазы.
Количественной характеристикой дисперсности (раздробленности) вещества является степень дисперсности (Д): Д = 1/a, где a – размеры частиц.
По степени дисперсности все дисперсные системы можно разделить на три группы:
1.Грубодисперсные (взвеси) – размеры частиц 10-5-10-7 м.
2.Коллоидные растворы (золи) – размеры частиц 10-7-10-9 м.
3.Истинные растворы – размеры частиц менее 10-9м.
Трем возможным агрегатным состояниям дисперсной фазы и дисперсионной среды соответствуют следующие типы гетерогенных дисперсионных систем.
Типы гетерогенных дисперсионных систем
(классификация по агрегатным состояниям)
Агрегатное состояние |
Агрегатное состояние дисперсной фазы |
||
дисперсионной среды |
|
|
|
газообразное |
жидкое |
твердое |
|
|
|
|
|
Газообразное |
- |
Г-Ж (туман) |
Г-Т (дымы, пыли) |
Жидкое |
Ж-Г (пены) |
Ж1-Ж2 (эмульсии) |
Ж-Т (суспензии) |
Твердое |
Т-Г (твердые пены) |
Т-Ж |
Т1-Т2 |
Таким образом, дисперсные системы – гетерогенные системы. В системах Ж-Г, Ж-Т, Г-Т и других каждая фаза ограничена внешней поверхностью. Состояние вещества у поверхности раздела соприкасающихся фаз отличается от его состояния внутри этих фаз. Это различие вызывает особые поверхностные явления на границе раздела фаз.
Чем больше поверхность раздела между фазами (или поверхность единицы объема системы), тем больше ее избыточная свободная энергия, сконцентрированная на поверхности раздела фаз. Следовательно, все дисперсные и особенно коллоидные системы обладают большим запасом, или избытком, свободной энергии, сконцентрированным на поверхности дисперсной фазы, чем обычные массивные тела. Условием устойчивого равновесия системы является минимум свободной энергии. Системы с большим запасом свободной энергии неравновесны, термодинамически неустойчивы, в них будут самопроизвольно протекать процессы, сопровождающиеся уменьшением запаса свободной энергии, которая всегда стремится к минимальному значению.
Одним из таких самопроизвольных процессов, протекающих на границе раздела двух фаз и приводящих к снижению поверхностного натяжения,
является адсорбция.

34
Изменение концентрации газообразного или растворенного вещества на границе раздела фаз – на поверхности твердого тела или жидкости – называется
адсорбцией.
Повышение концентрации на границе раздела фаз есть положительная адсорбция. Растворенные вещества, понижающие поверхностное натяжение растворителя, называются поверхностно-активными (ПАВ), а повышающие –
поверхностно-инактивными.
Одно и то же поверхностно-активное вещество может гидрофобную жидкость делать гидрофильной, а гидрофильную превращает в гидрофобную (рисунок).
.
а |
б |
Ориентация молекул поверхностно-активных веществ на границе: а – вода – масло; б – масло-вода
Вещество, поглощающее своей поверхностью молекулы или ионы других веществ, называется адсорбентом. Адсорбируемое вещество называется
адсорбтивом:
адсорбция
адсорбент + адсорбтив |
адсорбат |
десорбция
В некоторых случаях поглощение, начавшееся на поверхности, распространяется вглубь поглотителя. Такой процесс называется абсорбцией.
Общий термин для всех явлений, связанных с поглощением – сорбция. Следовательно, адсорбция и абсорбция представляют собой частные случаи сорбции. Абсорбция – явление объемное, а адсорбция – чисто поверхностное. Сорбция может ограничиваться либо только взаимодействием за счет физических (ван-дер-ваальсовых) сил, либо одновременно сопровождается образованием нового вещества за счет проявления валентных (химических) сил (хемосорбция).
Контрольные вопросы:
1.Что такое дисперсные системы?
2.Что является дисперсионной средой и дисперсной фазой в тумане?
3.Какой процесс называют адсорбцией?
4.Что такое ПАВ?
Список рекомендуемой литературы:
1. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. -
М.: КНОРУС, 2009. - С. 314 - 351.
2. Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов - 7-е изд., испр. - М.: Высшая школа, 2006. - С. 243 - 250.
35
Е.А. Буйлова, Д.Р. Галиева
Лекция 11. Растворы электролитов. Электролитическая диссоциация
Ключевые слова: электролиты, сольватация, степень диссоциации, константа диссоциации, ионная сила раствора, активность ионов, коэффициент активности, закон разбавления Оствальда, факторы, влияющие на степень диссоциации.
По способности проводить электрический ток все вещества делятся на электролиты (проводящие электрический ток) и неэлектролиты (не проводящие электрический ток). Электролиты - вещества, обладающие ионной проводимостью; их называют проводниками второго рода – прохождение тока через них сопровождается переносом вещества. К электролитам относится большинство неорганических кислот, оснований и солей. В среде высокой диэлектрической проницаемости (спирты, вода и др.) они распадаются на ионы. Процесс распада молекул на ионы называется электролитической диссоциацией: NaCl 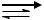 Na+ + Cl . Диссоциация электролитов на ионы сопровождается сольватацией, т.е. взаимодействием ионов с полярными молекулами растворителя. Если растворителем является вода, то термин «сольватация» заменяется термином «гидратация».
Na+ + Cl . Диссоциация электролитов на ионы сопровождается сольватацией, т.е. взаимодействием ионов с полярными молекулами растворителя. Если растворителем является вода, то термин «сольватация» заменяется термином «гидратация».
Количественной характеристикой процесса диссоциации является степень диссоциации ( ), которая показывает отношение числа молекул, распавшихся на ионы (Nион), к общему числу растворенных молекул (Nобщ):
По степени диссоциации электролиты делятся:
1) на сильные, которые в 0,1 М растворе имеют >30%; к ним относятся: почти все соли (кроме HgCl2, СdCl2, Fe(SCN)3, Pb(CH3COO)2 и некоторые другие); сильные минеральные кислоты (HNO3, HCl, H2SO4, HI, HBr, HСlO4);
основания щелочных (LiOH, NaOH, KOH, RbOH, CsOH, FrOH) и щелочноземельных металлов(Ca(OH)2, Sr(OH)2, Ba(OH)2);
2) средние ( = 3 - 30 % в 0,1 М растворах); к ним относятся, например,
H3PO4, H2SO3, HF, Mg(OH)2;
3) слабые ( < 3 % в 0,1 М растворах); слабыми электролитами являются
H2S, H2CO3, HNO2, HCN, H2SiO3, H3BO3, HClO и др., а также большинство оснований многовалентных металлов, NH4OH и вода.
Сильные электролиты практически нацело диссоциируют на ионы, и этот
процесс можно изобразить следующим образом: |
|
|
||||
HCl |
|
|
H+ + Cl ; |
Na2SO4 |
|
2Na+ + SO42 |
|
|
|
||||
Для |
оценки состояния ионов |
в растворе пользуются активностью – |
||||
условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах. Активность иона а (моль/л) связана с его молярной концентрацией в растворе (См) соотношением: а = f∙См,
коэффициент активности иона (безразмерная величина).
Коэффициенты активности ионов зависят от состава и концентрации раствора, заряда и природы иона и других условий. Значения коэффициентов
36
активности по рассчитанной ионной силе раствора можно определить с использованием соответствующих таблиц. Ионная сила раствора (Ι) равна полусумме произведений молярных концентрации (См) каждого иона на квадрат его заряда (Z):
Ι = 0,5 (C1Z12 + C2Z22 + … + CnZn2) = 0,5 Σ Ci Zi 2, ( i = от 1 до n)
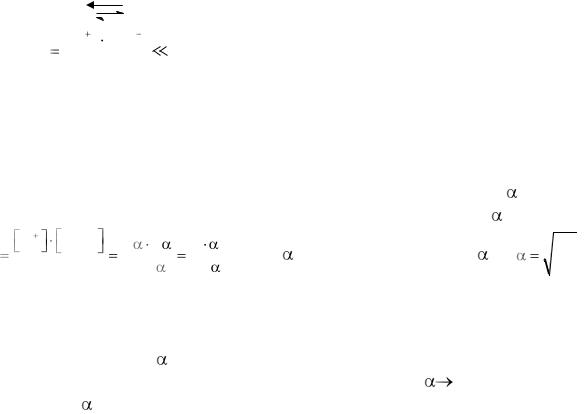
Слабые электролиты диссоциируют частично и обратимо. В их растворах преобладают не ионы, а молекулы. К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать константу равновесия, которая называется константой диссоциации (КД) и приводится в таблицах. Константа диссоциации характеризует силу электролита: чем больше величина КД., тем сильнее электролит, и наоборот.
HNO2 |
|
|
|
|
H+ |
+ |
NO2– |
(уравнение электролитической диссоциации) |
||
|
|
|
||||||||
К |
|
[H ] [NO2 ] |
|
|
+ |
- |
||||
Д |
|
|
|
|
|
1, |
где |
[H ], |
[NO2 ], [HNO2] – молярные равновесные |
|
[HNO2 |
] |
|
||||||||
|
|
|
|
|
|
|
||||
концентрации соответствующих частиц в растворе, КД – константа диссоциации азотистой кислоты HNO2
Равновесия в слабых электролитах подчиняются закону разведения Оствальда. Если общая молярная концентрация слабого электролита, например, слабой кислоты HNO2 равна С (моль/л), тогда концентрация ионов
H+ и NO2- будет определяться выражением [H+] = [NO2-] = С· |
(моль/л), а |
|||||||||||||
концентрация недиссоциированного электролита [HNO2] = (С-С· |
). Тогда |
|
|
|||||||||||
|
H NO2 |
- |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
C C |
|
C |
|
. 2 |
|
|
КД |
|
|
|||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
KД |
|
|
|
|
|
|
|
. При |
<< 1 получим КД = С |
и |
|
|
. |
|
HNO2 |
|
|
C 1- |
1- |
|
|
С |
|||||||
|
|
|
|
|
|
|
|
|
|
|||||
Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, присутствия в растворе одноименных ионов, температуры. Для одного и того же электролита при данной температуре степень диссоциации ( ) увеличивается с разбавлением раствора; при больших
разбавлениях |
электролит полностью диссоциирует ( |
1). С увеличением |
температуры |
также увеличивается. |
|
Контрольные вопросы:
1.Какие вещества называются электролитами и неэлектролитами?
2.Дайте определение кислотам, основаниям и солям с точки зрения теории электролитической диссоциации.
3.Что такое степень и константа диссоциации?
4.В каких случаях термин «концентрация» заменяется термином «активность»?
Список рекомендуемой литературы:
1.Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. -
М.: КНОРУС, 2009. - С. 237 - 252.
2.Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов
-7-е изд., испр. - М.: Высшая школа, 2006. - С. 210 - 243.

37
С.Б. Денисова, О.Б.Чалова
Лекция 12. Диссоциация воды. Диссоциация кислот и оснований. Водородный показатель
Ключевые слова: ионное произведение воды, водородный показатель (рН), гидроксильный показатель (рОН), кислота, основание, расчеты рН в растворах кислот и оснований.
Вода в очень малой степени находится в диссоциированном состоянии (очень слабый электролит): H2O  H+ + OH –
H+ + OH –
К её диссоциации можно применить закон действующих масс:
К Д |
[H ] [OH ] |
1.8 10 |
16 |
|
|
|
|||
[H 2 O] |
|
|||
|
|
|
||
При столь малой константе диссоциации (КД) концентрация воды
остается |
практически неизменной и |
равной [H2O]=1000/18=55.6 моль/л. |
|||||
К В |
[H ] [OH ] K D [H 2 O] |
1000 |
1.8 |
10 |
16 |
1 10 14 |
|
|
|
|
|
|
|||
|
|
18 |
|
|
|||
|
|
|
|
|
|
|
|
Произведение постоянных величин - также постоянная величина: Kд·[H2O] = [H+]·[OH–]. Таким образом, произведение молярных концентраций ионов водорода [H+] и гидроксильных групп [OH–] в любом водном растворе есть величина постоянная (при данной температуре) и называется ионным произведением воды (КВ). Диссоциация воды – процесс эндотермический, поэтому ионное произведение воды (КВ) зависит от температуры. С повышением температуры увеличиваются концентрации [H+] и [OH–] ионов и величина ионного произведения: так, при 100оС: КВ = [H+][OH–] = 59·10-14 , при
0оС: КВ = [H+][OH–] = 0,139·10-14.
В соответствии с теорией электролитической диссоциации ионы H+ являются носителями кислотных свойств, а ионы OH– - носителями основных свойств. Поэтому раствор будет нейтральным, при условии: [H+] = [OH–] =
10–7 моль/л; при [H+] > [OH–] – кислым; при [H+] < [OH–] – щелочным. Концентрация катионов водорода [H+] обычно выражается очень малыми
величинами. Для большего удобства принято пользоваться отрицательным значением десятичного логарифма молярной концентрации ионов [H+], который назван водородным показателем, и обозначается рН:
рН = –lg [H+], где [H+] - молярная концентрация ионов H+. Следовательно: [H+]= 10–pH
Если реакция среды нейтральная, то [H+] = 10–7 [моль/л], и рН=7. Если реакция среды кислая, то [H+]>10–7 [моль/л], и рН<7. Если среда щелочная, то [H+]<10–7 [моль/л], и рН>7. По аналогии рН введен гидроксильный показатель (рОН):
рОН = –lg [ОH-], где [ОH-] - молярная концентрация ионов ОH-. А также показатель
константы воды: рКВ = –lg КВ . Логарифмируя ионное произведение воды, получаем выражение: –lg [H+][OH–] = –lg 10–14 и далее: pH + pOH = 14.
Кислота (определение по Аррениусу) – это химическое соединение, которое в водном растворе полностью или частично диссоциирует на положительные ионы водорода и отрицательные ионы кислотного остатка.
38
Расчет рН в растворах сильных и слабых кислот
1. Поскольку диссоциация сильной кислоты (HNO3, HCl, H2SO4, HI, HBr, HСlO4) протекает практически полностью, можно считать: [H+] = Скисл., где Скисл
- молярная концентрация кислоты.
HNO3 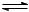 H+ + NO3– (сильная кислота - сильный электролит)
H+ + NO3– (сильная кислота - сильный электролит)
Расчет рН сильной кислоты проводят по уравнению
рН = - lgаН+ = - lgfН+[H+], где аН+ - активная концентрация, моль/л.
2. При расчете рН слабых электролитов обычно принимают ионную силу раствора (I) равной нулю, коэффициент активности (f) равным 1 и рН = - lg[H+].
HNO2 |
|
|
H+ + NO2– |
(слабая кислота - слабый электролит) |
||
|
|
|||||
Концентрация ионов водорода в растворе слабых кислот определяют по |
||||||
закону разведения Оствальда: |
|
|||||
|
|
|
|
|
|
|
H |
Cкисл |
|
Ккисл Скисл ,где |
α – степень диссоциации кислоты, Скисл – |
||
молярная концентрация кислоты, Ккисл – константа диссоциации кислоты, характеризует силу кислоты: чем меньше константа диссоциации, тем слабее кислота.
Основание (определение по Аррениусу) - это химическое соединение, которое в водном растворе частично или полностью диссоциирует на положительно заряженные ионы (простые или сложные) и отрицательно заряженные гидроксид-ионы.
Расчет рН в растворах сильных и слабых оснований
1. Диссоциация сильного основания (LiOH, NaOH, KOH, RbOH, CsOH,
FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2) протекает практически полностью: |
||
NaOH |
Na+ + OH– |
(сильное основание - сильный электролит) |
Можно считать, что [ОH-] = Сщел, где Сщел - молярная концентрация сильного основания (щелочи). Расчет рН раствора сильного основания проводят по схеме:
рОН = - lgаОН- = - lgfОН-[ОH-]; |
|
рН = 14 – рОН. |
|||||
2. Диссоциация слабого основания протекает незначительно, частично: |
|||||||
NH3·H2O |
|
|
|
NH4+ + OH– |
(слабое основание - слабый электролит) |
||
|
|
||||||
Молярную концентрацию гидроксид – ионов [ОH-] в растворе слабого |
|||||||
основания рассчитывают по закону разведения Оствальда: |
|||||||
|
|
|
|
|
|||
ОH |
Cосн Косн |
Сосн , где α – степень диссоциации основания, Сосн – |
|||||
молярная концентрация основания, Косн – константа диссоциации основания, характеризует силу основания: чем меньше константа диссоциации, тем слабее основание.
Контрольные вопросы:
1.Диссоциация воды, ионное произведение воды.
2.Водородный показатель (рН), гидроксильный показатель (рОН).
3.Расчет рН растворов сильных кислот и оснований.
4.Расчет рН растворов слабых кислот и оснований.
Список рекомендуемой литературы:
1. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. -
М.: КНОРУС, 2009. - С. 258.
2. Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов
- 7-е изд., испр. - М.: Высшая школа, 2006. - С. 215-218, 224 – 231.

39
С.Б. Денисова, Е.А. Буйлова, Д.Р. Галиева
Лекция 13. Произведение растворимости. Ионно-обменные реакции
Ключевые слова: малорастворимые сильные электролиты, произведение растворимости, растворимость, ионно-обменные реакции, реакция нейтрализации.
Насыщенный раствор находится в равновесии с твердой фазой растворяемого вещества. Гетерогенное равновесие «осадок  насыщенный раствор» характеризует константа равновесия. Если малорастворимый электролит диссоциирует по уравнению AmBn
насыщенный раствор» характеризует константа равновесия. Если малорастворимый электролит диссоциирует по уравнению AmBn  mAn+ + nBm-,
mAn+ + nBm-,
то выражение для константы равновесия – произведения растворимости
( ПРAm Bn ) – будет иметь вид: Кр = ПРAm Bn молярные концентрации ионов An+ и Bm- растворе. Например, для равновесия: СaSO4
= [An+]m∙[Bm-]n, где [An+], [Bm-] –
соответственно, в насыщенном
Ca2+ + SO42–
ПР CaSO |
[Ca 2 ][SO |
4 |
2 ] = 3,72·10-5 [моль2/л2] (при 25оС) |
|
4 |
|
|
Следовательно, для насыщенного водного раствора малорастворимого электролита произведение равновесных молярных концентраций его ионов в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данной температуре, и называемая произведением растворимости. Зная произведение растворимости (ПР), можно вычислить растворимость вещества (S) при данных условиях, т.е. концентрацию насыщенного раствора в [моль/л] и в [г/л]. Например, для бинарных электролитов (ВaSO4, СaСO3, AgI и др.) растворимость [моль/л] численно
равна: S 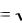
 ПР .
ПР .
В ненасыщенном растворе возможно растворение дополнительного количества вещества, так как концентрация меньше, чем в насыщенном. Из перенасыщенного раствора осадок образуется, так как его концентрация больше, чем в насыщенном.
Отсюда вытекают условия образования и растворения осадка:
1)если [An+]m∙[Bm-]n = ПРAmBn, то осадок находится в равновесии с раствором (насыщенный раствор);
2)если [An+]m∙[Bm-]n > ПРAmBn, то осадок выпадает (перенасыщенный
раствор);
3)если [An+]m∙[Bm-]n < ПРAmBn, то осадок растворяется (ненасыщенный раствор).
Важным следствием является правило, используемое для более полного удаления из раствора какого-либо иона: растворимость малорастворимого электролита уменьшается при введении хорошо растворимого электролита, имеющего одноименный (общий) ион с малорастворимым электролитом.
Вводных растворах электролитов химические реакции протекают с участием ионов, такие реакции называются ионно-обменными, а уравнения этих реакций – ионными уравнениями.
Вионных уравнениях реакций формулы сильных электролитов
40
записываются в виде ионов, формулы слабых электролитов, осадков и газов – в виде молекул.
Направление ионно-обменной реакции между двумя электролитами в растворе определяется возможностью образования их ионами осадка, газа или слабого электролита.
1. Образование малорастворимого соединения, выпадающего в виде
осадка: AgNO3 + NaCl = AgCl↓ + NaNO3 |
|
(молекулярное уравнение) |
|
Ag+ + NO3 |
– + Na+ + Cl – = AgCl↓ + Na+ + NO3 |
– (полное ионное уравнение) |
|
Ag+ + Cl – = AgCl↓ |
(сокращенное ионное уравнение ). |
||
2. Образование газообразного вещества, удаляемого из раствора:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
2Na+ + CO32 – + 2H+ + SO42 – = 2Na+ + SO42 – + H2O + CO2↑ CO32 – + 2H+ = H2O + CO2↑
3.Образование растворимого, но мало диссоциированного вещества, например, воды, слабой кислоты или слабого основания:
CH3COONa + H2SO4 = Na2SO4 + CH3COOH CH3COO –+ Na+ = 2Na+ +SO42 –+ CH3COOH CH3COO – + H+ = CH3COOH;
4.Образование устойчивой комплексной частицы – молекулы или иона:
HgI2 |
+ 2KI = K2[HgI4] |
|
|
|
|
Hg2+ + 2I |
– + 2K+ + 2I |
– = 2K+ + [HgI4]2 – |
|
|
|
Hg2+ + 4I |
– = [HgI4]2 – |
|
|
|
|
Реакциями |
нейтрализации |
называются |
обменные |
реакции |
|
взаимодействия кислот и оснований, в результате которых образуются соль и вода, например: NaOH + HCl = NaCl + H2O или OH – + H+ = H2O.
При нейтрализации сильного основания сильной кислотой равновесие практически полностью смещено в сторону образования воды. Реакции нейтрализации при взаимодействии кислот и оснований, различающихся по силе, не доходят до конца вследствие протекания обратной реакции гидролиза
соли, например: СН3СООН + NaOH |
|
CH3COONa + Н2О |
|
|
|||
СН3СООН + ОН- |
|
|
СН3СОО- + Н2О. |
|
|
||
Реакции нейтрализации экзотермические и протекают с выделением тепла.
Контрольные вопросы:
1.Произведение растворимости.
2.Растворимость и ее связь с произведением растворимости.
3.Условия образования и растворения осадков.
4.Ионно-обменные реакции.
5.Направление протекания ионно-обменных реакций.
6.Реакции нейтрализации.
Список рекомендуемой литературы:
1.Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. -
М.: КНОРУС, 2009. - С. 252 - 258.
2.Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов - 7-е изд., испр. - М.: Высшая школа, 2006. - С. 232 - 234.
