
- •7.4. Критическая ишемия нижних конечностей
- •7.5. Артериализация венозного кровотока стопы
- •7.6 Диагностика и лечение пациентов
- •7.6.1. Определение и эпидемиология хронической критической ишемии нижних конечностей
- •7.6.2. Обследование пациентов с критической ишемией нижних конечностей
- •7.6.3. Дифференциальная диагностика критической ишемии нижних конечностей
- •7.6.4. Лечение пациентов
- •7.7. Ишемическая диабетическая стопа
- •III. Смешанная форма (нейроише-мическая).
- •7.7.1. Диабетическая ангиопатия
- •7.8. Аневризмы периферических артерий
- •7.8.1. Классификация
- •7.8.2. Экстракраниальные аневризмы сонных артерий
- •7.8.3. Аневризмы артерий верхних конечностей
- •7.8.4. Аневризмы плечевой артерии и артерий предплечья
- •7.8.5. Аневризмы бедренных артерий
- •7.8.6. Аневризмы подколенной локализации
- •7.8.7. Аневризмы тибиальных артерий
- •7.8.8. Микотические аневризмы
- •7.9. Кистозное поражение адвентиции подколенной артерии
- •7.10. Хроническая ишемия верхних конечностей
- •7.11. Поясничная симпатэктомия
- •7.12. Грудная и поясничная эндоскопическая симпатэктомия
- •7.12.1. Торакоскопическая верхнегрудная симпатэктомия
- •7.12.2. Поясничная эндоскопическая симпатэктомия
- •7.13. Реваскуляризирующая остеотрепанация
- •7.14. Трансплантация большого сальника в лечении дистальных форм поражения артерий голени
- •7.15. Васкулогенная импотенция
- •7.15.1. Клиническая картина и диагностика
- •7.15.2. Лечение васкулогенной эректильной дисфункции
- •7.16. Травматические артериовенозные свищи
- •7.17. Ампутации конечностей при ишемии
с атеросклеротическим поражением артерий стопы очень важно оценить липидный профиль крови и при необходимости назначить соответствующее лечение.
Пациентам-курильщикам с изолированным поражением артерий стопы необходимо отказаться от курения.
Принципы сосудистой терапии остаются теми же. При отсутствии явлений критической ишемии стопы эффективна комплексная стандартная терапия, включающая прием пен-токсифиллина (1200—1800 мг/сут), ацетилсалициловой кислоты (50— 100 мг/сут) и механотерапию (дозированная ходьба). Необходимости в проведении стационарных курсов лечения у пациентов этой группы нет.
Больным с критической ишемией стопы комплексную терапию проводят в условиях стационара. Тактику лечения определяют, ориентируясь на поражения микроциркуляции стопы. При показаниях ТcР02 на стопе выше 20 мм рт.ст. эффективна, как правило, стандартная консервативная терапия, включающая внутривенную инфузию реополиглюкина по 400 мл с пентоксифиллином 10 мл (до 10 вливаний, выполняемых через день), струйное внутривенное введение солкосерила по 10 мл (до 10 вливаний), подкожное введение в течение 10—15 дней низкомолекулярных ге-паринов (фрагмин, фраксипарин). При купировании явлений критической ишемии пациентов в последующем переводят на дезагрегант-ную терапию.
При показаниях ТсР02 на стопе ниже 15—20 мм рт.ст. при критической ишемии стопы эффективно внутривенное курсовое лечение про-стагландином Е1 (вазапростан) в суточной дозе 60 мкг в течение как минимум 10—14 дней. Инфузия ваза-простана должна быть длительной — более 2 ч.
При изолированной окклюзии артерий стопы реконструктивные со-
212
судистые операции не выполняют. В арсенале хирургических методов лечения возможно использование лишь поясничной симпатэктомии, которая показана при явлениях критической ишемии. В последние 5—10 лет активно применяют эндоскопическую методику поясничной симпатэктомии.
При наличии язвенно-некротических дефектов на стопе параллельно с медикаментозной общей терапией назначают местное лечение — ежедневные обработка и перевязка язвенно-некротических очагов на стопе с использованием водорастворимых мазей или водных растворов йода (йодоповидон, йодопирон).
При купировании явлений критической ишемии может потребоваться хирургическая обработка на стопе, заключающаяся в некрэктомии с последующей пластикой (местными тканями или свободным кожным лоскутом).
Результаты лечения. У пациентов с изолированной окклюзией артерий стопы консервативная терапия, как правило, бывает эффективной более чем в 90 % случаев, поясничная сим-патэктомия — более чем в 95 % случаев. Лишь у 5 % больных встает вопрос о дистальной ампутации стопы, причем лишь у 2 % — на уровне сустава Шопара и Лисфранка.
Прогноз у больных с изолированной окклюзией артерий стопы благоприятный. Функциональной потери конечности не отмечается. Смертельных исходов в результате лечения также не бывает. Важно проведение комплексной терапии с учетом этиологии заболевания, при этом результат лечения положительный.
Литература
Second European Consensus Document on Chronic Critical Leg Ischaemia//Europ. J. Vasc. Surgery. - 1992. - Vol. 6. - Suppl. A.
International Consensus on the Diabetic Foot // The International Working Group on the Diabetic Foot. - 1999. — 96 p.
7.4. Критическая ишемия нижних конечностей
Термин "критическая ишемия конечности" был впервые предложен на Международном антологическом симпозиуме в 1981 г. В настоящее время он широко используется в литературе. Определение хронической критической ишемии включает следующие клинические признаки:
ишемическая боль покоя в течение более 2 нед с систолическим давлением на артериях голени меньшим или равным 50 мм рт.ст. (III степень ишемии по Фонтену);
наличие трофических язв или гангрены пальцев стопы с систолическим давлением в артериях голени меньшим или равным 50 мм рт.ст. (IV степень ишемии по Фонтену).
У больных, страдающих диабетом, систолическое давление измеряют на артериях I пальца стопы, в связи с тем что из-за выраженной кальцифика-ции артериальной стенки при диабетической ангиопатии показатели давления в артериях голени не являются достоверными. При этом критической ишемией считаются случаи, когда систолическое пальцевое давление (плетизмография на I пальце стопы) меньше или равно 30 мм рт.ст. (Second European Consensus Document on Chronic Critical Leg Ischae-mia, 1991).
Хроническими облитерирующими заболеваниями артерий нижних конечностей (ХОЗАНК) страдает 2—3 % населения. Эти заболевания больше распространены среди мужчин среднего и пожилого возраста, среди которых доля страдающих ХОЗАНК составляет 5 %. Эпидемиологические исследования основываются на подсчете количества больных с выраженными клиническими проявлениями заболевания, такими, как перемежающаяся хромота, боль покоя, трофические расстройства. Однако в течение нескольких лет ХОЗАНК
могут протекать мало- или асимптом-но (при I степени ишемии по классификации Фонтейна). В результате исследования, проведенного в Базель-ском университете (Швейцария), было установлено, что асимптомное течение ХОЗАНК встречается в 3 раза чаще, чем при выраженной клинической картине заболевания [Wid-merL.K., 1991].
Частота развития тяжелой ишемии при ХОЗАНК колеблется от 20 до 70 % [Bjerkelund CD., 1986]. Проведенные эпидемиологические исследования основывались на различных методиках подсчета числа больных с тяжелой ишемией конечности. По одной из них подсчитывали количество высоких ампутаций, выполненных у больных с ХОЗАНК. Их число в США, Великобритании, Норвегии и Дании составляет соответственно 280, 150, 250 и 280 на 1 млн жителей. Исходя из предположения, что у 25 % больных с тяжелой степенью ишемии требуется высокая ампутация конечности, число таких больных должно составлять от 600 До 1000 на 1 млн населения. Другой метод основан на подсчете общего количества больных ХОЗАНК в различных возрастных группах. Если предположить, что у 15—20 % пациентов, имеющих симптом перемежающейся хромоты, заболевание будет прогрессировать, то 1 % мужчин старше 55 лет должны иметь тяжелую ишемию конечности.
Количество пациентов, перенесших реконструктивные операции на магистральных артериях нижних конечностей по поводу тяжелой ишемии, также позволяет судить о ее частоте. Большинство операций бед-ренно-большеберцового шунтирования было выполнено больным с тяжелыми степенями ишемии. 70—80 % бедренно-подколенных и около 50 % аортоподвздошных реконструкций произведено по тем же показаниям. При суммировании количества ам-
213
путации и реконструктивных сосудистых операций, выполненных в Норвегии по поводу тяжелой ишемии, получается, что число пациентов с этой патологией составляет 400 человек на 1 млн жителей. В США этот показатель равен 600 человек на 1 млн населения. На основании этого можно заключить, что количество больных ХОЗАНК с тяжелой степенью ишемии в США и странах Европы составляет от 600 до 800 человек на 1 млн жителей [Myhre H.O., Mat-hisen S., 1992].
Патогенез. У больных с критической ишемией конечностей имеются различные гемодинамические, биохимические и гематологические нарушения. Однако их трудно скомбинировать в единую исчерпывающую теорию патогенеза этой патологии. Ведущую роль в появлении критической ишемии играет атеросклероз, а также существенное значение имеют тромбангиит и диабетические ан-гиопатии. Течение атеросклероза и тромбангиита часто осложняется тромбозом артерий, что приводит к резкому снижению перфузионного давления и кровотока в дистальной части конечности. При критической ишемии вследствие стенозов или окклюзии магистральных артерий кровоток в пораженной конечности настолько мал, что, несмотря на наличие компенсаторных механизмов, в первую очередь коллатерального кровотока, наступают тяжелые нарушения периферической микроциркуляции [Ruckley C.V. et al., 1986; Junger et al., 1989].
Определяющую роль в развитии критической ишемии конечности играют расстройства микроциркуляции. При ненарушенной микроциркуляции тромбоциты, лейкоциты и эндотелий взаимодействуют между собой так, чтобы обеспечивать соответствующие реакции на повреждение и воспаление без нарушения функции микроциркуляции [Botting R., Vane J.R., 1990]. Нормальное функционирование этой системы опреде-
ляется неирогенными и гуморальными механизмами и действием местных медиаторов.
Сосудорасширяющие медиаторы — простациклин и эндотелийпроизводя-щий релаксирующий фактор (ЭПРФ), эндотелийпроизводящий сосудосуживающий фактор (ЭПСФ, эндотелии) — продуцируются клетками эндотелия, который также участвует в различных микрососудистых защитных реакциях, удаляя тромбин и ва-зоактивные субстанции, и регулирует местную фибринолитическую активность, выделяя тканевый активатор плазминогена (т-ПА) и его ингибитор. Эндотелий также контролирует образование тромбина с помощью естественных антикоагулянтных механизмов (тромбомодулин, протеин С, протеин S) и воздействует на систему антитромбина-3 гликозами-ногликанами. Эндотелий, имея отрицательный поверхностный заряд, регулирует взаимодействие между сосудистой стенкой и форменными элементами крови, контролирует действие их адгезивных рецепторов.
Последовательность событий, ведущих к снижению капиллярной перфузии при критической ишемии, следующая: коллапс прекапиллярных артериол за счет низкого трансму-рального давления, артериолярный вазоспазм, нарушение сосудодвига-тельных реакций, микротромбозы, коллапс капилляров, вызванный ин-терстициальным отеком, окклюзия капилляров за счет набухания эндо-телиальных клеток, агрегация тромбоцитов, повышение ригидности и адгезивности лейкоцитов, повышение ригидности эритроцитов и кле-точно-тромбоцитарных агрегатов, местная активация иммунной системы [Lowe G.D.O., 1990]. При про-грессировании ишемии нарастает эндотоксикоз, выявляются выраженные реологические нарушения, что приводит к блокаде микроциркуля-торного русла в дистальных отделах конечности [Кунгурцев В.В. и др., 1994].
214
Изменения сосудистого мышечного тонуса и функции эндотелия определяют стабильный микрососудистый кровоток и относительно постоянное внутрисосудистое давление в новых гемодинамических условиях. Этот феномен носит название ауторегуляции. При критической ишемии имеет место недостаточность ауторегуляторной функции [Ubbink D.T., 1991].
При значительном снижении пер-фузионного давления наступают хроническая дилатация прекапиллярных сосудов, уменьшение и снижение скорости капиллярного кровотока. Хроническая вазодилатация способствует нарушению сосудодвигательной активности, осуществляющей равномерное поступление крови в ткани. Одновременно нарушаются ауторе-гуляторные механизмы, регулирующие капиллярное давление при изменении положения конечности. В норме при опускании конечности капиллярная вазоконстрикция ограничивает повышение капиллярного давления. Следствием нарушения этих механизмов являются капиллярная гипертензия и увеличенная фильтрация жидкости. В результате появляются отек и сдавление нутри-тивных капилляров, нарушается транскапиллярная диффузия кислорода [EickhoffJ.H., 1980].
Помимо перфузионного давления и тонуса сосудов, важное значение в циркуляции крови имеют ее реологические свойства, которые характеризуются показателями гематокрита, деформируемостью клеток крови, вязкостью плазмы. Лейкоциты и эритроциты имеют диаметр 7—8 мкм, нутритивные капилляры — 3—15 мкм. При нормальной микроциркуляции лейкоциты и эритроциты легко деформируются. При критической ишемии на фоне снижения перфузионного давления и скорости кровотока эритроциты И особенно лейкоциты труднее подвергаются деформации, причем их пассаж через нутритивные капилляры затруднен. К этому
же приводит повышение агрегации эритроцитов и уровня плазменного фибриногена. В свою очередь усиление агрегации эритроцитов повышает вязкость крови. Величина вязкости крови может расти и в ишемизи-рованных тканях за счет метаболического ацидоза и гиперосмолярнос-ти, что также повышает ригидность стенок эритроцитов. Активированные лейкоцитарные и тромбоцитар-ные агрегаты окклюзируют нутритивные капилляры, еще более ухудшая микроциркуляцию и усиливая ишемию. К этому же приводят скопление и адгезия лейкоцитов в вену-лах [Lowe G.D.O., 1990].
Наряду с реологическими нарушениями при критической ишемии имеют место и серьезные расстройства в системе гемостаза, что создает неблагоприятный коагуляционный профиль: сочетание гиперфункции тромбоцитов, повышение содержания в плазме маркеров активированного состояния свертывающей системы крови (фибриноген, протромбин и продукты деградации фибрина) с тенденцией к дефициту фибриноли-за из-за повышенного содержания в плазме ингибиторов тканевого активатора плазминогена [Ешкеева А.Р., 1995].
Диагностика. Все больные с критической ишемией конечностей подлежат обследованию и лечению в условиях специализированного сосудистого стационара. Из неинвазив-ных методов исследования применяют измерение систолического давления в артериях голени и пальцев стопы, сегментарное измерение давления в артериях конечности, спектральный анализ допплеровского сигнала и дуплексное сканирование. Эти методики направлены на изучение регионарной макрогемодинамикй конечности. Измерение давления в артериях голени и пальцах стопы используют для начальной оценки артериального кровотока в дистальной части конечности. Сегментарное измерение артериального давления на
215
различных уровнях дает информацию о наличии артериальных окклюзии в различных частях конечности [Gunderson J., 1972].
Метод дуплексного сканирования позволяет исследовать динамику кровотока и определить изменение стенок артерий конечности. Наиболее информативна эта методика при исследовании подвздошных и бедренных артерий, а также берцово-стопного сегмента [Seifert H., Jager К., 1990].
Обследование больных с крити ческой ишемией должно обязательно включать исследование микроцирку ляции путем чрескожного измерения парциального давления кислорода, капилляроскопии, лазерной доппле-; рофлоуметрии.
Наиболее важным является чрес-кожное измерение Р02 (рис. 7.22). По данным Л.Клэйсса и соавт. (1995), ТсР02 при II степени ишемии конечности равно 37,7 мм рт.ст., при III степени — 22,3 и при IV степени ишемии конечности — 14,8 мм рт.ст.
В анализах крови следует обращать внимание на количество тромбоцитов и лейкоцитов, уровень фибриногена в плазме, вязкость плазмы, уровень гликемии, протромбиновое время, содержание холестерина, три-глицеридов, липопротеидов высокой плотности.
Если комплексная консервативная терапия оказывается неэффективной в купировании критической ишемии на протяжении 2 нед, то больным показано ангиографическое исследование для определения харак-
тера и распространенности окклюзи-онных процессов в артериях для решения вопроса о возможности оперативного лечения [Bartoli J.M., 1990].
Алгоритм обследования больных с критической ишемией конечности.
Исследование крови:
полный общий анализ крови;
вязкость плазмы;
липидный профиль (холестерин, триглицериды, липопротеиды высокой плотности);
определение количества тромбоцитов;
уровень сахара крови;
суточный профиль сахара крови;
протромбиновый индекс;
уровень фибриногена;
• электрофорез протеинов крови. Сердечно-сосудистая система:
ЭКГ с нагрузкой (если существует возможность данного исследования без использования нижних конечностей);
эхокардиография;
• рентгенография грудной клетки. Исследование макроциркуляции:
измерение сегментарного артериального давления на нижних конечностях с определением лодыжеч-но-плечевого индекса (ЛПИ) (недостоверен у больных с диабетом из-за медиосклероза артерий среднего диаметра);
спектральный анализ доппле-ровского сигнала с периферических артерий нижних конечностей;
дуплексное сканирование артерий нижних конечностей;
дуплексное сканирование бра-хиоцефальных артерий (особое зна-

216
чение придается исследованию бифуркаций общих сонных артерий);
• рентгеноконтрастная ангиогра фия с уровня брюшной аорты до ар терий стопы с использованием фар макологической пробы.
Исследование микроциркуляции:
транскутанное измерение напряжения кислорода в первом межпальцевом промежутке в положении конечности лежа и сидя;
видеокапилляроскопия ногтевого ложа пораженной конечности;
лазерная флоуметрия дисталь-ных отделов стопы.
При наличии язвенно-некротических дефектов на стопе:
• определение вида флоры и чувс твительности к антибактериальным препаратам.
При наличии сахарного диабета:
определение уровня гликолизи-рованного гемоглобина;
определение регионарного систолического давления на пальцах стопы;
• рентгенография стопы. Исследования, проводимые у больных
тромбангиитом:
определение уровня С-реактивного белка;
определение показателей гуморального иммунитета (циркулирующие иммунные комплексы, IgG и IgM).
Комплекс проведенных диагностических мероприятий определяет выбор вида лечения больного с критической ишемией нижней конечности.
Лечение. При лечении больных с критической ишемией конечностей, особенно до выполнения радикальных вмешательств, показаны такие мероприятия, как борьба с ишеми-ческим отеком, болью покоя и трофическими язвами. При наличии боли покоя больные опускают конечность. При этом необходимо выбрать наиболее оптимальное ее положение, чтобы не провоцировать увеличение отека, так как он, сдавливая капилляры, ухудшает микроцирку-
ляцию и усиливает ишемию конечности [Fagrell В., 1977].
Консервативные мероприятия эффективны у больных с критической ишемией лишь в 15—20 % случаев. Поэтому при определении лечебной тактики у больных с критической ишемией конечности прежде всего необходимо решить вопрос о возможности реконструктивной операции.
Реконструктивная сосудистая операция показана больным с критической ишемией конечности там, где имеются адекватные пути оттока, однако ранний тромбоз трансплантата может ухудшить ишемию конечности и привести к ампутации на более высоком уровне, чем предполагалось ранее. Сочетание безуспешной восстановительной операции и последующей ампутации сопровождается более высокой смертностью, чем при первичной ампутации. Поэтому показания к реконструктивной сосудистой операции у больных с критической ишемией конечности должны ставиться очень строго, с оценкой как общего, так и местного статуса.
К основным видам хирургического лечения критической ишемии конечностей относят ангиопластику и реконструктивные сосудистые операции.
Чрескожная ангиопластика со стентированием может применяться при наличии стенозов и окклюзии подвздошных артерий либо бедрен-но-подколенного сегмента длиной до 10 см. Если длина стенозов и окклюзии превышает 10 см или они расположены дистальнее бедренно-подколенного сегмента, чрескожную ангиопластику у больных с критической ишемией можно выполнять лишь в тех случаях, когда проведение реконструктивной сосудистой операции невозможно [Zeitler E., 1985]. В ближайшем послеоперационном периоде после чрескожной ангиопластики частота неудовлетворительных результатов в среднем на 10—20 % больше, чем у больных со II степенью ишемии конечности.
217
Проходимость через год после проведения ангиопластики сохранялась у 58 % и через 5 лет — у 33 % больных. При ишемии II степени эти показатели составляют соответственно 74 и 52 % [Johnston K.W. et al., 1987].
После выполнения чрескожной ангиопластики у 2,3 % больных с критической ишемией наблюдаются различные осложнения. Частота осложнений зависит от локализации и протяженности артериальной окклюзии. При вмешательствах на артериях таза число осложнений составляет 1,9 %, на бедренно-подко-ленном сегменте — 2,7 %, при коротких обструкциях — 2,3 %, при стенозах и окклюзиях протяженностью более 10 см — 6,7 %. Наиболее распространенными осложнениями при чрескожной ангиопластике являются кровотечения и тромбоэмболии [Zeitler E., 1985].
Хорошие результаты дает выполнение аспирационной тромбэктомии, так как при этой процедуре снижается риск механического повреждения артериальной стенки [Guenther R.W., Vorwek D., 1990].
При артериальных тромбозах с успехом применяют регионарный тром-болизис. В зону тромботической окклюзии устанавливают катетер, по которому производят внутриартери-альную инфузию в тромботические массы фибринолитических препаратов. После растворения тромбов при необходимости возможно проведение баллонной вазодилатации [Родионов СВ., 1992; Eikelboom В., 1990].
Несмотря на значительные успехи в развитии эндовазальных методов лечения артериальных обструкций, ведущую роль в лечении критической ишемии конечностей играют реконструктивные сосудистые операции. Это объясняется тем, что больные с критической ишемией имеют, как правило, множественные и протяженные стенозы и окклюзии [Bell P.R.F., 1988].
Стенозы и окклюзии аорты и подвздошных артерий обычно являются
частью многоуровневого поражения артерий при критической ишемии нижних конечностей. Однако выполнения даже одного аортобифемо-рального шунтирования без реконструкции дистального сосудистого русла часто бывает достаточно для спасения конечности при критической ишемии [Bell P.R.F., 1990].
Аортобифеморальное шунтирование, выполненное у больных с критической ишемией, дает хорошие отдаленные результаты. Так, через год после операции у 90 % оперированных больных реокклюзий не наблюдалось, через 5 лет эти показатели составляли от 74 до 90 %, через 10 лет — от 59 до
69 %. Смертность больных, перенес ших аортобифеморальное шунтирова ние в течение 30 дней после опера ции, составляет 4 % [Piotrowski J. et al., 1986]. Пациенты, тяжесть состо яния которых не позволяет выпол нить такую операцию, могут быть оперированы менее травматичным ретроперитонеальным доступом [Johnson J.N. et al, 1986].
После выполнения бедренно-под-коленного шунтирования с наложением дистального анастомоза выше щели коленного сустава реокклюзий не наблюдалось у 75 % больных при использовании в качестве протеза аутовены и у 65 % больных при применении синтетического протеза через 5 лет. В случаях наложения дистального анастомоза ниже коленного сустава эти показатели составили
70 и менее 60 % соответственно [Bell P.R.F., 1990]. Результаты бед- ренно-большеберцовых шунтирова ний хуже, чем бедренно-подколен ных. При выполнении бедренно- большеберцового шунтирования в качестве протеза, если возможно, используют аутовену. При этом реокклюзий в течение года не на блюдалось у 70 % пациентов, при ис пользовании же синтетического про теза они возникли у 40 % больных [Bell P.R.F., 1990]. К сожалению, воз можности реконструктивной хирур гии при критической ишемии значи-
218
тельно ограничены в связи с характерными для этого состояния поражениями дистального сосудистого русла. В таких случаях у части больных возможна операция артери-ализации венозного кровотока стопы [Покровский А.В. и др., 1990]. Эта операция оказывается эффективной более чем у 85 % пациентов, исходно обреченных на первичную ампутацию конечности.
Изолированная поясничная сим-патэктомия не является средством спасения конечности при критической ишемии, но может быть использована для уменьшения боли покоя. У некоторых пациентов с критической ишемией конечности она может привести к потеплению стопы и некоторому субъективному улучшению, хотя и не исключает ампутацию. Для определения показаний к поясничной симпатэктомии у пациентов с критической ишемией конечности необходимо ориентироваться на показатели ишемической пробы — прирост линейной скорости кровотока на 50 % и более по общей бедренной артерии.
В случае невозможности проведения хирургического вмешательства или же в качестве дополнения к нему проводят консервативную терапию, которая включает антикоагулянтную терапию, гипербарическую оксиге-нацию, системный и регионарный тромболизис, гемодилюцию и применение вазоактивных препаратов, включая простаноиды. За рубежом было проведено множество исследований и опубликован ряд работ по использованию таких простаноидов, как Pgl2 и PgEl, для лечения тяжелых форм ишемии конечности. Широкое распространение получил препарат проставазин (вазапростан) фирмы "Шварц Фарма" (Германия), основным действующим компонентом которого является простагландин Е1. Препарат назначают как внутривенно, так и внутриартериально. Для внутривенного введения обычно применяют дозу 60 мкг (3 ампулы)
1 раз в день или по 40 мкг (2 ампулы)
2 раза в день в течение 3—4 нед. Большинство исследователей пришли к выводу, что данный препарат явля ется наиболее мощным фармакологи ческим средством для лечения кри тический ишемии [Покровский А.В. и др., 1992, 1995]. При использова нии вазапростана положительный ре зультат удается получить у 65—75 % больных с критической ишемией.
Для лечения используют также ультрафиолетовое и лазерное внутривенное облучение крови [Петухов Е.Б. и др., 1989; Швальб И.Г. и др., 1990]. При этом отмечается снижение активности перекисного окисления липидов и тромбоцитарной агрегации. А.Е.Барсуков (1989) рекомендует применять комплексные методы лечения — ультрафиолетовое облучение крови, гипербарическую окси-генацию и гемосорбцию.
Использование гипербарической оксигенации при критической ишемии конечностей основано на том, что ингаляции кислорода под давлением 3 атм повышают его содержание в плазме крови. Это приводит к увеличению поступления кислорода в ишемизированные ткани в связи с его легкой диффузией в интерсти-циальную жидкость [Verstraete M., Verhaeghe R., 1990]. Однако убедительных данных, подтверждающих существенный эффект гипербарической оксигенации при лечении больных с критической ишемией, не получено. Кроме того, это лечение часто приводит к еще большему нарастанию ишемии конечности и ухудшению общего состояния больных.
Проведение постоянной эпиду-ральной спинномозговой электростимуляции может уменьшить боль покоя и улучшить микроциркулятор-ный кровоток (рис. 7.23). Имеются сообщения о том, что у 80 % больных, которым проводили эпидураль-ную спинномозговую электростимуляцию, удалось сохранить конечность через 1 год после окончания процедуры, и у 56 % больных — через 2 года [Jacobs M.J. et al, 1990].
219
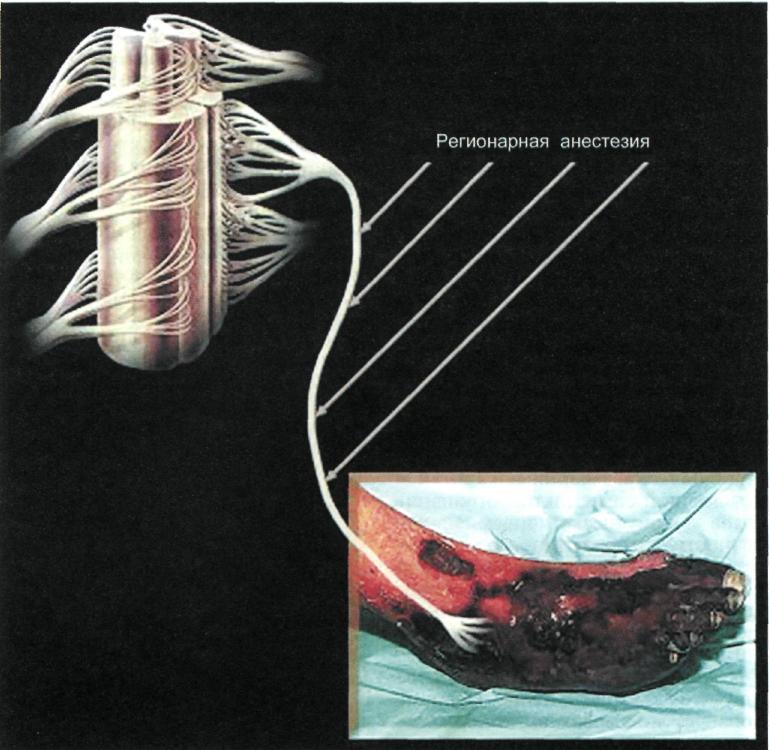
Первичная ампутация конечности при критической ишемии должна выполняться после неудачной попытки консервативной терапии лишь в тех случаях, когда невозможны какие-либо реваскуляризующие операции, а также у больных с обширным некрозом тканей на голени и стопе, когда существует угроза развития тяжелой интоксикации. Могут возникнуть также ситуации, когда необходимо решить вопрос, что лучше — выполнить первичную ампутацию или произвести повторную реконструктивную операцию, имеющую
мало шансов на успех [Harris P.L. et al., 1990].
Пациенты с ампутированной конечностью имеют неблагоприятный прогноз, касающийся как реабилитации, так и выживаемости. Только 70 % культей на уровне ниже коленного сустава заживают первичным натяжением, 15 % — вторичным, и у 15 % больных требуется реампутация выше коленного сустава. Необходимость в ампутации другой конечности возникает в 30 % случаев. Госпитальная смертность при ампутации ниже и выше коленного сустава со-
220
ставляет 8 и 18 % соответственно. Приблизительно 40 % больных умирают в течение 2 последующих лет после ампутации на уровне бедра. Способность к самостоятельному передвижению достигается менее чем у 50 % пациентов после ампутации ниже и у 25 % — выше коленного сустава.
В некоторых случаях первичная ампутация конечности может быть более целесообразной, чем хирургические процедуры с малым шансом на успех. Решать эту трудную задачу должен консилиум специалистов, занимающихся проблемой критической ишемии.
Показания к первичной ампутации конечности при критической ишемии:
▲ неэффективность консерватив ных мероприятий при купировании явлений критической ишемии;
▲ отсутствие возможности проведения ангиопластики и реконструктивной сосудистой операции из-за тяжелого поражения путей оттока;
▲ распространение гангрены на область голеностопного сустава;
▲ тяжелое общее состояние больного, связанное с основным заболеванием и сопутствующей патологией.
Таким образом, первичную ампутацию конечности следует выполнять при невозможности ревас-куляризации и наличии гнойно-некротических изменений конечности. Ампутация конечности должна сопровождаться соответствующей реабилитацией, направленной на поддержание физической активности пациента и социальную адаптацию.
Для лечения критической ишемии нижних конечностей используют как хирургические, так и консервативные методы. Лечение проводят в специализированном стационаре. Диагностические мероприятия должны быть направлены на выявление любой возможности, которая позволила бы выполнить сосудистую реконструктивную операцию; процент ее успеха в спасении конечности приближается к 90, тогда как консервативная терапия оказывается эффективной менее чем у 20 % больных.
Литература
Савельев B.C., Кошкин В.М. Критическая ишемия нижних конечностей. — М.: Медицина, 1997. - 160 с.
Second European Consensus Document on Chronic Critical Leg Ischaemiae // Europ. J. Vase. Surgery. - 1992. - Vol. 6. - Suppl. A.
