
- •7.4. Критическая ишемия нижних конечностей
- •7.5. Артериализация венозного кровотока стопы
- •7.6 Диагностика и лечение пациентов
- •7.6.1. Определение и эпидемиология хронической критической ишемии нижних конечностей
- •7.6.2. Обследование пациентов с критической ишемией нижних конечностей
- •7.6.3. Дифференциальная диагностика критической ишемии нижних конечностей
- •7.6.4. Лечение пациентов
- •7.7. Ишемическая диабетическая стопа
- •III. Смешанная форма (нейроише-мическая).
- •7.7.1. Диабетическая ангиопатия
- •7.8. Аневризмы периферических артерий
- •7.8.1. Классификация
- •7.8.2. Экстракраниальные аневризмы сонных артерий
- •7.8.3. Аневризмы артерий верхних конечностей
- •7.8.4. Аневризмы плечевой артерии и артерий предплечья
- •7.8.5. Аневризмы бедренных артерий
- •7.8.6. Аневризмы подколенной локализации
- •7.8.7. Аневризмы тибиальных артерий
- •7.8.8. Микотические аневризмы
- •7.9. Кистозное поражение адвентиции подколенной артерии
- •7.10. Хроническая ишемия верхних конечностей
- •7.11. Поясничная симпатэктомия
- •7.12. Грудная и поясничная эндоскопическая симпатэктомия
- •7.12.1. Торакоскопическая верхнегрудная симпатэктомия
- •7.12.2. Поясничная эндоскопическая симпатэктомия
- •7.13. Реваскуляризирующая остеотрепанация
- •7.14. Трансплантация большого сальника в лечении дистальных форм поражения артерий голени
- •7.15. Васкулогенная импотенция
- •7.15.1. Клиническая картина и диагностика
- •7.15.2. Лечение васкулогенной эректильной дисфункции
- •7.16. Травматические артериовенозные свищи
- •7.17. Ампутации конечностей при ишемии
7.14. Трансплантация большого сальника в лечении дистальных форм поражения артерий голени
Хирургическое лечение больных с дистальными формами поражения артерий нижних конечностей остается до настоящего времени одной из актуальных проблем ангиологии, что связано как с высоким удельным весом этих больных (18—20 %), так и с ограничением возможностей выполнения прямых реконструкций. Предлагаемые хирургические методики непрямой реваскуляризации по сути остаются поисковыми, а публикуемые результаты лечения весьма противоречивы, однако высокая степень инвалидизации больных и неизбежность ампутации делают оправданными такие методики, как костный "отщеп", остеоперфорация, артериа-лизация вен стопы. Аргумент в пользу этих операций прост: каждая спасенная конечность — победа.
Одним из методов непрямой реваскуляризации является пересадка большого сальника на голень. Эта методика разработана нами в 1981 г., и с тех пор накоплен значительный опыт выполнения данной операции.
Большой сальник привлек наше внимание благодаря его высоким трофическим и пластическим свойствам, известным сравнительно давно и используемым в различных хирургических ситуациях. Диапазон использования большого сальника практически неограничен, и сфера его применения может быть условно обозначена следующим образом:
ограничение воспалительного процесса;
дренажная функция;
создание поверхности, устойчивой к механическим воздействиям;
реваскуляризация ишемизиро-ванных тканей.
Физиология и функция большого сальника долго оставались неясными, и только исследования последних 10—15 лет открыли механизм приоб-
ретения сальником своих особенных свойств, проявляющихся только при его повреждении: пластичности, способности к сращению с травмированной и воспаленной поверхностью, абсорбции жидкости и микрочастиц, способности к фагоцитозу и иммунологическому ответу и, наконец, способности к реваскуляризации ишемизированных тканей.
Сращение сальника с последующей васкуляризацией ишемизиро-ванной ткани происходит в результате повреждения серозного покрова сальника, которое вызывает немедленную экссудацию альбумина, глобулина и фибриногена. Ишемизиро-ванная ткань активирует переход фибриногена в фибрин, образуется фибриновая сеть, и уже через 3 ч сальник слипается с окружающими тканями. За фазой экссудации следуют организация фибриновых сращений, появление в них фибробластов, новообразование и прорастание сосудов, о чем сообщают O.Eliska (1968), W.F.Chen (1978), H.S. Goldsmith (1982). Эти же исследователи доказывают, что даже лишенная кровоснабжения, свободно пересаженная ткань сальника сохраняет эти свойства, но гистиоцитарные процессы и процесс новообразования сосудов протекают не так бурно и несколько растянуты по времени.
Большой сальник является производным дорсального мезогастрия и представляет собой сросшиеся переднюю и заднюю дубликатуры с раздельными системами кровообращения [Bodemer M.E., 1968]. Связь с ними осуществляется через многочисленные анастомозы по нижнему краю сальника, где передняя дубликатура переходит в заднюю. Артерии задней дубликатуры являются ветвями селезеночной артерии и анастомозируют с сосудами поджелудочной железы,
316
брыжейки поперечной ободочной кишки.
Практическую ценность для применения сальника как сосудистого трансплантата представляет передняя дубликатура сальника, наиболее легко мобилизуемая и имеющая большое количество артерий.
С учетом особенностей ангиоархи-тектоники и предполагаемого удлинения большой сальник (точнее его передняя дубликатура) условно разделяют на две зоны. Первая зона — артерии и вены наиболее крупного диаметра, происходящие из правой и левой желудочно-сальниковых артерий и вен и образующие так называемую желудочно-сальниковую аркаду. К ним относятся отходящие от аркады сальниковые артерии и вены (количество их варьирует от двух до семи), а также аркада, соединяющая сальниковые артерии в их средней части. Вторая зона представлена сосудами малого диаметра (артериолы, вену-лы, капилляры), образованными конечными отделами сальниковых сосудов передней и задней дубликату-ры (рис. 7.47).
Уровень наложения микроанастомозов при свободной трансплантации сальника зависит от локализации облитерирующего процесса, и порой возникает необходимость выкраивания сальникового лоскута, равного длине конечности.
При выкраивании лоскута мы придерживались двух основных принципов: 1) сохранение артериального и венозного русла, обеспечивающего циркуляцию крови и жизнеспособность трансплантата; 2) дистальный отдел сальникового лоскута должен иметь максимальную ширину для создания условий максимальной площади контакта с тканями конечности.
Все операции проводят две бригады хирургов под эндотрахеальным наркозом. Задача первой — выделение и выкраивание сальникового лоскута, второй — выделение магистральных сосудов и их ветвей в зоне предполагаемого наложения микроанастомозов.
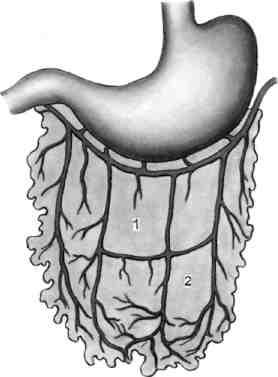
Рис. 7.47. Функциональные зоны (1, 2) сальника.
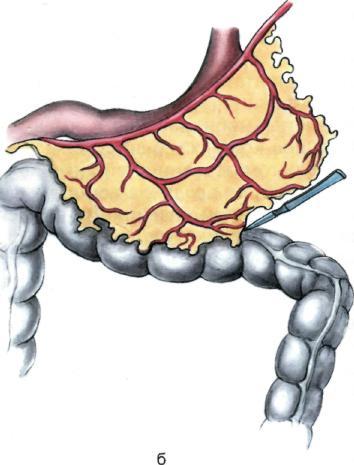
Спайки сальника с внутренними органами аккуратно пересекают, по возможности бескровно. Мобилизацию сальника по большой кривизне желудка начинают слева направо с лигированием и пересечением коротких артерий и вен, идущих от же-лудочно-сальниковой аркады к желудку. Для того чтобы не деформировать аркаду, сосуды лигируют по одному, малыми порциями (рис. 7.48, а).
На следующем этапе производят мобилизацию сальника вдоль поперечной ободочной кишки. Для этого сальник отводят вверх, поперечную ободочную кишку — вниз и острым путем по бессосудистой зоне освобождают сальник от кишки и ее брыжейки (рис. 7.48, б).
Слева на зажимах малыми порциями вдоль левой сальниковой артерии отсекают сальник и формируют лоскут по одной из разработанных методик. Сальник кровоснабжается только посредством левых желудочно-сальниковых артерии и вены. Питающую сальник ножку отсекают только после создания ложа для лоскута и подготовки сосудов на конечности. Для удобства наложения артериального анастомоза желудочно-
317

сальниковую артерию, если позволяет анатомическое строение этой зоны, отсекают с участками а раnсrеа-to-duodenalis с целью формирования
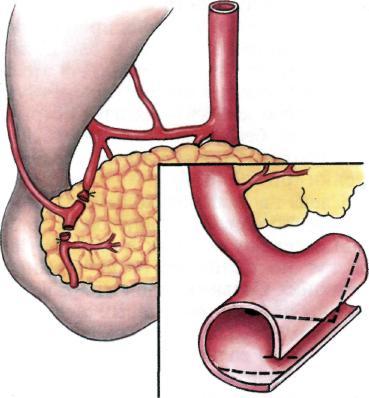
Рис. 7.49. Формирование Т-площадки артериального микроанастомоза.
Т-образной площадки (рис. 7.49). Важный момент операции — перфузия сальникового лоскута раствором гепарина (5000 ЕД на 400 мл изотонического раствора натрия хлорида) до полного вымывания крови из сосудов сальника. Этим предупреждают внутрисосудистое тромбообразо-вание на весь период отключения сальникового лоскута от системы кровообращения.
Микрохирургический этап операции начинают после субфасциально-го размещения сальникового лоскута на голени, максимально низводя его до стопы. Первым необходимо накладывать венозный анастомоз, так как в противном случае возможен перекрут тонкостенного ствола сальниковой вены. Для предотвращения этого выполняют катетеризацию сальниковой артерии и перфузию сальникового лоскута гепаринизированным раствором. При этом сальниковая вена расправляется, хорошо дифференцируются ее просвет и стенка.
Анастомоз накладывают с ветвью
318
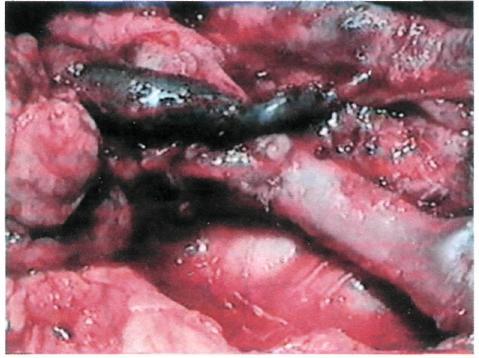
магистральной вены адекватного диаметра по типу конец в конец. Всего для формирования венозного анастомоза требуется наложить 7—8 узловых швов.
Артериальный анастомоз в зависимости от характера анатомического деления артерий панкреатодуоденаль-ной зоны накладывают двумя способами. При первом способе, когда удается выкроить желудочно-сальнико-вую артерию с Т-образной площадкой, производят продольную артерио-томию магистральной артерии длиной 5—6 мм. Далее желудочно-саль-никовую артерию с выкроенной Т-образной площадкой анастомозируют с артерией конечности конец в бок непрерывным либо узловыми швами.
В случаях, когда Т-образную площадку не удается выкроить, желу-дочно-сальниковую артерию отсекают от питающей ножки на 5—6 мм выше ее устья и затем сальниковую артерию анастомозируют с ветвью подходящего диаметра магистральной артерии по типу конец в конец узловыми швами (рис. 7.50).
Предлагаемая методика микрососудистой трансплантации сальника не позволяет, однако реваскуляризо-вать контралатеральную конечность либо использовать ее в случаях облитерации или окклюзии магистральных артерий и их ветвей, когда ис-
ключается возможность применения микрохирургической техники. В связи с этим нами была разработана методика выкраивания и пересадки свободного сальникового лоскута без наложения сосудистых анастомозов. Предпосылкой этой разработки явились собственные клинические наблюдения, когда у 10 больных после выполнения микрососудистой трансплантации сальника в раннем послеоперационном периоде развился тромбоз микроанастомозов. У всех этих больных не только не последовало отторжения сальникового трансплантата, но и в отдаленном периоде наступил регресс исходной ишемии.
Предлагаемая методика позволила использовать сальниковые лоскуты одномоментно на двух конечностях. На одной можно осуществить трансплантацию сальника с наложением микрососудистых анастомозов, а на другой — расположить сальниковый лоскут свободно, без анастомозов. В случаях симметричного поражения артерий нижних конечностей и при отсутствии возможности выполнения микрососудистого этапа выполняли трансплантацию неваскуляри-зованных сальниковых лоскутов на обе конечности. Данный вид операции мы обозначили как свободную пересадку сальника.
Проведенные нами дополнитель-
319
ные морфологические исследования биопсийного материала, взятого у пациентов этой группы, а также анализ зарубежного опыта трансплантации неваскуляризованного сальника показали, что в свободно перемещенном сальниковом лоскуте происходят те же морфологические и гистиоцитарные процессы, что и в лоскуте с восстановленным кровообращением. Отличие заключается в более продолжительном времени ангиогенеза (табл. 7.15).
Методика аутотрансплантации свободного неваскуляризованного саль-
никового лоскута проще, чем микрохирургическая, и не требует специальных навыков микрохирургии. Операция двухэтапна — лапарото-мия и забор сальника, затем трансплантация сальникового лоскута на конечность.
Выкраивание сальникового лоскута произвольное, поскольку нет необходимости в сохранении сосудистого русла выкроенного лоскута. Главное — его достаточная длина и максимальная площадь контакта с реципиентными тканями.
320
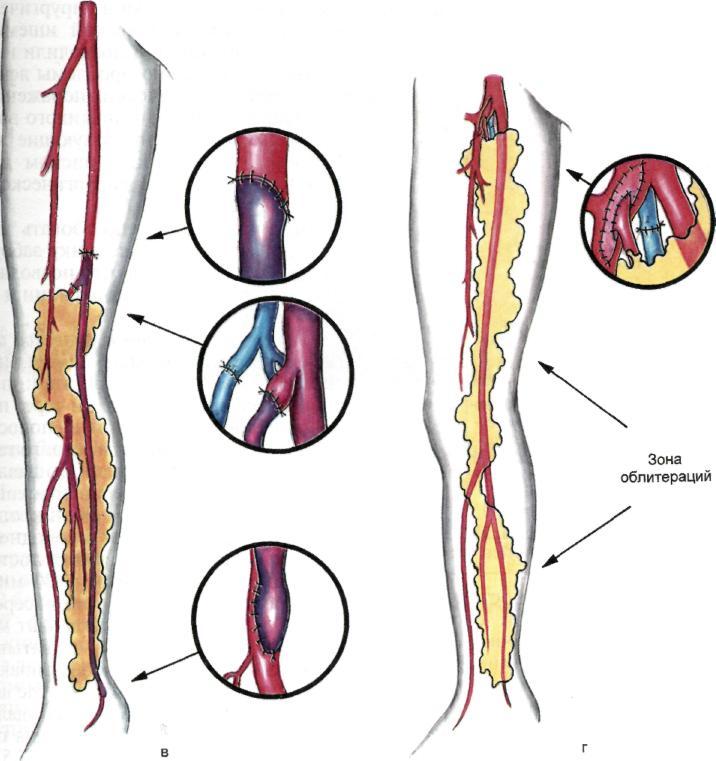
Рис. 7.51. Продолжение.
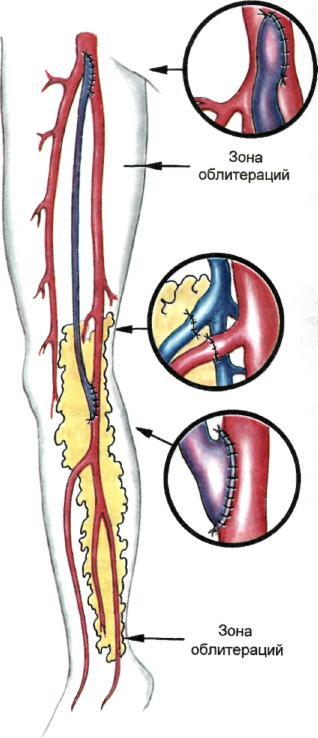
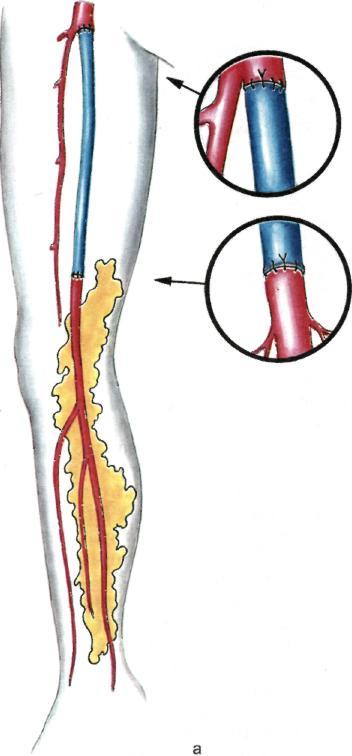
В случаях, когда предполагается ванного выкраивания сальниковых
комбинированное использование лоскутов позволила нам применить
сальниковых лоскутов (симметрич- методику трансплантации сальнико-
ное поражение артерий обеих ниж- вых лоскутов у больных с сочетан-
них конечностей), лоскут для микро- ными формами поражения артерий
сосудистой трансплантации выкраи- нижних конечностей одновременно с
вают вдоль желудочно-сальниковой такими традиционными реконструк-
аркады, левых сальниковых артерий циями, как бедренно-подколенное,
и сосудов свободного края большого бедренно-тибиальное шунтирование,
сальника, а лоскут для свободной пе- коррекция глубокой артерии бедра,
ресадки формируют из оставшейся баллонная ангиопластика магист-
части большого сальника, образо- ральных артерий (рис. 7.51, а—г),
ванной зонами бассейнов средней и В этих случаях трансплантирован-
правых сальниковых артерий. ный сальник способствовал не толь-
Разработанная техника комбиниро- ко улучшению трофики ишемизиро-
321
21 -4886
Таблица 7.15. Сравнительная динамика морфологических изменений на границе сальник—ткань реципиентной области

ванных тканей конечности, но и за счет новообразованной сосудистой сети приводил к снижению периферического сопротивления, увеличивая сроки функционирования шунта либо зоны ангиопластики.
Обнадеживающие результаты использования свободного неваскуля-
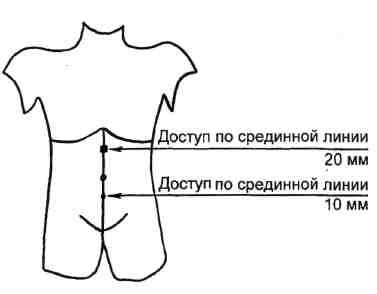
Рис. 7.52. Расположение троакаров при заборе сальника.
ризованного сальника в хирургическом лечении хронической ишемии нижних конечностей позволили нам подойти к решению проблемы лечения атеросклеротических поражений артерий голени у лиц пожилого возраста, имеющих сопутствующие заболевания, с высоким риском для жизни стандартного хирургического вмешательства.
Мы предлагаем использовать видеоэндоскопическую технику забора сальникового лоскута, что позволяет резко сократить время операции и ее травматичность.
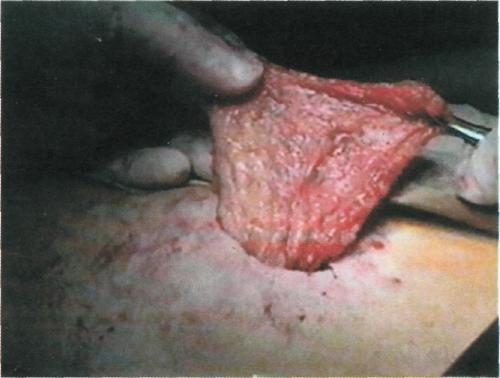
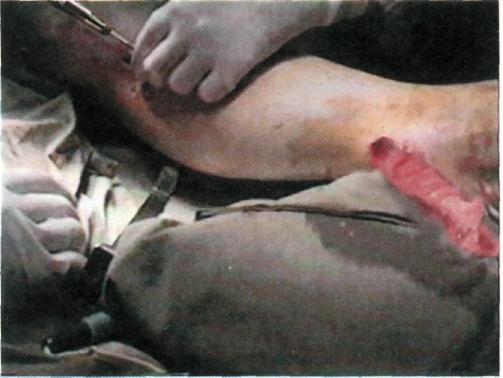
Методика видеоэндоскопической ас-систированной операции имеет несколько этапов. Первый этап: под эндотрахеальным наркозом через пупочный доступ в брюшную полость после инсуффляции углекислого газа до создания внутрибрюшного давления 15 мм рт.ст. вводят лапароскоп с камерой. Осматривают сальник, оценивают размеры его свободного края, после чего через второй доступ в брюшную полость вводят 20-миллиметровый троакар с редюссером (рис. 7.52). Через троакар вводят ма-нипуляционные щипцы, захватывают и выводят наружу через троакар свободный край сальника. После выведения части сальника троакар удаляют, сальник свободно выводят на переднюю брюшную стенку (рис. 7.53), после чего по частям на зажимах отсекают и лигируют. Площадь резецированного сальника при этом достигает 25—35 см2, что достаточно для трансплантации на голень.
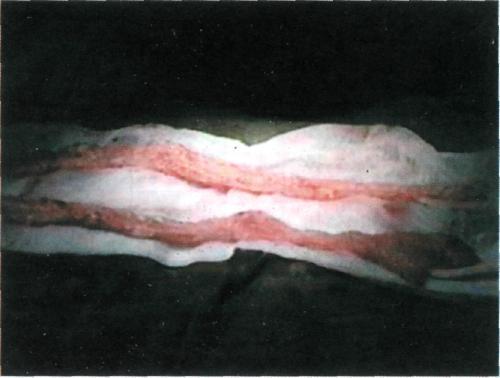
На втором этапе выкроенный сальник расщепляют на два или более равноценных по длине (40—45 см) сальниковых лоскута (рис. 7.54). Сальниковые лоскуты укладывают субфасциально с помощью металлического проводника через два кожных доступа в верхней и нижней третях голени (рис. 7.55). При этом соблюдается одно из условий трансплантации сальника — создание шунта между бассейнами функционирующих магистральных артерий нижней
322
трети бедра и сосудами ишемизиро-ванной голени.
Безусловный интерес с учетом длительности наблюдения представляют результаты описанных нами оперативных вмешательств, выполненных за период с 1981 по 1999 г. у 102 больных с дистальной и сочетай-ной формами поражения артерий нижних конечностей. У 70 больных был диагностирован облитерирующий тромбангиит (1-я группа) и у 32 — облитерирующий атеросклероз (2-я группа). Распределение больных по
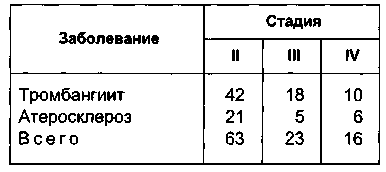
стадиям заболевания представлено в табл. 7.16.
Таблица 7.16. Распределение больных по стадиям заболевания
21'
323
Методы хирургических вмешательств на оперированных конечностях представлены в табл. 7.17, причем в нее вошли 14 больных, которым сальник был одномоментно трансплантирован на обе конечности.
В раннем послеоперационном периоде отмечены следующие осложнения: тромбоз микроанастомозов — 10 больных (все в 1-й группе); олео-некроз — 8 (5 — в 1-й и 3 — во 2-й группе); лимфорея — 6 (по 3 в каждой группе); прогрессирование ишемии конечности, приведшей к ампутации, — 6 больных (4 — в 1-й и 2 — во 2-й группе). Все больные, которым в раннем послеоперационном
Таблица 7.17. Методы хирургических вмешательств
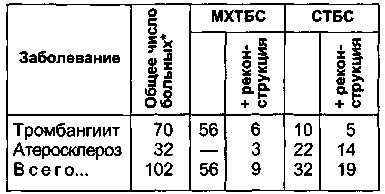
* Общее число больных меньше, чем число выполненных операций.
Условные обозначения: МХТБС — микрохирургическая трансплантация большого сальника; СТБС — свободная трансплантация большого сальника.
периоде была выполнена ампутация, имели исходно IV стадию заболевания, 4 больным выполнена микрососудистая трансплантация, 1 больному — микрососудистая трансплантация с реконструкцией глубокой бедренной артерии, 1 больному — свободное перемещение сальника.
Отдаленные результаты изучены в сроки от 3 мес до 17 лет. В 1-й группе (больные с тромбангиитом) прослежены 66 больных, которым было выполнено 58 операций микрососудистой трансплантации, причем хорошие результаты (сохранение конечности, снижение симптомов ишемии) отмечены у 55 больных; в 3 случаях произведена ампутация конечности. Свободная трансплантация сальникового лоскута выполнена у 15 больных: хороший результат получен в 13 случаях, ампутация произведена у 2 больных.
Во 2-й группе прослежены 30 пациентов, которым было выполнено 37 трансплантаций сальника. В 1 случае микрососудистая трансплантация с реконструкцией закончилась ампутацией, другая привела к регрессу ишемии конечности. У остальных 35 больных произведено перемещение свободного лоскута, из них у 14 — с прямой реконструкцией (аортоглубокобедренное бифуркационное шунтирование — у 2, профун-
324
х>
допластика — у 5, бедренно-подколенное шунтирование — у 6, бедрен-но-тибиальное шунтирование — у 1 больного); у 2 пациентов — баллонная ангиопластика подвздошно-бед-ренного сегмента и у 2 — баллонная ангиопластика бедренно-подколен-ного сегмента. Хороший результат получен при выполнении 32 трансплантаций, а у 3 больных произведена ампутация конечности.
Во всех случаях в 1 -й и 2-й группах ампутация конечности явилась следствием прогрессирования окклюзион-ного процесса аортоподвздошного сегмента или глубокой бедренной артерии, когда происходило выключение притока крови к сальниковому лоскуту. В целом эффективность операции трансплантации сальника в различных ее модификациях составила 86 %.
Противопоказаниями к операции являются тяжелое соматическое состояние больного, наличие обширных некрозов конечности, особенно
в сочетании с отеками голени и стопы. Однако трансплантация сальника в сочетании с прямыми реконструкциями в аортоподвздошной и бедренно-подколенной зоне позволяет сузить круг противопоказаний у части больных с тяжелой ишемией конечностей.
Таким образом, трансплантация большого сальника — это один из нетрадиционных методов реконструкции, который применяют тогда, когда невозможны либо исчерпаны методы прямой реваскуляризации и неизбежна ампутация конечности. Необоснованное расширение показаний к использованию большого сальника при обширных некрозах всегда приводит к ампутации и создает негативное отношение к использованию описанной методики.
При соблюдении обозначенных условий использования трансплантации сальника эта операция может занять достойное место в арсенале методов реваскуляризации голени.
