
- •7.4. Критическая ишемия нижних конечностей
- •7.5. Артериализация венозного кровотока стопы
- •7.6 Диагностика и лечение пациентов
- •7.6.1. Определение и эпидемиология хронической критической ишемии нижних конечностей
- •7.6.2. Обследование пациентов с критической ишемией нижних конечностей
- •7.6.3. Дифференциальная диагностика критической ишемии нижних конечностей
- •7.6.4. Лечение пациентов
- •7.7. Ишемическая диабетическая стопа
- •III. Смешанная форма (нейроише-мическая).
- •7.7.1. Диабетическая ангиопатия
- •7.8. Аневризмы периферических артерий
- •7.8.1. Классификация
- •7.8.2. Экстракраниальные аневризмы сонных артерий
- •7.8.3. Аневризмы артерий верхних конечностей
- •7.8.4. Аневризмы плечевой артерии и артерий предплечья
- •7.8.5. Аневризмы бедренных артерий
- •7.8.6. Аневризмы подколенной локализации
- •7.8.7. Аневризмы тибиальных артерий
- •7.8.8. Микотические аневризмы
- •7.9. Кистозное поражение адвентиции подколенной артерии
- •7.10. Хроническая ишемия верхних конечностей
- •7.11. Поясничная симпатэктомия
- •7.12. Грудная и поясничная эндоскопическая симпатэктомия
- •7.12.1. Торакоскопическая верхнегрудная симпатэктомия
- •7.12.2. Поясничная эндоскопическая симпатэктомия
- •7.13. Реваскуляризирующая остеотрепанация
- •7.14. Трансплантация большого сальника в лечении дистальных форм поражения артерий голени
- •7.15. Васкулогенная импотенция
- •7.15.1. Клиническая картина и диагностика
- •7.15.2. Лечение васкулогенной эректильной дисфункции
- •7.16. Травматические артериовенозные свищи
- •7.17. Ампутации конечностей при ишемии
III. Смешанная форма (нейроише-мическая).
Эта классификация отражает основные патогенетические механиз-
251
мы развития синдрома диабетической стопы, помогает оценить преимущественное влияние одного из них и в соответствии с этим назначить адекватное лечение в максимально ранние сроки.
7.7.1. Диабетическая ангиопатия
Диабетическая ангиопатия морфологически делится на макроангиопа-тию (артерии и артериолы) и микро-ангиопатию (капилляры); роль каждого из заинтересованных компонентов является предметом дискуссий уже не первый год. Некроз кожи обусловлен изменениями в микроцир-куляторном русле, хотя проведение реконструктивной коррекции артериального кровотока приводит к активизации процессов заживления мягких тканей и восстановлению дефектов кожи. Таким образом, наличие или отсутствие макроангиопатии является определяющим в клиническом исходе, несмотря на наличие микроангиопатии. В ряде случаев гангрена развивается при сохраненной пульсации артерий стопы, когда преимущественной причиной гангрены служат нейропатия и микроан-гиопатия.
LoGerfo и Coffman (1984) в обзоре по диабетической микро- и макроангиопатии опровергают широко распространенную точку зрения, согласно которой "у больных диабетом прежде всего имеются облитерирую-щие поражения артериол, приводящие к ишемическому некрозу мягких тканей при нормальной пульсации артерий стоп". Главными аргументами авторов являются:
• отсутствие специфических пато-морфологических признаков атеро-склеротического поражения у лиц, страдающих сахарным диабетом, по сравнению с патологоанатомическим материалом, полученным у больных облитерирующим атеросклерозом артерий нижних конечностей без диабета (окклюзии артериол наблюдались и у лиц без диабета);
• равная степень выраженности сопротивления дистальных сосудов у больных, перенесших бедренно-подколенное шунтирование, как страдающих диабетом, так и без диабета. Вместе с этим у пациентов с диабетом выявлено утолщение ба-зальной мембраны капилляров мышечной ткани (но не кожи). Данные капилляроскопии свидетельствуют, что у больных диабетом имеются значительные морфологические изменения: извитость капилляров, их закупорка и/или дилатация, однако прямые подтверждения влияния всех этих изменений на состояние микроциркуляции отсутствуют.
При сахарном диабете имеются функциональные расстройства мик-роциркуляторного русла, но они обратимы в ранние сроки от момента развития заболевания и необратимы при длительном его течении. Эти изменения включают повышение проницаемости сосудистой стенки, нарушение реактивности, нарушение ауторегуляторной функции. Однако микроангиопатия сама по себе не может стать причиной образования язвенного дефекта стопы. Формирование изменений, приводящих к образованию язв и некрозу мягких тканей, обусловливается нарушением макроциркуляции. Микроциркуля-торные нарушения в свою очередь являются следствием сочетанного воздействия микро- и/или макроангиопатии.
Морфологически атеросклероти-ческие изменения сосудистой системы у больных диабетом и у лиц без диабета одинаковы, однако при сахарном диабете имеется ряд особенностей, которые необходимо учитывать (табл. 7.11).
Факторы риска развития диабетической макроангиипатии те же, что и при атеросклерозе, хотя очень важное значение придается длительности и тяжести течения сахарного диабета (особенно при инсулинзависи-мом диабете).
252
Таблица 7.11. Различия атеросклеротического поражения сосудов нижних конечностей у пациентов с сахарным диабетом и у лиц без диабета
Пациенты с нейропатическим поражением стопы должны быть четко дифференцированы от больных с не-рвно-ишемическим поражением, так как ведение этих больных принципиально различно. Большинство нейро-патических язв может быть излечено с помощью специфического лечения инфекции, покоя и использования специальных шин или обуви. У больных с нейропатической язвой пульсация на артериях стопы сохранена, первой (раньше глубокой чувствительности) исчезает поверхностная чувствительность; результаты исследований регионарной гемодинамики свидетельствуют об увеличении общего притока крови к стопе.
У больных с ишемической диабе-
тической стопой пульсация сосудов на стопе отсутствует, первой снижается глубокая чувствительность.
Вопросы диагностики, показаний к различным видам лечения, а также основные принципы лечения ишемической диабетической стопы рассмотрены далее.
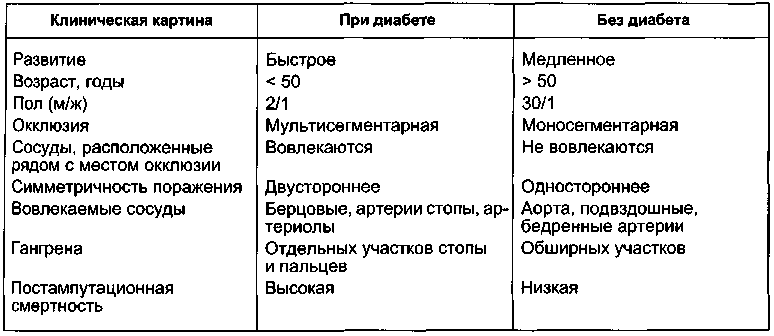
Клиническая картина. Причиной обращения больного с сахарным диабетом к сосудистому хирургу является неэффективность консервативного лечения язвенно-некротических поражений на стопе. Расспрашивая больного, в первую очередь следует установить, имеется ли (или была ли) боль в ногах при ходьбе. При выяснении анамнеза, как правило, больные отмечают, что на протяжении продолжительного времени страдали "низкой" перемежающейся хромотой. Поражение магистральных артерий нижних конечностей при диабете очень часто приводит к явлениям критической ишемии, которые характеризуются болями в покое и язвенно-некротическими поражениями (рис. 7.30), что соответствует III и IV степени нарушения кровообращения конечности по классификации Покровского — Фонтейна, хотя для больных диабетом клиническая картина этих стадий заболевания несколько изменяется. Наличие со-
253
путствующей диабетической нейро-патии снижает болевую чувствительность. Ранние признаки критической ишемии отсутствуют, поэтому первичное обращение пациентов, как правило, происходит уже при наличии язвенно-некротических поражений.
При клиническом осмотре больного с ишемической диабетической стопой обращают внимание на дистрофические изменения кожи дис-тальных отделов конечности (выпадение волос, признаки гиперкератоза и разрастания ногтевых пластинок), изменение окраски кожных покровов — бледность, цианоз. При пальпации отмечается снижение температуры кожных покровов пораженной конечности по сравнению с непораженной. Определяют и сравнивают пульсацию артерий на симметричных уровнях конечностей.
При поражении магистральных артерий нижних конечностей у больных с диабетом часто имеется поражение других сосудистых бассейнов: коронарных и брахиоцефальных артерий. В ряде случаев поражения указанных бассейнов может и не быть, поэтому при физикальном обследовании пациентов с диабетом важно придерживаться стандартного комплекса обследования сосудистого больного. Необходимо определять пульсацию на всех магистральных артериях. У больного диабетом сле-
дует прощупать пульс и выслушать шум над бедренной артерией в паховом сгибе, а также выполнить аус-культацию в стандартных точках для выслушивания магистральных артерий, в том числе и сосудов шеи.
Инструментальная диагностика. Диагностику у больных с ишемической диабетической стопой проводят в двух направлениях. В первую группу включены методы исследований, направленные на оценку общего состояния больного сахарным диабетом. Это прежде всего оценка тяжести диабета и характера патологических изменений сердца и почек.
Инструментальные методы исследования делят на амбулаторные и стационарные. На амбулаторном уровне выполняют указанные ниже исследования:
• биохимический анализ крови, в котором очень важны следующие показатели: сахар; суточный про филь сахара; мочевина; креатинин;
. ЭКГ;
рентгенографию пораженной стопы в двух проекциях;
посев с гнойно-некротической поверхности стопы для определения микрофлоры и ее чувствительности к антибактериальным препаратам;
измерение сегментарного артериального давления на стандартных уровнях нижних конечностей со спектральным анализом допплеровского сигнала.
254
При поступлении больного в специализированный стационар выполняют:
биохимический анализ крови, помимо перечисленных выше: про-тромбиновое время; фибриноген; тромбоциты крови; электролиты;
ЭКГ с нагрузочными тестами;
▲ЧПЭС (чреспищеводная электростимуляция сердца), направленную на выявление скрытой коронарной недостаточности с определением коронарного резерва;
▲ рентгенографию грудной клетки;
▲ рентгенографию пораженной сто пы в двух проекциях;
▲ посев с гнойно-некротической поверхности стопы для определения микрофлоры и ее чувствительности к антибактериальным препаратам.
Эти методы направлены на уточнение степени тяжести сахарного диабета, установление скрытой или определение тяжести уже существующей коронарной и/или почечной недостаточности. При выявлении данных о патологических изменениях необходима корригирующая терапия.
Вторую группу исследований составляют методы, оценивающие степень изменения сосудистого русла пораженной конечности и определяющие возможность выполнения реконструктивной операции с целью сохранения конечности. При поражении других сосудистых бассейнов тактика зависит от клинической картины и значимости пораженного бассейна или органа.
Специальные методы исследования направлены на выявление поражений артерий нижних конечностей и решение вопроса о возможной реконструкции, а также на исследование других сосудистых бассейнов при наличии клинических показаний.
Исследования, выполняемые с целью выявления макроизменений сосудистого русла:
• измерение артериального давления в пальцах стопы (существенный показатель макрогемодинамики при
выраженном кальцинозе берцовых артерий);
измерение сегментарного артериального давления на стандартных уровнях нижних конечностей с определением ЛПИ (не всегда информативен из-за кальциноза берцовых артерий);
спектральный анализ доппле-ровского сигнала с магистральных артерий пораженной конечности;
определение линейной скорости кровотока по магистральным артериям как пораженной, так и контра-латеральной конечности;
рентгеноконтрастная ангиография с обязательным контрастированием дистального артериального русла нижних конечностей с фармакологической пробой;
дуплексное сканирование бифуркаций общих сонных артерий (частое сочетанное поражение при отсутствии клинических проявлений).
Для оценки изменений микрогемодинамики нижней конечности используют следующие методы:
а транскутанное определение напряжения кислорода на стопе в первом межпальцевом промежутке в положении больного сидя и лежа (важными являются значение базального уровня кислорода и его ортостати-ческий прирост);
а компьютерную видеокапилляроскопию;
а лазерную допплеровскую флоу-метрию.
Все исследования проводят на фоне консервативной терапии. Если возможно консервативное лечение диабетических больных, ангиография может быть отсрочена на 2—4 нед. За это время нейропатические язвы у диабетических больных могут быть излечены консервативными методами. У больных сахарным диабетом часто имеются почечные расстройства, поэтому назначение ангиографии должно быть осторожным.
Ангиографию выполняют у больных диабетом даже при наличии клиники нейропатических поражений,
255
если нет улучшения после 2 нед консервативного медикаментозного лечения. Консервативное лечение ней-ропатических язв дает хорошие результаты в 90 % случаев.
Консервативное лечение ишеми-ческой диабетической стопы должно решать несколько задач:
компенсация сахарного диабета — обязательная нормализация углеводного обмена со снижением уровня гликемии и устранением метаболических расстройств;
купирование явлений критической ишемии стопы;
улучшение микроциркуляции в пораженной конечности;
лечение инфекционных осложнений — определение вида и чувствительности флоры к антибактериальным препаратам.
В большинстве случаев у пациентов с язвенными поражениями стоп отмечается выраженная гипергликемия. Для обеспечения условий, благоприятствующих заживлению, при инсулинзависимом сахарном диабете проводят интенсификацию режима инсулинотерапии. Потребность организма в инсулине может значительно возрастать из-за наличия ин-фекционно-воспалительного процесса и высокой температуры тела — следовательно, требуется соответствующее повышение дозы вводимого инсулина. Ориентиром оптимального количества препарата является не показатель соотношения дозы инсулина к массе тела пациента, а показатель гликемии.
Очень часто синдром диабетической стопы развивается у больных с инсулиннезависимым диабетом на фоне декомпенсации заболевания, не поддающегося коррекции, несмотря на диетотерапию и лечение пероральными сахаропонижающими препаратами. Таких больных при наличии незаживающих нейропатичес-ких язв или выраженного болевого синдрома рекомендуется переводить на инсулинотерапию. При этом назначение инсулина позволяет норма-
лизовать гипергликемию. Таким образом, всех больных с ишемической диабетической стопой в условиях критической ишемии необходимо переводить на терапию инсулином под постоянным контролем суточного уровня сахара крови.
Медикаментозная терапия, направленная на улучшение макро- и микрогемодинамики пораженной конечности, иногда купирует явления критической ишемии без оперативного вмешательства. Поэтому больным с критической ишемией стопы на фоне сахарного диабета при поступлении в стационар независимо от дальнейшей тактики лечения, которая определяется в процессе комплексного обследования, проводят стандартную консервативную терапию — комбинацию реологических растворов (реополиглюкин, реомакродекс — не на глюкозе) с дезагрегантами (ку-рантил, трентал). Курс лечения 7— 10 дней. С учетом часто встречающейся сопутствующей сердечной патологии объем инфузии должен быть 200—250 мл; введение растворов медленное, возможно применение диуретиков.
При клиническом улучшении, проявляющемся в купировании болевого синдрома и улучшении местного статуса язвы (появление активных грануляций и краевой эпителиза-ции), можно продолжить стандартную консервативную терапию еще в течение 7—10 дней с последующим переходом на таблетированные препараты.
В качестве лечения больных с ишемической диабетической стопой наиболее эффективно внутривенное введение простагландина Е1 (ваза-простан, производство фирмы "Schwarz-pharma", Германия). Препарат вводят в дозе 60 мг/сут в 250 мл изотонического раствора натрия хлорида; инфузия длится 2—3 ч. Курс лечения 10—14 дней. Около 60 % больных отмечают выраженное клиническое улучшение. При необходимости курс терапии вазапростаном
256
можно продолжить до 28 дней, до полной ликвидации явлений критической ишемии. Если же явления критической ишемии купированы первичным курсом, больного переводят на стандартную дезагрегант-ную терапию.
Показания к более длительной ин-фузии вазапростана (до 30—40 дней) часто возникают у больных с диабетической стопой на фоне тотальной окклюзии артерии голени и стопы, когда нет возможности выполнить стандартную реконструктивную операцию на магистральных артериях конечности. Поэтому становится ясной диагностическая ценность препарата при решении вопроса о спасении конечности от ампутации. Ва-запростан занял свое ведущее место в комплексной терапии больных с диабетической стопой на фоне поражения магистральных артерий нижних конечностей.
Больных, у которых консервативные мероприятия не купировали явления критической ишемии, но существует возможность реконструктивной сосудистой операции, оперируют в плановом порядке.
Определение вида и чувствительности к антибиотикам микрофлоры с поверхности язвы очень важно для подготовки к предстоящей "чистой" реконструктивной сосудистой операции. При выраженности гнойно-воспалительных явлений на стопе антибиотикотерапию начинают в до-операционном периоде.
Оперативное лечение. Показания к оперативному лечению:
неэффективность консервативной терапии, сохранение или про-грессирование критической ишемии;
возможность выполнения реконструктивной сосудистой операции по состоянию сосудов.
Противопоказания:
острый инфаркт миокарда или острое нарушение мозгового кровообращения в предшествующие 3 мес;
недостаточность кровообращения конечности III—IV степени.
Ни возраст больного, ни наличие сопутствующих заболеваний сами по себе не являются противопоказаниями к реконструктивной сосудистой операции.
При наличии у больного стеноза подвздошных артерий предпочтение отдают транслюминальной ангиопластике. Противопоказанием является выраженный кальциноз в месте стеноза. Транслюминальная ангиопластика эффективна в 95 % случаев при коротких стенозах в подвздошной позиции. Трехлетняя проходимость дилатированного сегмента в этой позиции составляет 85 %. Возможна дилатация артерий бедренно-подколенного сегмента, при этом результат трехлетней проходимости несколько хуже (60 %), чем аутовеноз-ного шунтирования в бедренно-под-коленной позиции (ниже щели коленного сустава — 70 %). Транслюминальная ангиопластика менее травматична, чем реконструктивная сосудистая операция, поэтому при соответствующих показаниях и возможностях транслюминальная ангиопластика является операцией выбора (рис. 7.31).
При наличии пролонгированных стенозов или же окклюзии и сохраненных путях оттока выполняют стандартные шунтирующие операции.
Реконструктивные сосудистые операции. Анестезиологическое обеспечение. Оперативное вмешательство у больных с поражением магистральных артерий нижних конечностей на фоне сахарного диабета лучше выполнять под эпидуральным обезболиванием.
При шунтирующей операции необходимо правильно выбрать место для наложения проксимального анастомоза, т.е. оценить пути притока. Немаловажное значение имеет также правильный выбор места для дистального анастомоза с оценкой дистального артериального русла — путей оттока.
17-4886
257
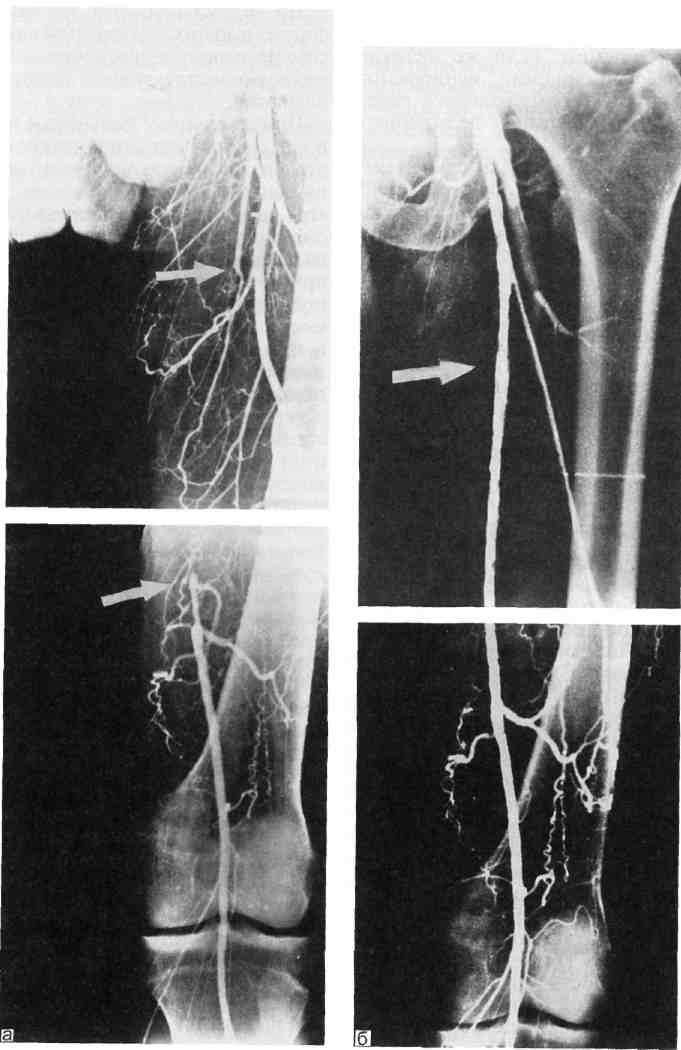
Рис. 7.31. Окклюзия поверхностной бедренной артерии (а) и восстановление ее проходимости после транслюминальной ангиопластики (б).
258
При аортобедренных реконструкциях проксимальный анастомоз накладывают с аортой на уровне отхож-дения нижней брыжеечной артерии, так как отдел аорты на уровне бифуркации чаще подвержен атеро-склеротическим изменениям.
При бедренно-подколенных реконструкциях проксимальный анастомоз формируют с общей бедренной артерией: при сохраненной проходимости начального отдела поверхностной бедренной артерии — по типу конец в бок, а при окклюзии поверхностной бедренной артерии ее резецируют в устье, при этом формируют косой длинный анастомоз по типу конец в конец, применяя непрерывный обвивной шов монофиламент-ной нитью 5/0.
При подколенно- берцовых и под-коленно-стопных реконструкциях проксимальный анастомоз формируется по типу конец в бок трансплантата с подколенной артерией непрерывным обвивным швом монофила-ментной нитью 6/0.
Если на голени сохранены две или три артерии, то выполняют стандартное бедренно-подколенное шунтирование. При сохранной одной боль-шеберцовой артерии ориентируются на проходимость плантарной дуги — при ее окклюзии необходимо выполнение разгрузочной артериовенозной фистулы, сформированной на уровне медиальной лодыжки с одной из глубоких вен по типу бок в бок. При сохранении на голени одной берцовой артерии в качестве пластического материала необходимо использовать аутовену по методике in situ. Все дистальные анастомозы формируются непрерывным обвивным швом монофиламентной нитью 6/0.
Выбор и использование трансплантата для шунтирующей операции имеют важное значение для реконструкции в бедренно-подколенно-бер-цовой зоне. Бесспорно, лучшим пластическим материалом является ауто-вена, хотя от методики ее использования зависит отдаленная проходи-
мость. Так, при бедренно-берцовых, бедренно-стопных и подколенно-стопных реконструкциях предпочтение отдают использованию аутовены по методике in situ. Использование реверсированной аутовены оправдано при бедренно-подколенных реконструкциях выше и ниже щели коленного сустава, хотя при поражении артерий голени при бедренно-подко-ленном шунтировании ниже щели коленного сустава использование аутовены по методике in situ более оправдано. При бедренно-подколен-ном шунтировании выше щели коленного сустава можно использовать синтетический протез, учитывая небольшую протяженность трансплантата и диаметр 7—8 мм, необходимый для этой позиции.
При невозможности использовать аутовену альтернативной заменой является протез из политетрафторэтилена (ПТФЭ). Так, в бедренно-подколенной позиции выше щели коленного сустава используют протез диаметром 7—8 мм, в бедренно-подколенной позиции ниже щели коленного сустава 6—8 мм, при бед-ренно-берцовой реконструкции — 5—7 мм и при подколенно-берцовых и подколенно-стопных реконструкциях — 5 мм. Если на голени поражена одна из болынеберцовых артерий, при использовании протеза желательно сформировать артериове-нозную фистулу по типу бок в бок на уровне лодыжки.
При выраженном поражении дис-тального артериального русла, когда невозможно выполнить реконструкцию на подколенной или берцовых артериях, необходимо оценить состояние глубокой артерии бедра (дуплексное сканирование или рент-геноконтрастная ангиография). При ее стенотическом поражении выполняют эндартерэктомию с пластикой артерии, в качестве пластического материала используют аутовену, ау-тоартерию, биозаплаты и заплаты из ПТФЭ. При окклюзии проксимального отдела глубокой артерии бедра с
17*
259
сохранным дистальным руслом выполняют либо резекцию окклюзиро-ванного участка с последующим протезированием, либо шунтирование в проходимый сегмент артерии.
Но бывают ситуации, когда любые реконструкции невозможны из-за отсутствия путей оттока, при этом необходимо решить вопрос о выполнении поясничной симпатэктомии, для чего следует провести пробу с реактивной гиперемией пораженной конечности. При приросте линейной скорости кровотока при допплеровс-ком исследовании на 50 % и более по общей бедренной артерии выполнение поясничной симпатэктомии обосновано. Если показатели ниже, то поясничная симпатэктомия противопоказана, так как может усугубить тяжесть критической ишемии.
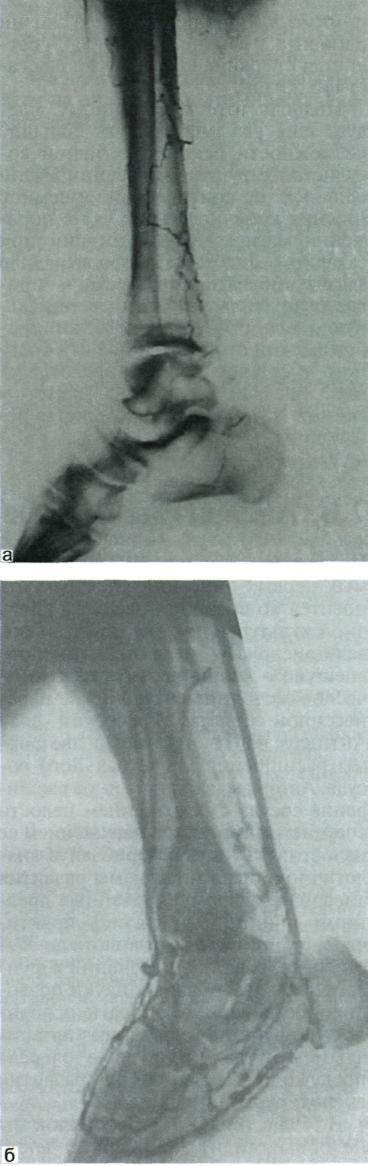
При неэффективности всех вышеперечисленных процедур у больных с тяжелым поражением артерий голени и стопы для спасения конечности от ампутации показано выполнение артериализации и реверсии венозного кровотока стопы (рис. 7.32).
Особенности интраоперационного ведения:
коррекция сахара введением инсулина под контролем показаний сахара крови;
применение жидких нитратов (перлинганит, изокет);
поддержание правильного (соотношение кристаллоидных и коллоидных препаратов) инфузионного баланса из расчета 600—800 мл/ч при стабильном течении анестезии и стабильном состоянии больного, оценка адекватности диуреза, кро-вопотери, состояния свертывающей системы крови, длительности пережатия магистральных сосудов;
поддержание максимальной концентрации антибиотика широкого спектра действия неоднократными введениями на протяжении всей операции.
Ранний послеоперационный период. Послеоперационное ведение больных направлено на сохранение ста-
бильного течения сахарного диабета, на профилактику ранних тромбозов, инфекции и обострения сопутствующих заболеваний:
▲ в раннем послеоперационном периоде — коррекция сахара крови инсулином;
▲ назначение реологических растворов до 5—7 дней (реополиглюкин, реомакродекс на изотоническом растворе натрия хлорида);
▲ при стандартных операциях гепарин не используют, однако больным после реконструктивной операции ниже щели коленного сустава при плохих путях оттока показана внутривенная инфузия гепарина через инфузомат в течение 3—5 дней под контролем времени свертывания, доводя его до 14—18 мин, с последующим переходом на подкожное введение гепарина сроком до 10 дней;
▲ поддержание стабильного кардиологического статуса (бета-блока-торы, жидкие нитраты — до 5 дней);
▲ профилактика возможных почечных осложнений (небольшой объем инфузионной терапии, уросептики) с обязательным контролем суточного диуреза;
▲ антибактериальная терапия с учетом чувствительности флоры (исключая нефротоксичные препараты);
▲ местное лечение язвенно-некротических повреждений стопы мазями на водорастворимой основе (левосин, левомеколь, диоксидиновая мазь).
В послеоперационном периоде выполняют контроль за изменением показателей макрогемодинамики (определение ЛПИ в динамике, дуплексное сканирование анастомозов и трансплантата) и микроциркуляции (определение транскутанного напряжения кислорода на стопе — ТсР02). При возрастании этих показателей выше критических (ТсР02 более 30 мм рт.ст. на стопе в положении лежа) можно выполнить хирургическую обработку на стопе с удалением нежизнеспособных тканей.
260
В заключение необходимо остановиться на следующих цифрах: по данным сводной статистики, смертность после реконструктивных сосудистых операций составляет от 2 до 4 %, а после первичной ампутации на уровне бедра при ишемической диабетической стопе смертность колеблется от 25 до 40 %, т.е. практически в 10 раз выше. У больных после реконструктивной сосудистой операции через 2 года сохраняется проходимость 88—90 % трансплантатов в аортобед-ренной позиции и около 70 % трансплантатов в бедренно-подколенной позиции; проходимость трансплантатов в бедренно-берцовой позиции несколько хуже — около 60 %. При ампутации нижней конечности выше коленного сустава через год смертность среди пациентов увеличивается еще на 20—30 %. Все это свидетельствует о необходимости поиска любых возможностей для спасения конечности у больных с ишемичес-
Рис. 7.32. Ангиограммы стопы и голени до (а) и после (б) артериализации венозного кровотока стопы.
261
кой диабетической стопой, так как, помимо улучшения качества жизни пациента, реконструктивная сосудистая операция спасает и продлевает его жизнь.
Подводя итог изложенному, следует еще раз подчеркнуть большие возможности реконструктивной сосудистой хирургии в спасении жизни больных с критической ишемией нижних конечностей на фоне поражения магистральных артерий при сахарном диабете. Первоочередная задача амбулаторного врача — провести правильную дифференциальную диагностику ишемической диабетической стопы и направить больного в специализированное отделение, так как временной фактор у данной группы больных является решающим.
Успешное лечение больных с ишемической диабетической стопой зависит от слаженного взаимодействия врачей различных специальностей: эндокринологов, ангио-логов, ангиохирургов и хирургов, специализирующихся в гнойной хирургии.
Литература
Дедов И.И., Анциферов М.Б., Галстян Г.Р., Токмакова А.Ю. Синдром диабетической стопы (клиника, диагностика, лечение и профилактика). — М., 1998. — 43 с.
Ефимов А. С. Диабетические ангиопатии. — М., 1989.
Эндокринология: Пер. с англ. / Под ред. НЛавина. — М.: Практика, 1999. - 1128 с.
The Diabetic Foot. Proceeding of the First International Symposium on the Diabetic Foot. — Netherlands, May, 1991.
