
ГОС / 53
.doc53. Под внутренней энергией понимается среднее значение суммы кинетических и потенциальных энергий движущихся и взаимодействующих частиц системы. Во внутреннюю энергию не входит энергия движения системы как целого по отношению к другим телам. Такое определение по сути является статистическим, но не термодинамическим. В рамках термодинамики внутренняя энергия должна быть определена как некоторый внутренний энергетический параметр, свойства которого раскрываются первым началом термодинамики. В состоянии термодинамического равновесия внутренняя энергия является функцией внешних параметров и температуры.
Пусть x1, x2 , ……….xn – внешние параметры, характеризующие систему.
Т – температура, U – внутренняя энергия
В состоянии равновесия
U =U(x1, x2, ……xn, T) (2.1)
Для газа в цилиндре (простая система, характеризующаяся параметрами V и T)
U=U(V, T) – для равновесных состояний системы.
Для неравновесных состояний U является функцией множества параметров, характеризующих это состояние (а не только объема и температуры).
Существуют два способа изменения внутренней энергии:
1. Первый способ связан с изменением внутренней энергии без изменений внешних параметров, этот способ называется теплопередачей.
Передача энергии при теплопередаче происходит на микроскопическом уровне посредством обмена энергиями между микрочастицами.
Изменение внутренней энергии при теплопередаче называется количеством теплоты.
δQ – элементарное количество теплоты в элементарном процессе.
Q – количество теплоты в конечном процессе.
В средние века ошибочно считали, что при теплопередаче происходит переход от одного тела к другому «некоей» жидкости, называемой теплородом.
2. Второй способ связан с изменением внешних параметров системы.
Каждому внешнему параметру х термодинамической системы можно поставить в соответствие обобщенную силу У.
Элементарная работа δA = y1dx1 + y2dx2 + … + yndxn
![]() (2.2)
(2.2)
Обобщенная сила – есть коэффициент пропорциональности между изменением соответствующего параметра и работы, соответствующей этому изменению.
Первое начало содержит в себе два утверждения:
1. Внутренняя энергия является однозначной функцией состояния термодинамической системы.
В состоянии равновесия внутренняя энергия является функцией внешних параметров и температуры.
U =U(x1, x2, ……xn, T) (2.3)
2. В термодинамических процессах выполняется закон сохранения и превращения энергии.
dU=δQ+δA’ (2.4)
где δA’ – работа над системой.
Бесконечно малое изменение внутренней энергии определяется сообщенным системе теплом и совершенной над системой работой. Учитывая, что в термодинамике обычно рассматривается работа, совершенная самой системой δA, причем δA = - δA’ , получим
δQ = dU + δA (2.5)
Тот факт, что внутренняя энергия является однозначной функцией внешних параметров и температуры, позволяет представить бесконечно малое изменение U в виде:
![]() (2.6)
(2.6)
δA=y1dx1 + y2dx2 +…+ yndxn
![]() (2.7)
(2.7)
Для количества теплоты записана форма (2.7), которая содержит дифференциалы всех параметров и температуры.
В соответствии с (2.5) δQ определяется суммой двух величин: dU- не зависящей от формы процесса и δА- зависящей от формы процесса перехода, поэтому δQ также является функцией процесса перехода системы из одного состояния в другое.
![]()
![]() (2.9)
(2.9)
Под теплоемкостью термодинамической системы будем понимать количество теплоты необходимое для изменения температуры системы на единицу (один Кельвин) в заданном процессе.
Пусть х – значок, обозначающий форму процесса, ( δQ)х – количество теплоты, сообщенное системе, в данном процессе. Теплоемкость системы определяется выражением
![]() ,
(2.13)
,
(2.13)
из которого видно, что теплоемкость зависит от формы процесса.
Рассмотрим простую систему, которая характеризуется параметрами V и T.
![]()
Теплоемкость при постоянном объеме
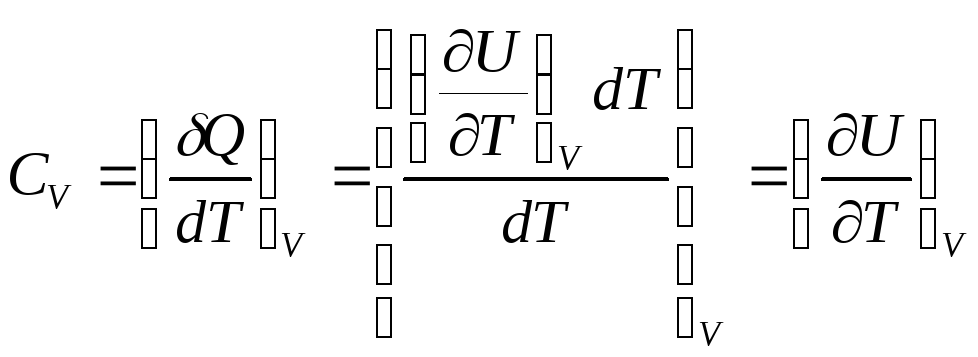 (2.14)
(2.14)
![]() При
постоянном давлении
При
постоянном давлении

![]() (2.15)
(2.15)
Теплоемкость одного моля вещества называется молярной теплоемкостью.
![]() , (2.16)
, (2.16)
где ν - число молей вещества
Теплоемкость единицы массы вещества называется удельной теплоемкостью.
![]() (2.17)
(2.17)
Единицы измерения теплоемкостей:
[ Cx]
=Дж/К , [Cмолх]=Дж/моль
.
К , [Cудх]=Дж/кг
.
К
Cx]
=Дж/К , [Cмолх]=Дж/моль
.
К , [Cудх]=Дж/кг
.
К
Изотермический процесс.
Изотермический процесс – это процесс, проходящий при постоянной температуре (Т=Const)
pV=сonst (2.22)
(2.22)– закон Бойля – Мариотта.
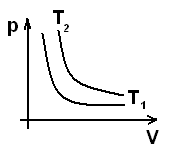
Т2>Т1
Изотермы,
соответствующие разным температурам,
не пересекаются.
![]()
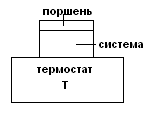 При изотермическом
процессе система должна находиться
в контакте с термостатом при заданной
температуре.
При изотермическом
процессе система должна находиться
в контакте с термостатом при заданной
температуре.
Адиабатический процесс.
Адиабатический процесс – это процесс, происходящий без теплопередачи:
δQ=0
, поэтому
![]() δQ=dU+pdV=0
δQ=dU+pdV=0
Согласно (1.21)
![]() СVdT+pdV=0
СVdT+pdV=0
Для 1моля вещества
pV=RT→
![]() ,
тогда
,
тогда
![]()
![]()
![]()
![]()
![]()
![]()
![]() - соотношение
Майера для 1 моля вещества
- соотношение
Майера для 1 моля вещества
Тогда уравнение
адиабаты примет вид
![]()
Обозначив
![]() g
получим уравнение адиабаты
g
получим уравнение адиабаты
pVγ=Const (2.23)

![]()
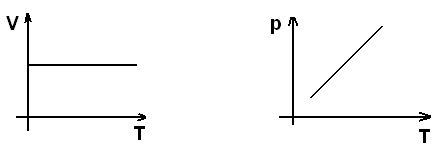
Изохорический (изохорный) процесс.
Изохорный процесс – это процесс, протекающий при постоянном объёме (V=Const).
![]() (2.24)
(2.24)
![]() - закон Шарля
(2.25)
- закон Шарля
(2.25)
Изобарический (изобарный) процесс.
Изобарный процесс – это процесс, протекающий при постоянном давлении (p=Const)
![]()

![]() - закон Гей –
Люссака. (2.26)
- закон Гей –
Люссака. (2.26)
Политропический
процесс – это процесс, проходящий при
постоянной теплоемкости.
![]() = const
= const
Найдем уравнение процесса:
![]()
![]()
![]()
Рассмотрим один
моль идеального газа:
![]()
![]()
![]()
![]()
![]()
![]()
