
ГОС / 57
.doc57. Рассмотрим равновесную статистическую систему, которая характеризуется классическим распределением Гиббса.
![]() (4.36)
(4.36)
Условие нормировки
![]() (4.37)
(4.37)
Каждая статистическая система характеризуется некоторой совокупностью степеней свободы.
Число независимых возможных перемещений частей системы называется числом степеней свободы.
Свободная материальная точка имеет три степени свободы.
N – материальных независимых точек, 3N – степеней свободы
Д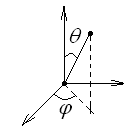 вухатомная
молекула имеет 5 степеней свободы (три
координаты центра масс и углы θ и φ).
вухатомная
молекула имеет 5 степеней свободы (три
координаты центра масс и углы θ и φ).
N – двухатомных молекул,
 5N
– степеней свободы.
5N
– степеней свободы.
Трехатомная молекула имеет 6 степеней свободы.
Для N – молекул имеем 6N степеней свободы без учета колебательных степеней.
Выделим i-ю координату, которая характеризует положение частицы.
![]() - кинетическая
энергия, приходящаяся на i-ю
степень свободы, pi
– i-я
проекция импульса. Среднее значение
кинетической энергии, приходящейся на
i-ю
степень свободы
- кинетическая
энергия, приходящаяся на i-ю
степень свободы, pi
– i-я
проекция импульса. Среднее значение
кинетической энергии, приходящейся на
i-ю
степень свободы
![]() определим с помощью функции распределения
Гиббса
определим с помощью функции распределения
Гиббса
![]()
![]()
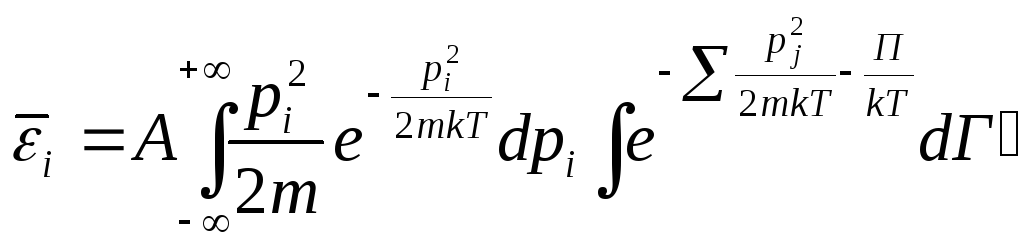 (
(![]() не включает dpi)
не включает dpi)
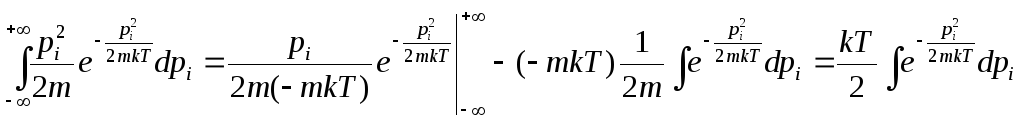
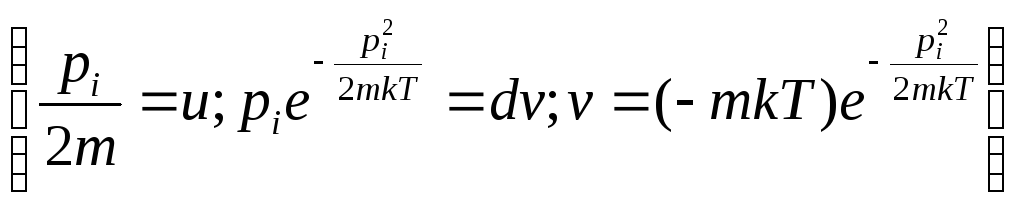
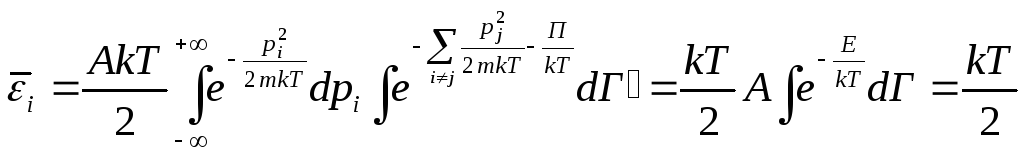 (3.38)
(3.38)
![]() - среднее значение
энергии, приходящейся на одну степень
свободы.
- среднее значение
энергии, приходящейся на одну степень
свободы.
Газ, молекулы которого движутся хаотически и у которого средней потенциальной энергией взаимодействия молекул друг с другом можно пренебречь по сравнению со средней кинетической энергией, называется идеальным.
1. Идеальный одноатомный газ.
N – молекул в системе, 3N – число степеней свободы системы
![]() (4.40)
(4.40)
![]() -
средняя (внутренняя) энергия идеального
газа
-
средняя (внутренняя) энергия идеального
газа
![]() (4.41)
(4.41)
1 моль:
![]()
2. Идеальный двухатомный газ.
N – молекул в системе
5N – число степеней свободы системы
![]() (4.43)
(4.43)
![]() (4.44)
(4.44)
![]() (4.45)
(4.45)
3. Идеальный трехатомный газ.
N – молекул в системе
6N – число степеней свободы системы
![]() (4.46)
(4.46)
![]() (4.47)
(4.47)
![]() (4.48)
(4.48)
Полученные теплоемкости – постоянные, не зависят от температуры и определяются числом степеней свободы системы.
Сопоставление с экспериментом.
1. Одноатомный газ.
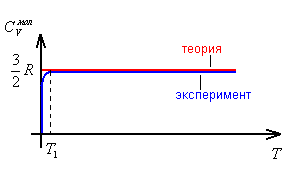
Согласие теории
и эксперимента хорошее. Несогласие
возможно при сверхнизких температурах.
Если а – размер сосуда - при
![]()
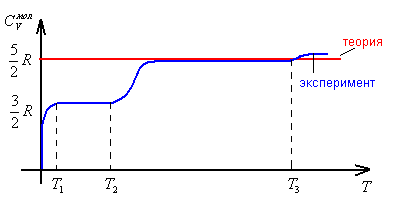
2. Двухатомный газ.
Т2 – азотные температуры
Согласие теории и эксперимента имеет место только в области температур от Т2 до Т3.
3. Трехатомный газ.

Согласие теории и эксперимента плохое. Теория неудовлетворительна для двухатомных и трехатомных газов.
Классическая
теория теплоемкости противоречит
третьему началу термодинамики, согласно
которому
![]() при
при
![]() .
.
Двухатомный газ.
Будем рассматривать движение центра масс двухатомной молекулы классически, а вращательное движение – квантово – механически.
Считаем, что энергия поступательного движения принимает непрерывный ряд значений. Энергия вращательного движения принимает значения равные
![]() (4.49)
(4.49)
I – момент инерции молекулы, L – момент импульса молекулы
![]() (4.50)
(4.50)
l – орбитальное квантовое число (l=0,1,2,…)
![]() (4.51)
(4.51)
Э нергия
поступательного движения
нергия
поступательного движения
принимает непрерывный ряд значений,
поэтому при любой температуре заполнены как нулевой, так и вышележащие уровни.
![]()
![]()
![]()
Тепловое движение означает наличие частиц в возбужденном состоянии.
Если энергия непрерывна, то при сколь угодно низкой температуре найдутся ближайшие к основному уровни, у которых заселенность будет не мала, то есть даже при низких температурах частицы газа «участвуют» в тепловом движении.
Энергия вращательного движения квантуется
![]() (4.52)
(4.52)
![]()
![]()
Если
![]() ,
то
,
то
![]() .
Все частицы находятся на нулевом
уровне, то есть молекулы не участвуют
в тепловом движении, происходит
вымораживание вращательных степеней
свободы. Поэтому среднее значение
энергии, приходящейся на одну степень
свободы вращательного движения стремится
к нулю при
.
Все частицы находятся на нулевом
уровне, то есть молекулы не участвуют
в тепловом движении, происходит
вымораживание вращательных степеней
свободы. Поэтому среднее значение
энергии, приходящейся на одну степень
свободы вращательного движения стремится
к нулю при
![]() .
.
О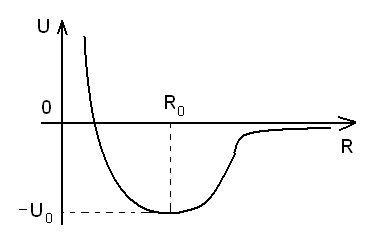 пределим
среднее значение энергии вращательного
движения при произвольных температурах.
пределим
среднее значение энергии вращательного
движения при произвольных температурах.
![]() (4.53)
(4.53)
Условие нормировки
![]() .
.
Здесь
![]()
Каждый l – уровень имеет (2l+1) проекцию, то есть он (2l+1) – кратно вырожден.
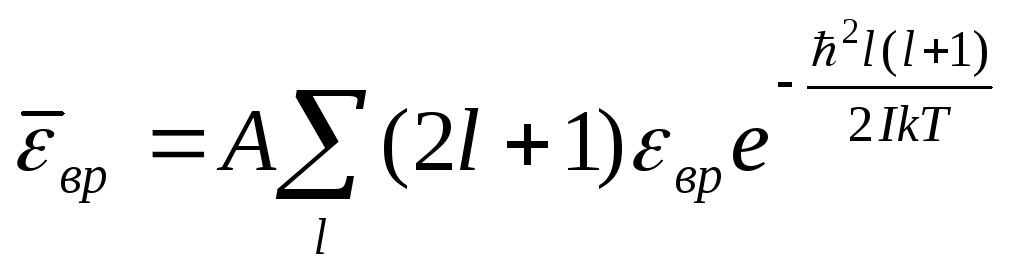 (4.54)
(4.54)
![]() (4.55)
(4.55)
Формулу (4.54) с учетом (4.55) можно записать в виде
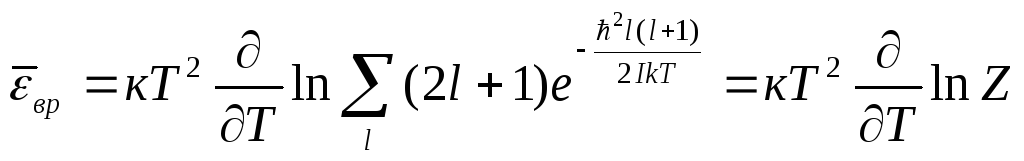 (4.56)
(4.56)
1.Низкие температуры
![]() ,
,
![]() ,
,
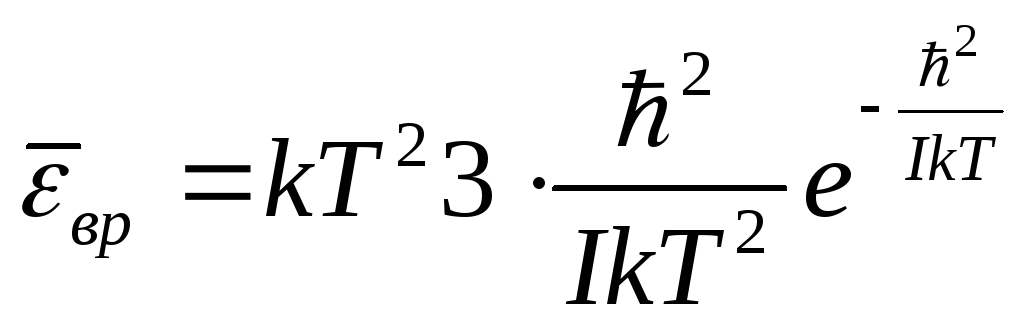
![]()
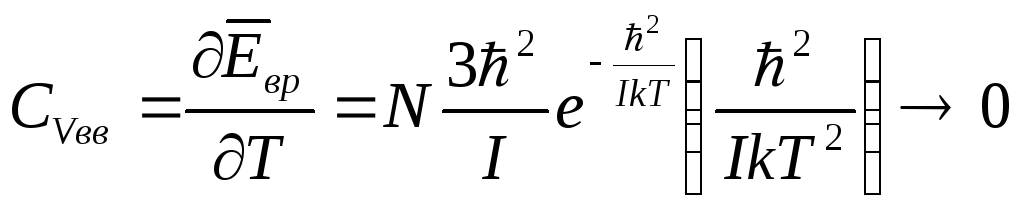 при
при
![]()
2.Высокие температуры
![]()
![]()
Выполним суммирование
в Z,
заменяя сумму приближенно интегралом
по
![]() ,
полагая
,
полагая
![]() . При этом получим
. При этом получим
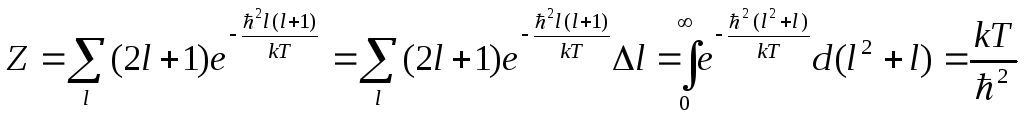
Отсюда
![]() и
и
![]()
![]() ;
;
![]()
Колебательное движение ядер (ионов) относительно друг друга.
Атомы в двухатомной молекуле могут смещаться относительно друг друга, при этом на классическом языке возникает «сила», возвращающая их в положение равновесия.
![]()
![]()
Движение атомов
в поле с потенциальной энергией
![]() -
это задача о квантовом осцилляторе.
-
это задача о квантовом осцилляторе.
![]() - энергия осциллятора; n=0,1,2,3,…
- энергия осциллятора; n=0,1,2,3,…
![]() ;
М – масса ядер
;
М – масса ядер
Вычислим
среднестатистическое значение энергии
системы независимых осцилляторов.
Выберем начало отсчета энергии от
энергии нулевых колебаний
![]() - энергия осциллятора,
отсчитанная от
- энергия осциллятора,
отсчитанная от
![]() .
.
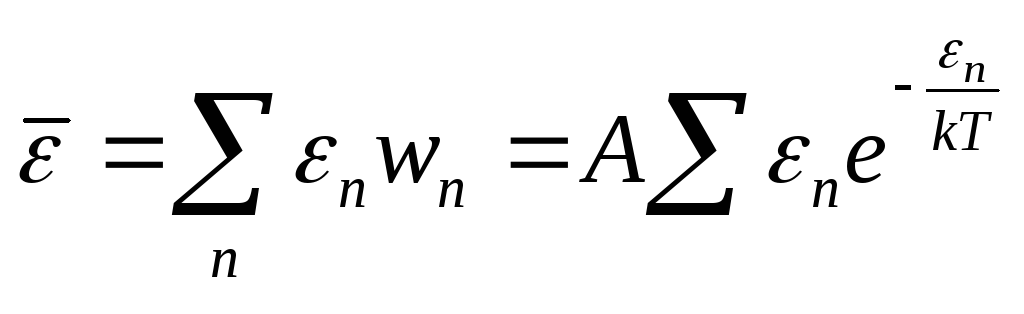
![]() - условие нормировки.
- условие нормировки.
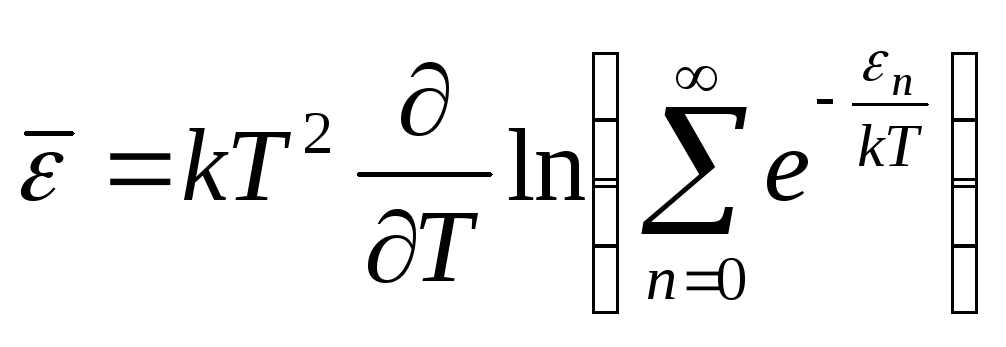 ,
,
![]() - статистическая сумма
- статистическая сумма
![]()
Вычислим статистическую сумму z
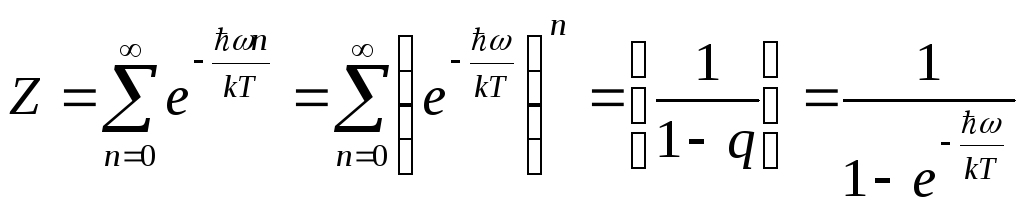 ,
,
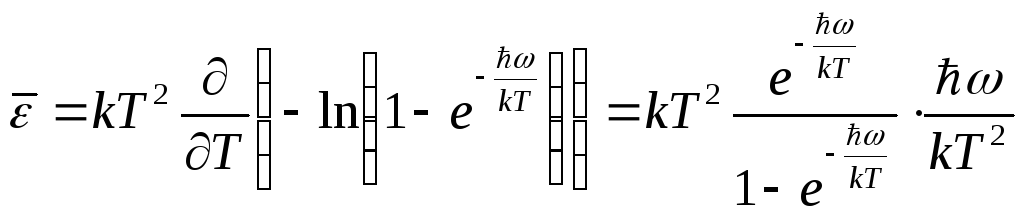
Среднее значение
энергии осциллятора
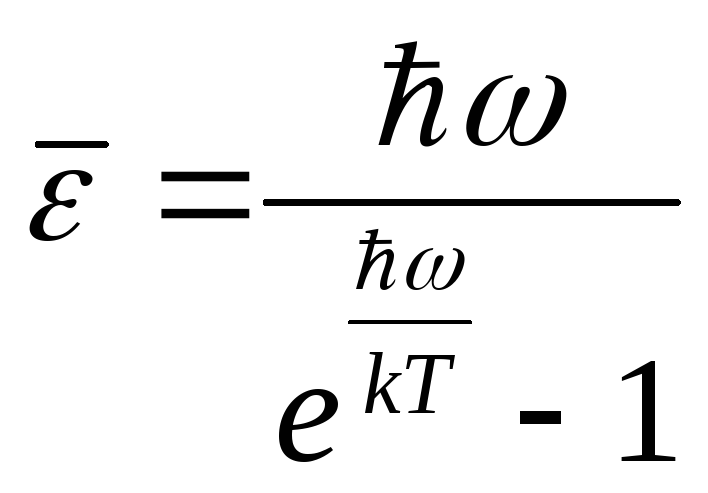 (4.58)
(4.58)
Предельные случаи.
1. Низкие температуры
![]()
![]()
![]()
![]()
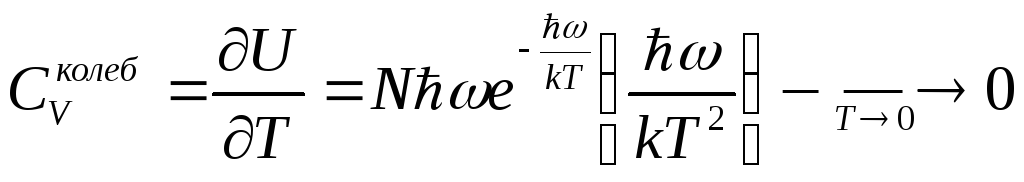
2. Высокие температуры
![]()
![]()
![]()
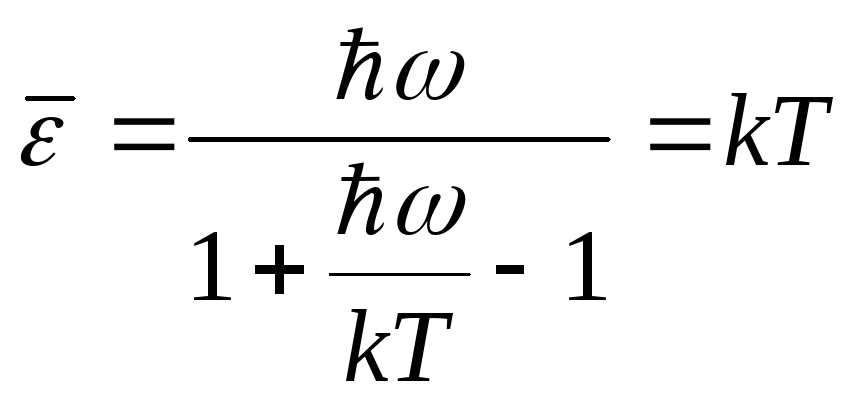 - классический
результат
- классический
результат
![]()
![]() 1 моль:
1 моль:
![]()
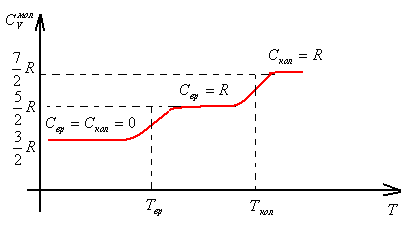
Рассмотрим поведение
теплоемкости двухатомного газа в широком
температурном интервале. При низких
температурах вклад в теплоемкость дает
поступательное движение молекул. При
Т >
![]() возбуждаются вращательные степени
свободы, при Т >
возбуждаются вращательные степени
свободы, при Т >![]() колебательные.
колебательные.
