- •6. Арены
- •А.И. Кузнецов
- •Оглавление
- •6. Арены
- •Гексагон энергетические
- •Циклопентадиенил анион катион тропилия
- •6.1.1. Нитрование
- •Не очень неустойчивый
- •6.1.2. Сульфирование
- •6.1.3. Галогенирование
- •6.1.4. Алкилирование
- •6.1.5. Ацилирование
- •Пропионилхлорид пропиофенон
- •Применение реакции Фриделя-Крафтса имеет следующие ограничения:
- •6.2. Алкилбензолы
- •6.2.1. Реакции электрофильного замещения толуола
- •6.3. Реакции электрофильного замещения нафталина
- •6.4. Восстановление по Берчу
- •6.5 Окисление аренов
- •Нафталин фталевый ангидрид фталевая кислота
- •6.6. Стирол
- •Фуллерены и нанотрубки
6. Арены
(пособие для самостоятельной работы студентов)
А.И. Кузнецов
23
27
Оглавление
А. Аннулены. Правило Хюккеля 2
Б. Стабильность бензола 2
В. Ароматичность 3
Г. Строение бензола 3
Д. Конденсированные ароматические углеводороды 5
Е. Ароматические ионы 5
Ж.Ароматические гетероциклические соединения 7
6.1. Электрофильное ароматическое замещение 6
А. Механизм электрофильного ароматического замещения 12
Б. Влияние заместителей на электрофильное замещение (правила ориентации) 13
6.1.1. Нитрование 9
6.1.2. Сульфирование 11
6.1.3. Галогенирование 12
6.1.4. Алкилирование 14
А. Хлорметилировани 16
6.1.5. Ацилирование 16
6.2. Алкилбензолы 17
А. Кумольный метод получения фенола и ацетона 19
6.2.1. Реакции электрофильного замещения алкилбензолов 19
А. Нитрование 19
Б. Сульфирование 21
В. Галогенирование 21
6.3. Реакции электрофильного замещения нафталина 22
6.4. Восстановление Аренов по Берчу 24
6.5.Окисление аренов 24
6.6. Стирол 25
А. Анионная полимеризация стирола 26
Фуллерены и нанотрубки 28
6. Арены
История ароматических соединений началась в 1825 году, когда английский ученый Фарадей выделил бензол из осветительного газа. В 1834 году немецкий химик Митчерлих получил бензол нагреванием бензойной кислоты с оксидом кальция и установил, что он имеет формулу С6Н6.
![]() (1)
(1)
В 1865 г Кекуле предложил формулу бензола. В конце 19 века в органической химии распространилась теория строения органических соединений (Бутлеров - Кекуле и Купер). В результате все соединения были разделены на алифатические и ароматические углеводороды.
А. Аннулены. Правило Хюккеля
В случае циклических соединений сопряжение может быть циклическим кольцевым. Группа соединений с одинаковой эмпирической формулой (СН)n и циклической структурой называют аннуленами. Их номенклатура ясна из приводимых примеров. Некоторые из аннуленов обладают повышенной термодинамической стабильностью
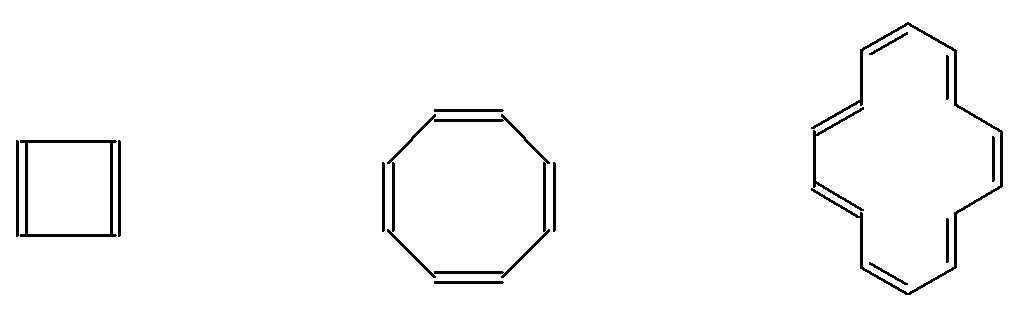
[4]-аннулен [8]-аннулен [14]-аннулен
Хюккель вывел правило, по которому: ароматичностью обладают карбоциклы имеющие плоское строение и содержащие в замкнутой системе сопряжения (4n + 2) -электронов. Из правила Хюккеля следует, что [2], [6] и [10]-аннулены должны быть ароматическими. Понятие ароматичности возникло раньше правила Хюккеля. Правило Хюккеля является лишь квантовомеханическим критерием ароматичности.
Б. Стабильность бензола
Гидрирование бензола в присутствии платинового или никелевого катализатора приводит к образованию циклогексана:
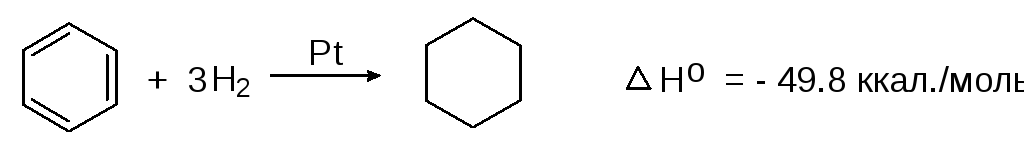 (2)
(2)
бензол циклогексан
При этом продуктов неполного гидрирования (циклогексена и 1,3-циклогексадиена) не образуется. При гидрировании циклогексена выделяется 28,6 ккал/моль.
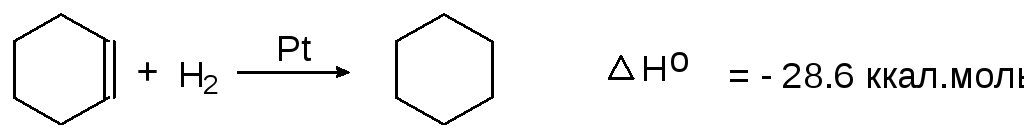 (3)
(3)
цикоогексен циклогексан
При гидрировании 3 молей циклогексена, таким образом, выделяется 28,6 х 3 = 85,8 ккал/моль. Если из этой суммы вычесть энергию, выделяющуюся при гидрировании одного моля бензола, содержащего то же количество кратных связей, что и три моля циклогексена (85,8 - 49,8 = 36 ккал. моль), получим энергию стабилизации или энергию резонанса в бензоле. Энергия стабилизации представляет собой разницу между вычисленной энергией, которая могла бы выделиться при гидрировании гипотетического 1,3,5-циклогексатриена в случае отсутствия в нем делокализации электронов и экспериментально найденной энергией, выделяющейся при гидрировании реального бензола.
В. Ароматичность
Термин «ароматический» возник потому, что многие соединения бензальдегид, бензиловый спирт, эфиры бензойной кислоты, содержащие бензольные кольца, были выделены из различного рода ладанов, ароматических масел и бальзамов. Ароматические соединения отличаются по свойствам от других ненасыщенных соединений:
Критериями ароматичности являются:
- высокая термодинамическая стабильность;
- ненасыщенный характер их молекул почти не проявляется;
- они трудно вступают в реакцию присоединения;
- соединение считается тем ароматиченее, чем менее реакционноспособны его двойные связи, и чем выше его термодинамическая стабильность;
- ароматические соединения отличаются от алифатических соединений по их поведению по отношению к электрофильным реагентам: электрофильные реагенты при взаимодействии с ароматическими соединениями не присоединяются по их кратным связям, а замещают атомы водорода, связанные с ароматическими циклами;
- легкость образования аренов в различных реакциях;
- устойчивость к действию окислителей.
Г. Строение бензола
Данные современных физико-химических методов указывают на то, что все СС и СН связи в бензоле эквивалентны. Согласно этим данным, бензол представляет собой правильный гексагон с длиной СС связи 1,397 Å и валентным углом 120о. Образование -связей СС можно представить как результат продольного перекрывания sp2-гибридных орбиталей углерода, при этом шесть негибридных p-орбиталей шести атомов углерода образуют замкнутую -электронную систему за счет бокового перекрывания. Образующийся при этом секстет -электронов обусловливает особые свойства и стабильность бензола.
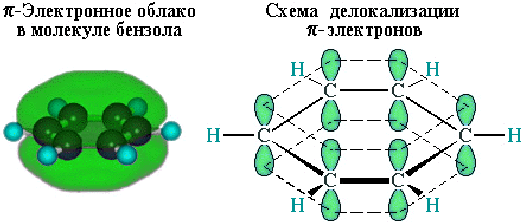
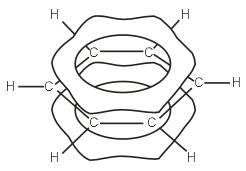
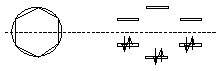
Согласно теории МО, шесть атомных p-орбиталей атомов углерода комбинируются с образованием шести молекулярных -орбиталей, из которых три являются связывающими, а три – разрыхляющими. Чтобы показать равномерность распределения электронной плотности в молекуле бензола, структурную формулу его часто изображают в виде шестиугольника с окружностью внутри:
![]()
Для оценки устойчивости плоских полностью сопряженных циклических -систем по относительной энергии молекулярных орбиталей удобно пользоваться графическим методом по Фросту, Кулсону (Coulson). Систему представляют правильным многоугольником и вписывают в окружность таким образом, чтобы одна из вершин располагалась в точке пересечения вертикально проведенного диаметра с нижней частью круга. Точки, в которых вершины многоугольника касаются круга, считают уровнями энергии молекулярных орбиталей, а вертикальный диаметр - координатой энергии, на которой горизонтальный диаметр обозначает несвязывающий уровень.
Рассмотрим с помощью круга Фроста уровни энергии бензола. В бензоле имеются три связывающие и три разрыхляющие орбитали. Все три связывающие орбитали бензола полностью заняты, и на каждой из них размещаются по два электрона с антипараллельными спинами. Все разрыхляющие орбитали бензола в основном состоянии не заняты электронами.