
- •4. Алкины а.И. Кузнецов
- •Оглавление
- •4. Алкины
- •Структура тройной связи
- •4.1. Кислотность алкинов
- •Литийдиизопропиламид пропиниллитий диизопропиламин
- •4.2. Методы получения алкинов а. Получение ацетилена из карбида кальция
- •В. Дегидрогалогенирование дигалогенидов
- •4.3. Реакции присоединения по тройной связи
- •4.3.1 Восстановление
- •Электрофильное присоединение
- •А. Присоединение брома и хлора
- •В. Гидратация
- •Д. Присоединение синильной кислоты
- •4.8. Изомеризация
- •4.9. Полимеризации
- •4.10. Реакции карбонилирования
- •Применение
4. Алкины а.И. Кузнецов
14.11.10
Оглавление
4.1. Кислотность алкинов 2
4.2. Методы получения алкинов 4
А. Получение ацетилена из карбида кальция 4
Б. Пиролиз метана 4
В. Дегидрогалогенирование дигалогенидов 5
Г. Алкилирование ацетилена 6
4.3. Реакции присоединения по тройной связи 6
4.3.1. Восстановление 7
А. Каталитическое гидрирование 5
Б. Восстановление натрием в жидком аммиаке 7
4.3.2. Электрофильное присоединение 8
А. Присоединение брома и хлора 8
Б. Гидрогалогенирование 9
В. Гидратация 10
Г. Присоединение уксусной кислоты – образование винилацетата 11
Д. Присоединение синильной кислоты 11
4.4. Димеризация 11
4.5. Циклизация 12
4.6. Получение ацктиленовых спиртов 12
4.7. Окисление алкинов 13
А. Реакция окислительного сочетания 13
4.8. Изомеризация 13
4.9. Полимеризация 13
4.10. Реакция карбонилирования 14
4. Алкины
Алкинами называют соединения, содержащие тройные углерод-углеродные связи СС. По низшему гомологу - ацетилену, их называют ацетиленами или ацетиленовыми углеводородами. Ацетилены образуют гомологический ряд с общей формулой СnH2n - 2.
Ацетилен горит в атмосфере кислорода с образованием пламени с температурой 2800оС, что используется для сварки. С воздухом взрывчатые смеси в широких пределах (от 5 до 80% ацетилена).
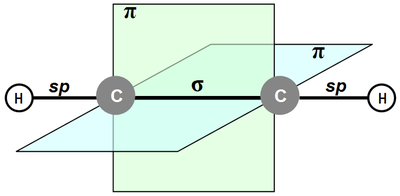
Структура тройной связи
У алкинов связь -С≡С- линейна (угол 180°) и находится в одной плоскости. Атомы углерода связаны одной σ- и двумя π-связями, максимальная электронная плотность которых расположена в двух взаимно перпендикулярных плоскостях. Длина тройной связи примерно 0,121 нм, энергия связи 836 кДж/моль.
4.1. Кислотность алкинов
Характерным свойством ацетиленовых углеводородов является высокая кислотность терминального ацетиленового водорода. Это проявляется в том, что ацетилен способен давать соли.
H-OH > RO-H > RCC-H > H2N-H > CH2=CH-H > CH3CH2-H
pKa 15.8 16-17 25 38 44 50
Повышенная подвижность ацетиленового водорода является результатом большего s-характера (50%) sp-гибридизованной орбитали, чем sp2 и sp3-гибридных орбиталей. Поскольку s-орбиталь ближе к атому углерода, чем p-орбиталь, то увеличение s-характера приводит к сдвигу этой пары в сторону углерода и вызывает повышение кислотности водорода.
Электроны на s-орбиталях удерживаются ядром прочнее, чем на р-орбиталях. Это означает, что s-электроны обладают меньшей энергией и меньшей подвижностью, чем р-электроны. Отсюда следует, что чем больше вклад s-орбитали в гибридную орбиталь, на которой находится неподеленная пара электронов, тем устойчивее соответствующий карбанион
С другой точки зрения, подвижность ацетиленового водорода является результатом выхода значительной части электронной плотности в пространство, что уменьшает плотность на атоме углерода и вызывает кислотность водорода.
Соединения, в которых кислый атом водорода связан с атомом углерода, называются С-Н-кислотами.
Алкины взаимодействуют с сильными основаниями с образованием солей, называемых ацетиленидами.
![]() (1)
(1)
pKa 25 38
амид натрия этинид натрия
Для получения ацетиленидов кроме амида натрия можно использовать гидрид натрия и литийдиизопропиламид (LDA).
![]()
![]()
гидрид натрия литийдиизопропиламид (LDA)
CH3CC-H + [(CH3)2CH]2NLi CH3CC-Li + [(CH3)2CH]2NH (2)
