
Московский государственный университет тонкой химической технологии им. М.В. Ломоносова.
Курсовая Работа
Кафедра Общей Химической Технологии
Тема: Производство серной кислоты из серы.
Преподаватель: Цыганков Владимир Николаевич
Студент: Лыкошин Дмитрий Дмитриевич
Группа ХТ-409
Москва 2013
-
Общие сведения
Серная кислота - H2SO4 (мол. Масса 92,082) бесцветная маслянистая жидкость без запаха. Не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от -40…-20 до 260 – 336,5 ˚С) находится в жидком состоянии.
Области
применения серной кислоты чрезвычайно
обширны. Существенная ее часть используется
как полупродукт в различных отраслях
химической промышленности, прежде всего
для получения минеральных удобрений,
а также солей, кислот, взрывчатых веществ.
Серная кислота применяется и при
производстве красителей, химических
волокон, в металлургической, текстильной,
пищевой промышленности и т.д.
Серная
кислота может существовать как
самостоятельное химическое соединение
H2SO4,
а также в виде соединений с водой:
H2SO4 2H2O,
H2SO4
2H2O,
H2SO4 H2O,
H2SO4
H2O,
H2SO4 4H2O,
H2SO4
4H2O,
H2SO4
 SO3,
H2SO4
SO3,
H2SO4 2SO3.
2SO3.
В
технике серной кислотой называют
безводную H2SO4
,
ее водные растворы (смесь H2SO4
,
H2O
и H2SO4 nH2O)
и растворы триоксида серы в безводной
H2SO4
–
олеум ( смесь H2SO4
и
соединений H2SO4
nH2O)
и растворы триоксида серы в безводной
H2SO4
–
олеум ( смесь H2SO4
и
соединений H2SO4 nSO3
).
nSO3
).
Безводная серная кислоты – тяжелая маслянистая бесцветная жидкость, смешивающаяся с водой и триоксидом серы в любом соотношении. Безводная 100%-ая серная кислота имеет сравнительно высокую температуру кристаллизации (10,7˚С). Выпускают три вида серной кислоты:
|
|
Концентрация |
Температура кристаллизации, ˚С |
|
Башенная кислота |
75% |
-29,5 |
|
Контактная кислота |
92,5% |
-22,0 |
|
Олеум |
20% свободного SO3 |
+2 |
Серная кислота и вода образуют азеотропную смесь: 98,3% H2SO4 и 1,7% H2O с максимальной температурой кипения (336,5 ˚С).
-
Исходное сырье
Исходными реагентами для получения серной кислоты могут быть элементарная сера и серосодержащие соединения, из которых можно получить либо серу, либо диоксид серы. Например, сульфиды железа, сульфиды цветных металлов (меди, цинка и др.), сероводород и ряд других сернистых соединений. Традиционно основные источники сырья – сера и железный (серный) колчедан. Значительное место в сырьевом балансе производства серной кислоты занимают отходящие газы цветной металлургии, содержащие диоксид серы. Производство серной кислоты включает в себя несколько этапов:
-
Подготовка сырья: а) очистка и плавление серы; б) очистка, сушка и дозировка воздуха;
-
Сжигание серы. Получение диоксида серы окислением (обжигом) серосодержащего сырья. Процесс ведут с избытком воздуха.
S+О2 = SO2
-
Контактное окисление оксида серы (IV) в оксид серы (VI). Этот процесс характеризуется очень высоким значением энергии активации, для понижения которой необходимо, как правило, применение катализаторов.
SO2 + 0,5O2 = SO2 (Процесс ведут на ванадиевом катализаторе при t = 420-550˚С)
-
Абсорбция. В зависимости от того как проводится процесс окисления SO2 в SO3 , различают два основных метода получения серной кислоты:
-
Контактный – процесс окисления SO2 в SO3 проводят на твердых катализаторах. Триоксид серы переводят в серную кислоту на последней стадии процесса – абсорбции триоксида серы, которую можно представить уравнение реакции:
SO3
+
H2O
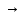 H2SO4
H2SO4
-
Нитрозный (башенный) – в качестве переносчика кислорода используют оксиды азота. Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
SO3
+
N2O3
+ H2O
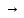 H2SO4
+ 2NO
H2SO4
+ 2NO
В промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
Рассмотрим процесс получения серной кислоты контактным методом из двух видов сырья: серного (железного) колчедана и серы.
Первой стадией процесса является окисление сырья с получением обжигового газа, содержащего диоксид серы. В зависимости от видов сырья протекают экзотермические химические реакции обжига:
FeS2
+ 11O2
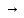 2Fe2O3
+ 8SO2
(I)
S
+ O2
2Fe2O3
+ 8SO2
(I)
S
+ O2
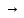 SO2
.
(II)
SO2
.
(II)
При протекании реакции (I) помимо газообразного диоксида серы образуется твердый продукт Fe2O3, который может присутствовать в газовой фазе в виде пыли. Колчедан содержит различные примеси, в частности соединения мышьяка и фтора, которые в процессе обжига переходят в газовую фазу. Присутствие этих соединений может вызвать отравление катализатора. Поэтому реакционный газ после стадии обжига колчедана должен быть предварительно направлен на стадию подготовки к контактному окислению, на которой помимо очистки от каталитических ядов выделяются пары воды (осушение), а также получаются побочные продукты (Se и Te).
Если обжиговый газ получают сжиганием серы, то отпадает необходимость очистки от примесей. Стадия подготовки будет включать в себя лишь осушку газа и утилизацию теплоты.
На третьей стадии протекает обратимая экзотермическая химическая реакция контактного окисления диоксида серы:
SO2 + 0,5O2 = SO3 (III)
Последняя стадия процесса – абсорбция триоксида серы концентрированной серной кислотой или олеумом.
В зависимости от комбинации этапов получения серной кислоты, существуют различные функциональные схемы:
-
Из колчедана методом одинарного контактирования
-
Из серы методом двойного контактирования
-
Циклическим методом из серы.
