
Краткий курс органической химии. Часть 1
.pdf
МОСКОВСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ ТОНКОЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
ИМ. М.В. ЛОМОНОСОВА
Кафедра органической химии
Помогаев А.И.
КРАТКИЙ КУРС ОРГАНИЧЕСКОЙ ХИМИИ
Учебное пособие Часть 1
Теоретические

 основы
основы
органической химии
Москва 2003
http://www.mitht.ru/e-library
УДК 547
ББК 24.2
Помогаев А.И.
Краткий курс органической химии Часть 1
Теоретические основы органической химии.
Учебное пособие М., МИТХТ им. М.В.Ломоносова, 2003 – 48 с.
Издание 2-ое.
Утверждено Библиотечно-издательской комиссией МИТХТ
им. М.В. Ломоносова в качестве учебного пособия.
Данное методическое пособие предназначено для студентов 3 курса направления бакалавриата «Материаловедение и технология новых материалов», изучающих органическую химию в течение одного учебного семестра.
Пособие представляет собой изложение материала, не выходящего в основном за пределы учебной программы по органической химии для этого направления. В конце каждого раздела приводятся упражнения и типичные задачи, самостоятельное решение которых поможет студенту подготовиться как к контрольным работам, так и к экзамену.
Подготовлено на кафедре органической химии МИТХТ им. М.В. Ломоносова.
© Московская Государственная Академия Тонкой Химической Технологии им. М.В. Ломоносова
http://www.mitht.ru/e-library
Оглавление
СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ _____________ 4
1.Классификация органических соединений____________________________4
2.Образование связей в органических соединениях______________________5
3.Свойства ковалентных связей ______________________________________9
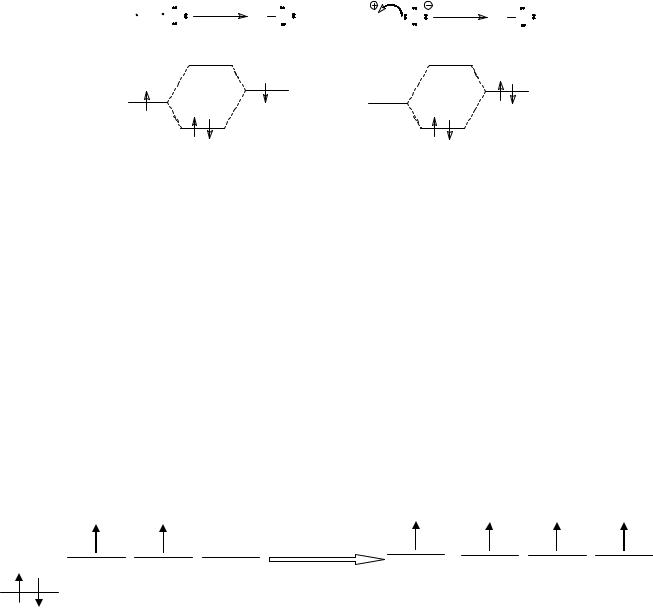
4.Электронные смещения в молекулах органических соединений_________11
4.1.Индуктивный эффект _____________________________________________11
4.2.Сопряжение орбиталей: делокализация связей, мезомерный эффект ______14
5.Изомерия органических соединений________________________________19
5.1.Структурная изомерия ____________________________________________19
5.2.Стереоизомерия__________________________________________________20
6.Задачи и упражнения_____________________________________________32
ОСНОВЫ ТЕОРИИ ОРГАНИЧЕСКИХ РЕАКЦИЙ__________ 34
1.Классификация органических реакций по типу разрыва связи __________34
1.1.Гомолитические или свободнорадикальные реакции ___________________34
1.2.Гетеролитические или ионные реакции ______________________________36
2.Классификация реакций по типу превращения _______________________38
3.Кислоты и основания в органической химии_________________________39
3.1.Кислоты и основания Бренстеда ____________________________________39
3.2.Кислоты и основания Льюиса ______________________________________43
3.3.Кислотно-основный катализ________________________________________44
4.Задачи и упражнения_____________________________________________45
http://www.mitht.ru/e-library
СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1. Классификация органических соединений
Органическая химия изучает различные соединения углерода,
простейшими из которых являются соединения углерода с водородом –
углеводороды. Все остальные органические вещества могут быть рассмотрены как производные углеводородов, отличающиеся от углеводородов тем, что в них один или более атомов водорода замещены на какие-либо другие атомы или группы атомов (функциональные группы).
В состав органических соединений кроме атомов углерода и водорода могут входить атомы других элементов (так называемые гетероатомы). Это,
прежде всего, атомы галогенов (галогенопроизводные углеводородов),
кислорода (спирты, фенолы, простые эфиры, альдегиды, кетоны, карбоновые кислоты), азота (амины, нитросоединения), серы (тиолы, сульфокислоты),
металлов (металлорганические соединения) и многих других элементов.
Воснове классификации органических соединений лежит их структура
–последовательность соединения атомов в молекуле. Для классификации органических соединений производят сначала классификацию углеводородной основы (родоначальной структуры), относя ее к насыщенным углеводородам с открытой цепью или циклическим, насыщенным или ненасыщенным,
алициклическим или ароматическим. А затем производят отнесение к соответствующим производным углеводородов, рассматривая функциональную группу. Так, например, бутан является насыщенным нециклическим углеводородом (такие углеводороды называются алканами), 1-бутен – ненасыщенным углеводородом нециклического строения, имеющим двойную связь (алкен). Циклобутен представляет собой циклический алкен, а бензол – ароматический углеводород. 2-Бутеналь является ненасыщенным ациклическим
(т.е. нециклическим) альдегидом, а бензойная кислота – это ароматическая карбоновая кислота.
http://www.mitht.ru/e-library

CH3CH2CH2CH3 |
CH2=CHCH2CH3 |
CH3CH=CHCH=O |
|
|
|
|
COOH |
|
|
|
|
|
|||||
|
|
|
|
|
||||
бутан |
1-бутен |
циклобутен |
2-бутеналь |
бензойная |
||||
|
|
|
|
|
кислота |
|||
2. Образование связей в органических соединениях
Молекула любого органического соединения представляет собой упорядоченную совокупность атомов, связанных преимущественно ковалентной связью. Ионная связь также встречается в органических молекулах, однако, не она определяет строение и химическое поведение подавляющего большинства органических соединений. Органическая химия – это химия ковалентных соединений углерода.
Ковалентная связь – это связь, которую осуществляют два атома посредством обобществленной пары электронов. Обобществление пары электронов происходит при перекрывании атомных орбиталей двух атомов, при этом совершенно безразлично (для образовавшейся связи), сколько электронов было на каждой из перекрывающихся орбиталей. На обеих орбиталях может быть по одному электрону, или на одной из орбиталей может находиться пара электронов, а на другой – ни одного электрона (в последнем случае говорят о донорно-акцепторном механизме образования ковалентной связи).
Орбитали, которые атомы элементов 1-го и 2-го периодов предоставляют для образования связей в органических соединениях, могут иметь обычные для атомных орбиталей характеристики, т. е. быть s- или p-орбиталями. Так,
например, при образовании молекулы хлороводорода атом хлора предоставляет р-орбиталь, а атом водорода – s-орбиталь. На р-орбитали атома хлора может быть один электрон, тогда для образования связи атом водорода также предоставляет один электрон. Или на р-орбитали атома хлора могут находиться два электрона (анион), тогда для образования связи атом водорода должен иметь пустую, или вакантную, орбиталь (протон). В последнем случае ковалентная связь образуется по донорно-акцепторному способу: анион хлора выступает донором электронной пары, а протон – ее акцептором. Ниже
http://www.mitht.ru/e-library
представлены две схемы образования молекулярных орбиталей (связывающей и антисвязывающей, или разрыхляющей) при взаимодействии (перекрывании)
атомных орбиталей.
H + Cl |
H Cl |
H + Cl |
H Cl |
|
|
|
|
s |
p |
s |
p |
|
|
||
|
|
|
|
Для атома углерода, как и для атомов других элементов второго периода,
которые могут образовывать как простые (одинарные) связи, так и двойные или тройные связи, характерна так называемая гибридизация атомных орбиталей,
когда атомные орбитали разной энергии (s- и p-орбитали) выравнивают свои энергии, образуя так называемые вырожденные орбитали, т.е. орбитали,
имеющие одинаковую энергию.
Атом углерода имеет на внешнем энергетическом уровне четыре электрона. Два валентных электрона располагаются на s-орбитали, на двух р-
орбиталях имеется по одному электрону, а третья р-орбиталь пуста. При образовании связей атом углерода возбуждается, и один из s-электронов переходит на вакантную р-орбиталь.
возбуждение
s рх ру рz
Возбужденный атом углерода с электронной конфигурацией 2s2p3 может образовать максимально четыре ковалентные связи. При этом связи могут быть образованы с различным количеством атомов – с четырьмя, тремя или двумя.
В первом случае, когда атом углерода образует связи с четырьмя соседними атомами, т.е. является четырехкоординационным, происходит гибридизация всех четырех орбиталей с образованием четырех вырожденных орбиталей, отличающихся от исходных орбиталей и по энергии, и по форме.
http://www.mitht.ru/e-library
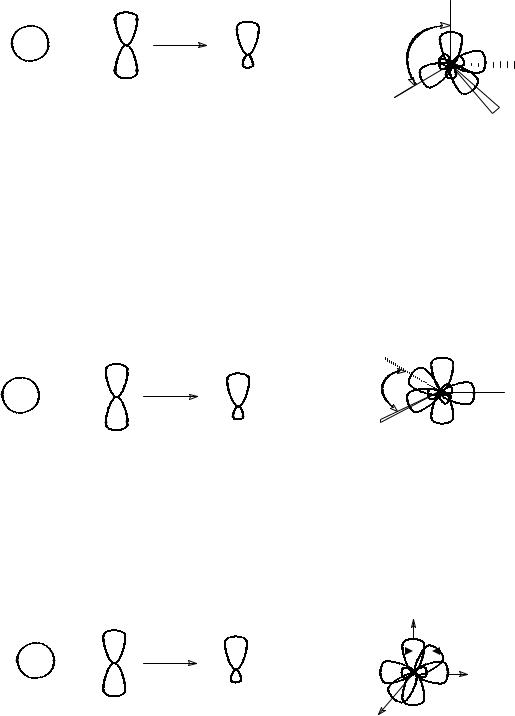
Этот процесс по участвующим в процессе орбиталям называют sp3-
гибридизацией, а образующиеся при этом орбитали – sp3-гибридными орбиталями. В пространстве эти гибридные орбитали лежат на осях,
максимально удаленных друг от друга и расположенных в силу этого под углом
109,5О друг к другу (как отрезки, соединяющие центр тетраэдра с его вершинами). Поэтому атом углерода в sp3-гибридизации называют еще
тетраэдрическим.
+ |
3 |
4 |
|
|
109,5o |
s |
р |
sp3 |
Когда же атом углерода образует связи с тремя соседними атомами, т.е.
является трехкоординационным, происходит выравнивание энергий трех орбиталей – одной s- и двух р-орбиталей с образованием трех вырожденных sр2-гибридные орбитали, оси которых лежат в одной плоскости под углом 120О
друг к другу. Не участвующая в гибридизации р-орбиталь располагается перпендикулярно упомянутой плоскости.
+ 2 |
3 |
120o |
s |
р |
sр2 |
 рZ
рZ
В третьем случае, когда атом углерода является двухкоординационным и
связан лишь с двумя соседними атомами, реализуется sр-гибридизация. Две вырожденные sр-орбитали располагаются под углом 180О друг к другу, т.е. на одной оси координат, а две негибридные р-орбитали находятся на двух других
осях координат. |
|
|
z |
+ |
|
рZ |
рY |
|
2 |
x |
|
|
|
|
|
s |
р |
sр |
y |
|
|
|
http://www.mitht.ru/e-library

Образование связей атома углерода происходит при перекрывании его гибридных орбиталей с соответствующими гибридными или негибридными орбиталями других атомов. При этом могут реализовываться два принципиально различных способа перекрывания орбиталей.
А) Осевое перекрывание орбиталей, при котором максимум перекрывания находится на оси, проходящей через ядра связывающихся атомов, приводит к образованию σ-связи. Электронная плотность этой связи заключена между ядрами связанных атомов. Она симметрична относительно оси перекрывания. σ-Связь может быть образована перекрыванием любых атомных орбиталей. Атомы водорода и хлора в молекуле хлороводорода связаны σ-связью, образованной в результате осевого перекрывания s-орбитали атома водорода и р-орбитали атома хлора. В молекуле метана все четыре связи между атомом углерода и атомами водорода являются также σ-связями, каждая из которых образована перекрыванием одной из четырех sp3-гибридных орбиталей атома углерода с s-орбиталью атома водорода.
а б
Перекрывание атомных орбиталей при образовании σ-связей в молекулах хлороводорода (а) и метана (б)
Б) Боковое перекрывание орбиталей – это перекрывание двух р-
орбиталей, расположенных на взаимно параллельных осях. Образующаяся при таком перекрывании π-связь характеризуется тем, что максимум перекрывания не находится на оси, проходящей через ядра связанных атомов. π-Связь образуют р-орбитали sр2- или sр-гибридизованных атомов.
Так, например, в молекуле этилена (СН2=СН2) три sр2-гибридных орбитали каждого атома углерода при осевом перекрывании с двумя s-
орбиталями атомов водорода и одной sр2-орбиталью соседнего атома углерода
http://www.mitht.ru/e-library

образуют три σ-связи. Негибридные р-орбитали атомов углерода перекрываются «боками» и образуют π-связь. При этом все пять σ-связей расположены в одной плоскости, а плоскость симметрии π-связи перпендикулярна ей.
В молекуле ацетилена тройная углерод-углеродная связь представляет собой комбинацию σ-связи и двух π-связей. Последние образуются боковым перекрыванием негибридных р-орбиталей во взаимно перпендикулярных
плоскостях. |
z |
|
|
z |
|
H |
H |
H |
H x |
|
H |
x |
||
|
H |
|
|
|
|
y |
|
y |
|
|
|
|
|
|
|
а |
|
|
б |
Образование π-связей в молекулах этилена (а) и ацетилена (б)
3. Свойства ковалентных связей
Ковалентная связь характеризуется следующими параметрами:
Длина связи определяется как расстояние между связанными атомами. Длина связи зависит от радиусов связанных атомов, от типа гибридизации атомов,
а также от кратности связи (табл. 1).
|
|
|
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
|
|
Связь |
Длина связи, Å |
Связь |
Длина связи, Å |
||||
|
|
|
|
|
|
|
|
С-С |
1,54 |
С-N |
1,47 |
||||
С=С |
1,34 |
С=N |
1,28 |
||||
C |
|
C |
1,20 |
C |
|
N |
1,16 |
|
|
||||||
|
|
||||||
|
|
||||||
С-Н |
1,11 |
С-F |
1,38 |
||||
С-О |
1,41 |
С-Сl |
1,78 |
||||
С=О |
1,20 |
С-Вr |
1,94 |
||||
|
|
|
|
С-I |
2,14 |
||
|
|
|
|
|
|
|
|
Энергия связи определяется как энергия образования или диссоциации связи и зависит от природы связанных атомов, от длины связи, а также от ее
http://www.mitht.ru/e-library
кратности (табл. 2). Следует отметить, что энергия двойной С-С-связи не представляет собой удвоенную энергию простой, поскольку боковое перекрывание орбиталей менее эффективно, чем осевое, и, следовательно, π-
связь менее прочная, чем σ-связь.
|
|
|
|
|
Таблица 2 |
|
|
|
|
|
|
|
|
Тип связи |
Энергия связи, |
Тип связи |
Энергия связи, |
|||
ккал/моль |
ккал/моль |
|||||
|
|
|
|
|||
|
|
|
|
|
|
|
О-Н |
110 |
С-F |
116 |
|||
|
|
|
|
|
|
|
N-Н |
93 |
С-Сl |
79 |
|||
|
|
|
|
|
|
|
S-Н |
82 |
С-Вr |
66 |
|||
|
|
|
|
|
|
|
С-Н |
96-99 |
С-I |
52 |
|||
|
|
|
|
|
|
|
С-С |
83-85 |
С-О |
85-91 |
|||
|
|
|
|
|
|
|
С=С |
146-151 |
С=О |
173-181 |
|||
|
|
|
|
|
|
|
C |
|
C |
199-200 |
С=N |
143 |
|
|
||||||
|
||||||
|
||||||
|
|
|
|
|
|
|
Полярность связи определяется разностью электроотрицательностей связанных атомов. Электроотрицательность атома – это его способность притягивать валентные электроны. Если электроотрицательности связанных атомов одинаковы, электронная плотность связи равномерно распределена между атомами. Во всех остальных случаях электронная плотность связи смещена в ту или иную сторону в зависимости от того, к какому из атомов она притягивается сильнее. На более электроотрицательном атоме возникает при этом так называемый частичный отрицательный заряд, а на менее электроотрицательном атоме – частичный положительный заряд. Для двухатомных молекул полярность связи может быть очень просто охарактеризована дипольным моментом молекулы, который может быть измерен. Обычно полярность простой связи изображают стрелкой вдоль связи, направленной к более электроотрицательному атому. Полярность кратных связей изображают изогнутой стрелкой, направленной от связи к более электроотрицательному атому. Ниже приведены примеры
http://www.mitht.ru/e-library
