
Туркельтауб Г.Н., Ищенко А.А.ВВЕДЕНИЕ В ХРОМАТОГРАФИЮ
.pdfФедеральное агентство по образованию
Московская государственная академия тонкой химической технологии имени М.В. Ломоносова
Кафедра аналитической химии
Туркельтауб Г.Н., Ищенко А.А.
ВВДЕНИЕ В ХРОМАТОГРАФИЮ
Учебное пособие
Москва
МИТХТ им. М.В.Ломоносова
2008
www.mitht.ru/e-library
ББК24.74.я7
УДК 543.544 Рецензент:
д.х.н., проф. Ларионов О. Г. (ИФХЭ РАН им.
А.Н.Фрумкина).
Рекомендовано к изданию кафедрой аналитической химии МИТХТ (протокол № от .03.08)
Туркельтауб Г.Н., Ищенко А.А.
ВВЕДЕНИЕ В ХРОМАТОГРАФИЮ
Учебное пособие.
М: МИТХТ им. М.В.Ломоносова, 2008 – 84с.:ил. Утверждено Библиотечным Издательским Комитетом МИТХТ им. М.В.Ломоносова в качестве учебного пособия. Поз.
Учебное пособие знакомит с основными методами
хроматографического анализа. Эти методы широко используются для качественного и количественного
анализа различных органических и неорганических
веществ. Хроматографические методы применяются при анализе пищевых продуктов, окружающей среды, лекарственных препаратов. Особое значение приобрели эти методы для контроля
производственных процессов. Достоинством этих
методов является высокая чувствительность, точность, экспрессность анализа.
Это учебное пособие предназначено для самостоятельной работы студентов по курсу физико-
химических методов анализа и выполнению практических лабораторных работ.
Пособие подготовлено на кафедре аналитической химии МИТХТ им. М.В.Ломоносова.
___________________________________________
© МИТХТ им. М.В.Ломоносова, 2008
www.mitht.ru/e-library
хроматограмм, приведенных на рис. 11 видно, что при
изотермическом режиме пики низкокипящих
компонентов “налезают” друг на друга. Пики
высококипящих компонентов сильно размыты. Из рисунка видно, что некоторые из этих пиков в изотермическом режиме не выходят из колонки вовсе. При программировании температуры (повышении температуры в ходе анализа) элюируют все высококипящие компоненты. При этом эти пики
становятся более узкими и симметричными (рис.11).
Введение
Хроматография была открыта русским ученым М.С. Цветом 1901-1906 годах при исследовании пигментов зеленого листа. При этом он получил ряд окрашенных зон. Он дал название этому методу хроматография (от
греческого слова chroma (chromatos) цвет + grapho - пишу).
Это открытие признано настолько важным, что по
оценке ЮНЕСКО достойно включения в десятку
величайших открытий ХХ века.
Хроматография – метод анализа веществ, основанный на распределении разделяемых компонентов между двумя
фазами: одна фаза неподвижная, другая — подвижная,
непрерывно протекающая через неподвижную фазу.
Можно дать и другое определение.
Хроматография - метод разделения смесей веществ или частиц, основанный на различии скоростей их перемещения по колонке в системе
несмешивающихся и движущихся относительно друг друга фаз.
1.1. Схема работы хроматографической колонки
Схема процесса разделения двух веществ в
хроматографической колонке показана на рис.1.
В хроматографическую колонку вводят очень небольшую
пробу анализируемой смеси. Вещество распределяется между двумя несмешивающимися
www.mitht.ru/e-library

где 2 и 1 – ширина пиков на половине высоты.
Рисунок 10. Оценка эффективности метода хроматографии числом разделений TZ, т.е. числом “условных” пиков, которое помещается между двумя пиками Для выделения высококипящих соединений в
дистилляции используется вакуум. В газовой хроматографии можно понизить температуру анализа
увеличением скорости газа-носителя, уменьшением толщины слоя неподвижной фазы, сокращением
длины колонки. Это позволяет анализировать
соединения с температурой кипения 700-800оС при
температуре анализа 350-400оС.
Если интервал температур кипения смеси
анализируемых веществ достигает более 100ºС, то время анализа резко возрастает. Из сравнения
www.mitht.ru/e-library
термической неустойчивости анализируемых веществ
и стационарных фаз имеются принципиальные
температурные ограничения. Так, при 350оС, исходя
из расчета энергии связи Si – C, должен происходить отрыв органических радикалов. Экспериментально установлено, что при температуре 370оС наблюдается разрыв Si – O – Si связи.
Помимо силиконов , термическая устойчивость которых достаточно высока, в справочниках и проспектах ведущих фирм, предлагающих материалы для хроматографии, предлагаются
стационарные фазы с температурным пределом от
120 до 250оС. В этом случае температура колонки должна быть понижена.
Из уравнения (26) следует, что при этом
значительно возрастет время удерживания.
Очевидно, что анализ, на который надо затратить много часов, нецелесообразен. На практике время
анализа всегда ограничено. Поэтому в
хроматографии число теоретических тарелок n
относят ко времени анализа. Соответственно RS
(смотри уравнение 19) следует разделитьна корень квадратный извремени анализа.
Хроматография обычно применяется при анализе сложных смесей, когда число компонентов в смеси
значительно превышает количество пиков на хроматограмме. При этом неважно насколько хорошо
делятся отдельные пики, а желательно оценить
какое максимально-возможное число пиков TZ.
(эффективное число пиков). TZ мы можем определить
на данной колонке (с известным числом теоретических тарелок).
tR |
tR |
1, |
(27) |
|
TZ |
2 |
1 |
||
|
1 |
|||
2 |
|
|
||
Рисунок 1. Схема разделения компонентов I и II в хроматографической колонке. Доля сечения колонки, занятая неподвижной фазой обозначена штриховкой. Долю сечения колонки, свободную для непрерывного прохождения газа-носителя - без штриховки.
фазами. Коэффициент распределения равен:
К = Сs /Cm, |
(1) |
где Сs и Cm – концентрации вещества в неподвижной и подвижной фазах.
Новые порции подвижной фазы, непрерывно поступающей в колонку, вызовут перераспределение
этих соединений между подвижной и неподвижной
фазами.
Вместе с потоком подвижной фазы вещества
анализируемой пробы будут двигаться по колонке. Хроматография обеспечивает многократность актов
перераспределения. Это позволяет выявить даже
малейшие различия в коэффициентах
распределения разделяемых веществ. При этом
вещества анализируемой пробы перемещаются по колонке с различной скоростью в соответствии с их коэффициентом распределения (Ki).
Будем условно считать, что колонка имеет 4 теоретические тарелки, то есть высота (длина)
каждой секции равна высоте теоретической тарелки. Теоретическая тарелка это гипотетическая зона,
высота которой соответствует достижению
равновесия между двумя фазами. Чем больше теоретитических тарелок тем эффективнее колонка. Теория теоретических тарелок была предложена для
описания процесса ректификации и была использована Мартином и Сингом для
www.mitht.ru/e-library
хроматографии. При этом были приняты некоторые
допущения: колонка состоит из некоторого числа
теоретитических тарелок; равновесие на каждой
тарелке считается достигнутым, до того как подвижная фаза переместится на следующую тарелку.
Примем, что коэффициент распределения K1 вещества I равен ½.
То есть концентрации вещества I в неподвижной
фазе CS относится к концентрации вещества I в подвижной фазе СM как 1/2, а для вещества II концентрации этого вещества в жидкой фазе
относится к его концентрации в газовой фазе как 2/1.
Впозиции 2 показано, что произошло
распределение этих веществ между подвижной
(газовой) и неподвижной (жидкой) фазами, согласно значений их коэффициентов распределения.
Впозиции 3 представлено, что потоком газаносителя вещества, которые остались в газовой фазе передвинуты во вторую теоретическую тарелку.
Из позиции 4 видно, что произошло распределение
этих веществ между подвижной (газовой) и неподвижной (жидкой) фазами. При этом в первой
тарелке вещества из неподвижной фазы переходят согласно коэффициенту распределения в подвижную.
Во второй тарелке вещества наоборот сорбируются
(растворяются), переходя из подвижной в неподвижную фазу.
Впозиции 5 показано, что потоком газа-носителя вещества, которые остались в газовой фазе передвинуты из первой теоретической тарелки во
вторую, а из второй на третью теоретической тарелки.
Впозиции 6 мы видим, что произошло распределение этих веществ между подвижной и
Если числитель и знаменатель отношения u/VL
разделим на площадь поперечного сечения колонки S, то
получим: |
|
|
|
||
4.6 |
TK |
lg |
u |
lgt C |
(26a) |
|
|
||||
|
T |
L |
|
||
гдеu – средняя линейная скорость газа-носителя; VL - объем жидкой фазы(VL = VS); L - длина колонки;
- толщина слоя жидкой фазы; C – постоянная.
Это уравнение позволяет связать параметры хроматографического опыта с термодинамическими
характеристиками вещества и, в частности с
температурой кипения. Если анализируемые вещества низкокипящие, то необходимо либо
понижать температуру колонки, либо увеличивать
количество неподвижной фазы. В случае высококипящих веществ, для элюирования их при времени удерживания t, можно повысить
температуру колонки, уменьшить процент неподвижной фазы, сократить длину колонки,
увеличить линейную скорость газа-носителя. Кроме того, необходимо повысить температуру испарителя,
детектора и т.д.
При повышении температуры колонки возникает проблема термической устойчивости анализируемых соединений и стационарных фаз, используемых в
газожидкостной хроматографии. Причем, на термостойкость влияет материал испарителя и колонки, присутствие тех или иных примесей в
твердом носителе и неподвижной фазе, состав анализируемой смеси. Кроме этих причин
www.mitht.ru/e-library
кипения повышается от -161ºС для метана до более
чем 800ºС для углеводорода C120H242. Соответственно, возникает вопрос: как
проанализировать все эти соединения одновременно в одних и тех же условиях?
Для этого рассмотрим влияние
хроматографических параметров на объем удерживания.
Коэффициент распределения K зависит от величины свободной энергии растворения, F0 и температуры колонки, Т:
|
F |
0 |
|
|
|
|
|
|
, |
(23) |
|
|
|
||||
K C exp |
RT |
|
|
||
|
|
|
|
|
|
где R - универсальная газовая постоянная; C –
безразмерная постоянная.
Если принять F Q - теплоте растворения, то,
выражая теплоту растворения через температуру
кипения по правилу Трутона (Q 21TK;
R = 1,99 2,0 кал/моль град), получим следующее
соотношение
lgK lgC' |
Q |
lgC' |
21TK |
|
lgC' |
4,6TK |
(24) |
|
|
|
|||||
i |
2.3RT |
|
2.32 T |
|
T |
|
|
|
|
|
|
||||
Подставим значения приведенного удерживаемого |
|||||||
объема из уравнения (21) в уравнение (22): |
|
||||||
|
|
Vs K = uср t. |
(25) |
||||
t - приведенное время удерживания.
Теперь прологарифмируем это уравнение и подставим в левую часть значение Kиз соотношения (23) , и получим уравнение:
|
T |
ucp |
lgt C |
|
|
4.6 |
K |
lg |
|
(26) |
|
|
|
||||
|
T |
VL |
|
||
|
|
|
|||
неподвижной фазами. При этом в первой и второй
тарелках вещества из неподвижной фазы переходят
согласно коэффициенту распределения в подвижную.
В третьей тарелке вещества из подвижной переходят в неподвижную фазу.
В позиции 7 показано, что потоком газа-носителя
вещества, которые остались подвижной фазе
передвинуты из первой теоретической тарелки
во вторую, из второй на третью теоретическую
тарелку, а из третьей на четвертую теоретическую тарелку.
В позиции 8 представлено, что вновь произошло распределение этих веществ между подвижной и неподвижной фазами. При этом в первой, второй и
третьей тарелках вещества из неподвижной фазы
переходят согласно коэффициентам распределения в подвижную. В четвертой тарелке вещества,
наоборот, из подвижной переходят в неподвижную
фазу. Соединения, которые остались в газовой фазе на четвертой тарелке, покидают колонку и их концентрация фиксируется детектором.
С помощью детектора (прибора записывающего изменение концентрации в подвижной фазе), мы
увидим картину разделения двух пиков, которая
получила название хроматограммы. Хроматограмма представляет зависимость сигнала детектора от объема пропущенного элюента (времени
анализа). Профиль гауссовской кривой на
хроматограмме получили название
хроматографического пика.
Таким образом, на выходе из колонки мы получим хроматограмму, состоящую из двух пиков (рис.2).
Если в шприце оказался пузырек воздуха, то мы увидим три пика.
www.mitht.ru/e-library
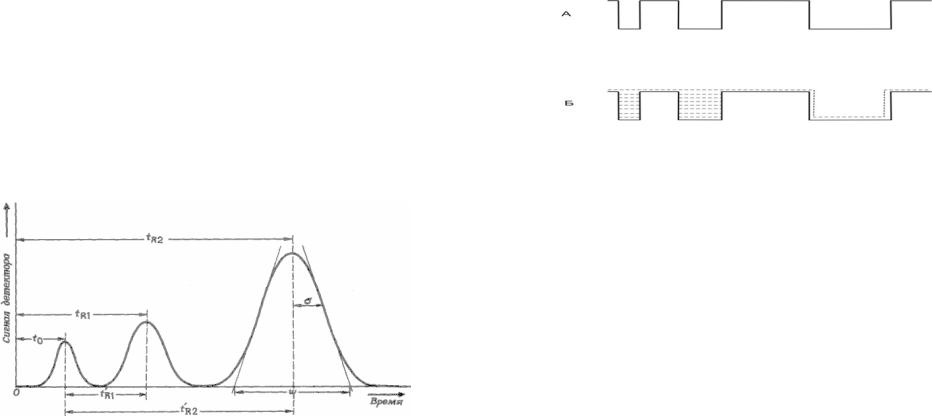
Время выхода (элюирования) вещества из колонки называют временем удерживания tR.
Время удерживания воздуха to, (или другого
вещества, которое вообще не удерживается неподвижной фазой) называют мертвым временем. Оно представляет собой время нахождения его в
подвижной фазе. Фактически это время, которое
затрачивает молекула подвижной фазы на прохождение всего пути вдоль колонки.
Если из времени удерживания tR вычесть to, то
мы получим приведенное время удерживания t.
t = tR - to (2)
На выходе из колонки сначала появится компонент, коэффициент распределения которого равен 0, а последним выйдет соединение с наибольшим коэффициентом распределения.
Рисунок 2. Аналитическая хроматограмма. Пик на хроматограмме с временем удерживания tо соответствует соединению, которое не сорбируется неподвижной фазой и имеет коэффициент распределения K = 0. Второй пик с временем удерживания tR1 соответствует соединению с K = 0,5.Третий пик с tR2 соответствует соединению с K = 2,0.
сожалению, диатомитовые твердые носители
содержат ряд примесей, которые приводят к
образованию «хвостов» (смотри рис. 6) и сдвигу
времен удерживания, характерному для выпуклой изотермы адсорбции.
Рисунок 9. Модель заполнения твердого носителя неподвижной жидкой фазой. А – поверхность твердого носителя без неподвижной жидкой фазы. Б – поверхность твердого носителя, покрытая неподвижной жидкой фазой.
Для уменьшения влияния этого фактора диатомитовые твердые носители промывают
кислотой и обрабатывают гексаметилдисиланом или
диметилдихлорсиланом.
Понятно, что для различных твердых носителей, отличающихся по величине площади удельной поверхности, одинаковая степень пропитки приводит
к различным временам удерживания. Чтобы иметь возможность сравнения сорбентов на различных
твердых носителях, вводится концепция толщины
слоя (пленки) неподвижной фазы. Толщины «пленки» рассчитывается делением объема жидкой фазы на
площадь поверхности используемого твердого носителя.
Газовая хроматография позволяет установить, например, состав фракции нефти, содержащей
несколько сотен компонентов. При этом температура
www.mitht.ru/e-library
сорбента. Выбор степени пропитки зависит от
особенностей решаемых задач и твердого носителя.
Наибольшее распространение получили твердые
носители на основе «диатомитов», которые образовались в результате отмирания одноклеточных диатомитовых водорослей. Для анализа высококипящих соединений используется малый процент неподвижной фазы - 5% (а иногда 3 и даже 1%). Часто на упаковках с таким сорбентом
ставится надпись: «для высокотемпературной
хроматографии».
Вообще, можно нанести на твердый носитель
практически любое количество жидкой фазы, но обычно степень пропитки составляет от 3 до 25%. Сам процесс приготовления сорбента для газожидкостной хроматографии предельно прост.
Сначала взвешивают требуемое количество жидкой
фазы и твердого носителя. Взвешенное количество жидкой фазы (обычно несколько грамм) растворяют в 50-100 мл низкокипящего растворителя. Готовый раствор выливают в «выпаривательную» чашку. Туда же помещают взвешенный твердый носитель так,
чтобы полученный раствор полностью покрывал его
поверхность. Затем при слабом нагревании и медленном перемешивании ждут полного испарения
растворителя. Спустя некоторое время, после того
как приготовленный сорбент вновь приобрел «сыпучесть», его можно засыпать в колонку.
Поверхность твердого носителя представляет
собой набор узких и широких пор, заполненных жидкостью и участков поверхности, где жидкая фаза вовсе отсутствует (рис. 9).
Твердый носитель должен быть инертным, сохраняя при этом большую удельную поверхность. К
1.2 Основные виды и варианты хроматографии Любая хроматографическая система включает подвижную и неподвижную фазы,
хроматографическую колонку (пластинку в планарной хроматографии), в которой происходит процесс разделения веществ.
Классификация методов хроматографии очень многообразна и может быть проведена на основании:
агрегатного состояния подвижной фазы хроматографической системы: газовая, жидкостная, сверхкритическая флюидная;
используемой неподвижной фазы: газо-
твердофазовая, газо-жидкостная, жидкостно-твердофазовая, жидкостножидкостная, флюидно-твердофазовая;
способа перемещения сорбата:
фронтальная, когда разделяемая смесь
подается в колонку непрерывно; элюентная (элютивная, проявительная), когда разделяемая смесь подается в колонку
периодически, а элюент - непрерывно, причем элюент удерживается в колонке
слабее наименее удерживаемого компонента. Сегодня более 99% всех
анализов проводится элюентной
хроматографией.
механизма разделения веществ:
адсорбционная, распределительная, ситовая (эксклюзионная), ионообменная, лигандообменная, аффинная
(биоселективная);
цели разделения: аналитическая,
www.mitht.ru/e-library
препаративная, промышленная
хроматография;
конфигурации разделяющей системы
различают: колоночную, планарную (тонкослойную и бумажную) хроматографию.
В таблице 1 приведена классификация
хроматографии в зависимости от агрегатного состояния фаз.
Таблица 1. Варианты хроматографии в зависимости от агрегатного состояния фаз
Подвижная |
Неподвижная |
Наименование |
фаза |
фаза |
|
ГАЗ |
АДСОРБЕНТ |
ГАЗО-АДСОРБ- |
|
|
ЦИОННАЯ |
ГАЗ |
ЖИДКОСТЬ |
ГАЗОЖИД- |
|
|
КОСТНАЯ |
ЖИДКОСТЬ |
АДСОРБЕНТ |
ЖИДКОСТНО- |
|
|
АДСОРБ- |
|
|
ЦИОННАЯ |
ЖИДКОСТЬ |
ЖИДКОСТЬ |
ЖИДКОСТНО- |
|
|
ЖИДКОСТНАЯ |
ВЕЩЕСТВО |
АДСОРБЕНТ |
ФЛЮИДНО- |
В |
|
АДСОРБ- |
СВЕХКРИТИ- |
|
ЦИОННАЯ |
ЧЕКОМ |
|
|
СОСТОЯНИИ |
|
|
ВЕЩЕСТВО |
ЖИДКОСТЬ |
ФЛЮИДНО- |
В |
|
ЖИДКОСТНАЯ |
СВЕХКРИТИ- |
|
|
ЧЕКОМ |
|
|
СОСТОЯНИИ |
|
|
Объектами хроматографического разделения являются различные смеси соединений, которые
5 Газовая хроматография
Бурное развитие газовой хроматографии началось
с 1952 года, после того как Мартин и Джеймс осуществили газожидкостной вариант, использовав смешанную неподвижную фазу, состоящую из стеариновой кислоты и полиметилфенилсилоксана.
Это позволило сразу включить широкий набор
жидкостей вместо ограниченного круга адсорбентов. Кроме того, линейность изотермы распределения анализируемых веществ (постоянство времени удерживания) позволило проводить надежную
идентификацию даже очень сложных смесей.
Примерно в это же время целый ряд фирм начал серийный выпуск газовых хроматографов. Принципиальная схема хроматографической
установки приведена на рис.7.
5.1 Газожидкостная хроматография.
Разделение анализируемой смеси в ГХ
происходит |
за |
счет |
различия |
констант |
распределения K1 |
и K2, как это показано, например, |
|||
на рис.1. При этом приведенный объем |
||||
удерживания, |
V’R |
прямо |
зависит от |
количества |
жидкой фазы Vs в колонке. |
|
|
||
Приведенный объем удерживания получается, если |
||||
из объем удерживания VR вычесть мертвый объем VM. |
||||
VR’ = VR - VM = VS K , |
(21) |
|||
где K - коэффициентом распределения. |
|
|||
Объем удерживания VR определяется: |
|
|||
VR = uср tR , |
|
(22) |
||
uср – объемная скорость газа-носителя.
Для сорбентов насадочных колонок количества
жидкой фазы получило название степени пропитки и
задается как процент жидкой фазы от веса всего
www.mitht.ru/e-library
