
385
.pdf
МИНИСТЕРСТВО ОБЩЕГО И ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
МОСКОВСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ ТОНКОЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ им. М.В. ЛОМОНОСОВА
Кафедра физической химии
В.А.Тюриков, Ж.Е.Грабовская, О.Г.Леванда
ХИМИЧЕСКАЯ КИНЕТИКА
Учебно--методическое пособие
МОСКВА
1999
www.mitht.ru/e-library
УДК 541.124
Рецензент: доц. И.А. Лыгина
Тюриков В.А., Грабовская Ж.Е., Леванда О.Г.
Химическая кинетика. Учебнометодическое пособие. 28 страниц. Рис. 8, табл. 7.
Учебно-методическое пособие включает в себя описание лабораторных работ по химической кинетике для студентов дневного и вечернего факультетов. В работах по возможности дано описание приборов, используемых при выполнение работ.
Утверждено БИК МИТХТ им. М.В.Ломоносова
МИТХТ им. М.В.Ломоносова
МОСКВА
1999
2
www.mitht.ru/e-library
КИНЕТИКА РЕАКЦИИ РАЗЛОЖЕНИЯ МУРАВЬИНОЙ КИСЛОТЫ
1.Теоретические основы работы Целью данной работы является изучение кинетики разложения му-
равьиной кислоты в концентрированной серной кислоте и определение кинетических параметров: константы скорости и периода полураспада при разной температуре, а также энергии активации.
Муравьиная кислота в концентрированных растворах сильных кислот (серной, фосфорной ,хлорной) разлагается по уравнению:
HCOOH = CO + H2O
Реакция протекает по механизму специфического протонного катализа: в первой стадии ее происходит обратимое, достигающее равновесия в условиях опыта, протонирование муравьиной кислоты:
HCOOH + H HCOOH2 |
(1) |
Скорость определяющей стадией (лимитирующей) является дегидратация протонированной частицы с образованием иона карбония, затем следует быстрое отщепление протона от карбкатиона:
HCOOH2 HCO + H2 O
HCO H + CO
Скорость реакции пропорциональна концентрации протонированных молекул, которая определяется равновесием (1), т.е. зависит от концентрации муравьиной кислоты и протонирующей способности среды, характери-
зуемой кислотностью Гаммета (ho |
): |
r= k K CHCOOH ho |
(1) |
где ho -кислотность Гаммета,
K - константа равновесия стадии протонирования, k - константа скорости лимитирующей стадии.
В условиях опыта количество муравьиной кислоты очень мало по сравнению с количеством серной кислоты, поэтому можно пренебречь изменением протонирующей способности среды за счет выделения Н2 0 в ходе реакции. Кислотность Гаммета будет практически постоянной в условиях эксперимента. Таким образом, скорость реакции оказывается зависящей только от концентрации муравьиной кислоты и кинетика реакции будет описываться уравнением первого порядка.
3
www.mitht.ru/e-library
Кинетику реакции разложения муравьиной кислоты удобно изучать, измеряя объемы оксида углерода (х), выделившегося к моменту времениили измеряя время, за которое выделится определённый объём СО. Для этого используется прибор, изображенный на рис.1. Он состоит из
1)реактора с термостатируемой рубашкой для проведения опытов при температурах отличающихся от комнатной,
2)вибратора с регулируемой частотой встряхивания.
3)напорного резервуара, в который отбирается СО,
4)бюретки для измерения объёма выделившегося СО,
5)манометра для выравнивания давления в резервуаре с атмосфер-
ным,
6)термостата .
Интенсивное встряхивание реакционной колбы необходимо, чтобы скорость процесса не лимитировалась диффузией образовавшегося оксида углерода из жидкой в газообразную фазу. Для этого в реактор помещают стеклянные шарики или спирали. В таких условиях константа скорости реакции может быть рассчитана по уравнению:
k = |
1 |
ln |
a |
, |
(2) |
|
t |
a - x |
|
||
где а - общий объем оксида углерода, выделившегося при полном разложении муравьиной кислоты.
2.Экспериментальная часть
2.1.Подготовка к первому опыту.
Установите в термостате температуру 15-20 С. Реактор (1) с 50 мл серной кислоты укрепите во встряхивающем устройстве (2). Через 10 мин., необходимых для термостатирования реакционной массы, внесите пипеткой в реактор 0,3 мл муравьиной кислоты. Включите встряхиватель на 0,5 мин. для растворения НСООН в серной кислоте. Присоедините реактор шлангом к напорному резервуару (3) и включите вибратор. Перед началом измерений отберите в бюретку (4) небольшое количество воды из напорного резервуара для создания разрежения в системе (5-10 см водяного столба по манометру 5).Воду из бюретки сразу же слейте до нижнего деления (объем воды в этом случае измерять не нужно).Когда в результате выделения оксида углерода уровни в манометре сравняются,
включите секундомер. Этот момент принимают за начало опыта. Секундомер не выключайте до конца опыта.
4
www.mitht.ru/e-library
2.2. Проведение измерений
Вариант А.
Объемы выделившегося оксида углерода измеряйте через равные промежутки времени. Величина этого интервала времени выбирается таким образом, чтобы в первом замере объем выделившегося газа был не менее 20-30 мл. Для этого в измерительную бюретку отбирайте понемногу воду из системы, приоткрывая кран так, чтобы уровни в манометре всё время были примерно одинаковы. Через определённый интервал времени (лучше выбрать его целочисленным 1,2,3 и т.д. или полуцелым 0,5 мин) уровни в манометре выровняйте точно и закройте кран на резервуар. Измерьте объем воды в бюретке и слейте ее из бюретки до нижнего деления. (Поскольку вода поступает в нижнюю часть бюретки, для определения ее объема необходимо вычесть из полного объема бюретки отсчет уровня воды и записать полученный объем). После этого приступайте к новому замеру. Замеры ведите до тех пор, пока в течение выбранного интервала времени не будет выделяться менее 2-3 мл.
Вариант Б.
Измеряется время , за которое выделится определённый объём газа. Из напорного резервуара в измерительную бюретку отберите определённый объём воды ( 10 или 20 мл). При этом в резервуаре создастся небольшой вакуум и возникнет разность уровней манометра . Эта разность будет уменьшаться за счёт выделения СО в ходе реакции и в момент уравнивания уровней манометра количество выделившегося СО будет равно объёму отобранного в бюретку объёма воды. Этот момент определить по секундомеру и записать в таблицу. Слить воду из бюретки до нижнего деления и вновь отобрать из резервуара выбранный объём воды и вновь определить время выравнивания уровней в манометре. По мере протекания реакции скорость её будет замедляться и поэтому в дальнейшем объёмы отбираемой воды надо уменьшить. Измерения проводить до тех пор , пока на выделение 5 мл газа будет требоваться более 15 мин.
2.3. Подготовка к новому опыту По окончании первого опыта с помощью контактного термометра
поднимите температуру в термостате на 6-8 С. Через 10 мин. термостатирования при новой температуре добавьте в реактор новую порцию муравьиной кислоты (0,5 мл) и повторите при этой температуре опыт.
Результаты измерений внесите в таблицу.
t, |
мин,сек |
Уровень |
в |
ОбъёмСО |
Объём |
от |
(а-х),мл |
ln (а-х) |
k, мин-1 |
от |
начала |
бюретке, |
. |
за время |
начала |
|
|
|
|
опыта |
мл |
|
замера,мл |
опыта, |
мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
www.mitht.ru/e-library
х- объём СО к моменту времени t; а- объём СО при полном разложении НСООН.
3. Обработка экспериментальных данных Для расчета константы скорости реакции по уравнению (2) необходи-
мо знать объем оксида углерода, который выделяется при полном разложении муравьиной кислоты (точка а на рис. 3), пропорциональный начальному количеству НСООН. Эту величину можно измерить экспериментально, дождавшись конца реакции, однако для этого требуется длительное время. Поэтому удобнее использовать метод обработки данных, который позволяет для реакции 1-го порядка избежать необходимости достигать конца реакции. Суть метода состоит в следующем. Согласно материальному балансу, количество муравьиной кислоты в любой момент времени пропорционально разности объемов (а-х). В соответствии с кинетическим уравнением 1-го порядка, эта величина равна:
С=С0 e kt ; |
а - хt = а e kt |
Для момента времени t+b выражение аналогично:
a - xt b = a e k(t b)
Поделив одно уравнение на другое, получим:
а - хt = |
(a - xt b ) ekb |
|
xt = a (1 |
- ekb ) + xt b ekb |
(3) |
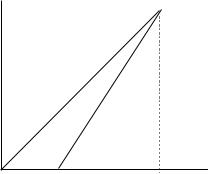
Если проводить измерения через одинаковый промежуток времени b , то уравнение (3) становится линейным в координатах xt — xt b . Если на графике найти точку, где абсцисса равна ординате , то она будет соответствовать начальному количеству муравьиной кислоты (а), как это следует из уравнения (3).
Для построения такого графика нужно использовать попарно результаты двух последовательных замеров: первый и второй ,второй и третий и т.д. Проведя биссектрису 0А, найдите на пересечении ее с прямой
точку, отвечающую величине а. Используя полученное значение а, определите для каждого момента времени величины а-х и ln(а-х). Постройте график зависимости ln(а-х) от времени, определите по нему константу скорости.
6
www.mitht.ru/e-library
xt |
|
a |
xt+ t |
Рис.2 |
|
Постройте график зависимости (а-х) от времени, найдите по нему несколько значений времени полупревращения и убедитесь, что время полупревращения не зависит от начального количества реагента. Рассчитайте константу скорости по среднему значению этого времени.
По температурной зависимости константы скорости рассчитайте энергию активации данной реакции.
E |
A |
|
R T1 T2 |
ln |
k2 |
, |
||
|
|
|||||||
|
|
T |
- T |
|
k |
1 |
|
|
|
|
2 |
1 |
|
|
|
||
где k1 и k2 — константы скорости реакции при температурах Т1 и Т2 .
7
www.mitht.ru/e-library
ИЗУЧЕНИЕ КИНЕТИКИ ГИДРАТАЦИИ УКСУСНОГО АНГИДРИДА
1. Теоретические основы работы
Реакция гидратации уксусного ангидрида в разбавленном водном растворе протекает как реакция 1-го порядка и практически до конца по уравнению :
(СН3СО)2 + Н2О = 2 СН3СООН
В данном случае измерение скорости удобно вести по изменению электропроводности раствора во времени. Метод удобен тем, что допускает непрерывное наблюдение за ходом реакции без взятия проб. Электропроводность раствора возрастает со временем вследствие образования уксусной кислоты.Зависимость электропроводности и сопротивления раствора от концентрации уксусной кислоты следует из теории слабых электролитов Аррениуса. Концентрация уксусной кислоты обратно пропорциональна квадрату сопротивления:
С = |
А |
, |
|
R2 |
|||
|
|
где с - концентрация кислоты, R- сопротивление раствора, А -постоянная в условиях опыта величина.
Исследуемая реакция является реакцией первого порядка, поэтому расчеты константы скорости ведутся по уравнению :
1 |
|
Co |
|
|
k = |
|
ln |
|
, |
|
|
|||
Co - Cx
где Co - начальная концентрация уксусного ангидрида,
Cx- убыль концентрации ангидрида к данному моменту времени,- время от начала реакции.
Так как концентрация реагентов в опыте определяется через сопротивление раствора, то соответственно при расчетах будут использоваться величины:
Ro- сопротивление раствора в момент начала измерений, Rc- сопротивление в данный момент,
R - сопротивление после окончания реакции.
Возрастание концентрациии уксусной кислоты за все время реакции будет
равно |
CCH3COOH |
= A ( |
1 |
- |
1 |
) |
|
R2 |
R02 |
||||||
|
|
|
|
|
8
www.mitht.ru/e-library
Количество образовавшейся уксусной кислоты пропорционально количеству введенного в раствор уксусного ангидрида:
Co |
= |
C CH |
3COOH |
|
A |
1 |
1 |
|
1 |
|
1 |
|
||
|
|
= |
|
( |
|
- |
|
) = B ( |
|
- |
|
) . |
||
2 |
|
|
|
Ro2 |
R2 |
|
||||||||
|
|
|
|
2 R2 |
|
|
|
R2O |
||||||
По аналогии можно записать :
Сx |
= B ( |
1 |
|
- |
1 |
) , |
|
||||||||||
R2 |
R2O |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
CO |
- Cx |
= B ( |
1 |
|
|
- |
|
|
1 |
) , |
|||||||
|
|
|
R2O |
||||||||||||||
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
|
||||
|
|
|
|
1 |
|
- |
1 |
|
|
|
|
|
|||||
k = |
|
1 |
ln |
|
|
R2 |
|
Ro2 |
|
|
. |
|
|||||
|
|
|
|
|
|
|
|
||||||||||
|
|
1 |
|
|
|
1 |
|
|
|||||||||
|
|
|
|
- |
|
|
|
|
|
||||||||
|
|
|
|
|
|
R2 |
|
R2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
2.Экспериментальная часть
Всосуд для измерения электропроводности наливают мерным цилиндром 25 мл дистиллированной воды и ставят его в термостат на 10-15 мин, в термостат помещают и колбу с уксусным ангидридом. По истечении указанного времени в сосуд добавляют рекомендованное преподавателем количество уксусного ангидрида. Раствор тщательно перемешивают стеклянной палочкой до полного растворения уксусного ангидрида. (От начала растворения до первого измерения сопротивления раствора обычно проходит 1-2 мин).
Убедившись в полноте растворения уксусного ангидрида, опускают электроды в раствор и измеряют электропроводность, включив в этот момент секундомер. Измерение электропроводности проводится на автоматических цифровых приборах (Е-7-8, Р-5010) в ручном (нажатие кнопки "пуск") режиме, с интервалом 1 мин. Измерения проводят 1,5-2 часа до постоянного значения R .
Результаты измерений записывают в таблицу.
Вре- |
|
|
|
1 |
|
1 |
|
1 |
1 |
|
|
||
мя, , |
R |
1/R 2 |
|
|
- |
|
|
ln( |
|
|
|
) |
k |
R2 |
R2 |
R2 |
R2 |
||||||||||
мин. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
www.mitht.ru/e-library
Обработка экспериментальных данных
3.1. Постройте график в координатах ln( |
1 |
|
1 |
) - . Экспериментальные |
|
R2 |
R2 |
||||
|
|
|
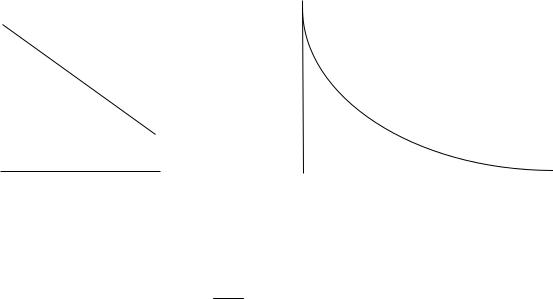
данные в этих координатах должны укладываться на прямую, тангенс угла наклона этой прямой равен k (рис.1).
3.2. Вычислите по уравнению (3)константу скорости реакции для каждого момента ,определите ее среднее значение и сравните с величиной k, полученной графически.
3.3. Постройте график зависимости концентрации уксусного ангидрида от времени (рис.2) .По оси ординат вместо концентрации ангидрида можно отложить пропорциональную ей величину ( 1/R 2 -1/R 2 ).
|
1 |
|
1 |
|
|
1 |
|
1 |
|
||||
ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
|
||||||||
|
|
|
Rt2 |
|
|||||||||
R |
|
Rt |
|
|
R2 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
t |
Рис. 1. Рис. 2.
3.4. Графически определите время полураспада и рассчитайте константу скорости реакции по формуле:
k = ln2
1/2
3.5. По двум константам скорости при двух температурах рассчитайте по уравнению Аррениуса величину энергии активации для данной реакциии.
E |
A |
|
R T1 T2 |
ln |
k2 |
, |
||
|
|
|||||||
|
|
T |
- T |
|
k |
1 |
|
|
|
|
2 |
1 |
|
|
|
||
где используются константы скорости реакции при двух температурах.
10
www.mitht.ru/e-library
