
Вариант задач по кинетики_бе
.pdf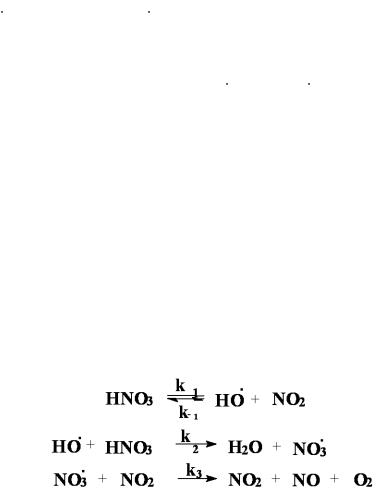
|
|
11 |
|
|
|
|
С NO2,105 , моль/л |
4,47 |
5,01 |
6,31 |
7,94 |
10 |
12,59 |
r , моль/(л,сек) |
0,032 |
0,040 |
0,063 |
0,095 |
0,158 |
0,214 |
6. Константа скорости разложения пентоксида диазота
N2O5 = 2 NO + O2
равна 0,079 10-5с-1 при 00С и 12,9 10-5с-1 - при 350С. Рассчитайте энергию активации
ивеличину предэкспоненциального множителя.
7.Для реакции разложения диоксида азота 2NO2 = 2NO + O2 предэкспоненциальный множитель уравнения Аррениуса равен 3 109 л/(моль с). Рассчитайте стерический фактор этой реакции, если газокинетический диаметр молекулы диоксида азота равен 3,6  , а температура 500 К.
, а температура 500 К.
8.Для следующей схемы сложной реакции:
k1
A+D = X +2C
k-1
k2
X +C → Пр
где Х , Y промежуточные высокореакционные реагенты
Используя метод квазистационарных концентраций по Х и Y выведите кинетическое уравнение реакции по реагенту С.
9.Реакция термического разложения азотной кислоты при 4000С описывается уравнением 2HNO3 = H2O + O2 + NO2 + NO и протекает по механизму
Выведите уравнение скорости расходования азотной кислоты в квазистационарном режиме. Как изменится порядок реакции по реагенту по мере увеличения степени конверсии? Какой из продуктов оказывает тормозящее действие?
10.
Вариант 6.
1. Разложение мочевины в кислой среде имеет первый порядок по мочевине в избытке кислоты и воде:
H2NCONH2 + H+ + 2H2O = 2NH4+ + HCO3−
При начальной концентрации мочевины равной 0,2 М скорость реакции составляет 8,56,10-5 моль/(л,с) при t =61ºС, Определите константу скорости, концентрацию реагента через 5000 с, а также скорость реакции в этот момент,
2, Изменение концентрации метильных радикалов 2СН3 = С2Н6 изучали с помощью флеш-фотолиза (мгновенных вспышек), Были получены
следующие данные:

12
Время, мкс |
|
0 |
10 |
20 |
30 |
40 |
50 |
|
|
|
|
|
|
|
|
[CH3∙],106, |
М |
1,25 |
0,95 |
0,80 |
0,65 |
0,57 |
0,50 |
|
|
|
|
|
|
|
|
Определите порядок реакции и значение константы скорости,
3, Реакция разложения пентоксида диазота в газовой фазе протекает по уравнению:
N2O5 = 1/2 O2 + N2O4
Кинетику этого процесса изучали, измеряя увеличение общего давления (ΔР = Робщ,– Р0) в реагирующей системе в определенные моменты времени при V=const, При 328,1 К были получены следующие данные:
, мин |
3 |
5 |
7 |
9 |
12 |
18 |
26 |
38 |
∞ |
Р, мм рт,ст, |
73 |
116 |
152 |
183 |
218 |
266 |
299 |
320 |
331 |
Каков порядок реакции, среднее значение константы скорости и период полураспада?
4, Время разложения для двух различных соединений РН3 (1) и N2О (2) на 50% при
различных исходных давлениях приводится ниже: |
|
||
1 |
РоРН3, мм рт,ст, |
139 |
52,5 |
|
1/2, с |
84 |
83 |
2 |
РоN2O,мм рт,ст, |
79 |
37,5 |
|
1/2, с |
470 |
860 |
Определите порядок обеих реакций,
5. Для реакции разложения ацетальдегида в газовой фазе:
Н3ССНО = СН4 + СО
изучена зависимость начальной скорости от давления ацетальдегида
Рсн3сно0·10-4, Па |
0,88 |
1,08 |
1,6 |
2,93 |
3,49 |
5,05 |
r0, Па/мин |
110 |
151 |
263 |
700 |
810 |
1397 |
Определите порядок реакции и константу скорости .
6. Найдите энергию активации реакции и предэкспоненциальный множитель уравнения Аррениуса для реакции взаимодействия оксида углерода с диоксидом азота:
CO + NO2 = CO2 + NO
Т, К 600 650 700 750 800
k, л/(моль.с) 0,028 0,22 1,3 |
6,0 |
2,3 |
7.Диаметр метильного радикала равен 3,8 10-10 м. Какова гипотетическая максимальная константа скорости реакции второго порядка для рекомбинации радикалов при комнатной температуре. Трансмиссионный коэффициент принять равным 1, а энергию активации - 3 кДж/моль.

13
8. Для следующей схемы сложной реакции:
k1
A + С = X +D
k-1
k2
X +A → Y + C
k3 Y + D → P
где Х , Y промежуточные высокореакционные реагенты
Используя метод квазистационарных концентраций по Х и Y выведите кинетическое уравнение реакции по реагенту А.
9.Для реакции гомогенного пиролиза этана, протекающей по следующему основному маршруту C2H6 = C2H4 + H2 , предложен следующий механизм:
C2H6 |
+ C2H6 |
k |
0 |
2CH |
|
+ |
C2H6 |
|
|
|
3 |
||||||
|
|
k |
|
|
|
|
||
CH3 + C2H6 |
1 |
CH4 |
|
+ C2H5 |
||||
|
|
|
||||||
|
|
k 2 |
|
|
|
|
||
|
C2H5 |
|
|
C2H4 |
+ |
H |
||
H |
+ C2H6 |
k3 |
C2H5 |
+ H2 |
||||
k 4 |
||||||||
|
2 C2H5 |
C4H10 |
|
|||||
|
|
|
|
|||||
Выведите кинетическое уравнение образования этилена, используя метод квазистационарных концентраций. Каков порядок реакции по реагенту в этом уравнении? Тормозится ли реакция продуктами? Есть ли в механизме лимитирующая стадия?
10.
Вариант 7.
1.Разложение пентоксида диазота N2О5 является реакцией первого порядка, Если в системе давление N2O5 через 10 мин составляло 69,2 мм.рт.ст., а через 30 мин 39,6 мм.рт.ст, то какова константа скорости реакции?
2.Реакция кислотного распада бис- -аллилникеля в водных растворах описывается следующим стехиометрическим уравнением:
( -С3Н5)2Ni + H3O+ = 2C3H6 + H2O + Ni2+
Начальные концентрации комплекса и кислоты соответствуют и равны 0,00500 и 0,0100 моль/л, Изменение концентрации H3O+ во времени при 110С характеризуется следующими значениями:
Время, мин |
0 |
20 |
30 |
40 |
50 |
60 |
[HCl] 102, моль/л |
1,000 |
0,3460 |
0,1499 |
0,1168 |
0,0957 |
0,0810 |
Подтвердите выполнимость второго порядка реакции и рассчитайте значение константы скорости,

14
3. Дитретбутилпероксид при 154,90С распадается по уравнению
(CH3)3COOC(CH3)3 2(CH3)2 С=O + C2H6
Составьте материальный баланс по каждому реагенту, определите порядок реакции и время полураспада из следующих данных по изменению общего давления в системе:
, мин |
0 |
2 |
5 |
6 |
8 |
9 |
14 |
15 |
Робщ, мм.рт.ст |
169,3 |
188,3 |
201,1 |
207,1 |
218,7 |
224,4 |
250,3 |
255,2 |
4.Изучалась зависимость скорости реакции димеризации бутадиена в газовой фазе от начальной концентрации бутадиена,
2 С4Н6 = С8Н12
При 240О С получены следующие данные:
Со, моль/л |
0,05 |
0,1 |
0,15 |
0,20 |
rо, 104, моль/(л,,мин,) |
0,565 |
2,26 |
5,07 |
9,02 |
5.Термический распад диоксана изучался при температуре 504О С, При начальном
давлении диоксана 800 мм.рт.ст, его концентрация уменьшалась вдвое за 15,8 минут, а при начальном давлении 400 мм.рт.ст. _ за 22,3 мин, Определите порядок реакции и рассчитайте константу скорости реакции.
6.Реакция первого порядка прошла на 30% при 250С за 30 мин, а при 400С - за 5 мин. Определите энергию активации и предэкспоненциальный множитель уравнения Аррениуса.
7.Димеризация бутадиена в газовой фазе является реакцией 2-го
порядка
|
CH 2 |
|
|
|
|
|
CH 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
CH 2 |
|
|
CH |
|
|
CH2 |
||||
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
CH |
|
|
CH |
|
CH |
|||||
|
|
|
|
|
|
|
|||||
|
CH 2 |
|
CH |
CH 2 |
CH 2 |
|
CH |
|
CH 2 |
||
|
|
|
|||||||||
Эффективный диаметр молекул бутадиена равен 5,5.10-10 м. В таблице даны значения констант скорости реакции димеризации бутадиена в зависимости от температуры:
Т, К |
503 |
513 |
527 |
540 |
578 |
622 |
k, 103, л/(моль с) |
0,531 |
0,715 |
1,40 |
2,43 |
9,85 |
44,5 |
Вычислите энергию активации и значение предэкспонента уравнения Аррениуса. Рассчитайте значение предэкспонента при 600 К по теории столкновений и сопоставьте его с опытным значением. К какому типу (―нормальные―, ―медленные― или ―быстрые―) относится рассматриваемая реакция?
8.Для разложения перекиси водорода на катализаторе Pt/SiO2 В.П. Лебедев предложил следующий механизм:
2H2O2 +Pt = PtO2 +2H2O |
k1, k-1 |
PtO2 Pt +O2 |
k2 |
Константа адсорбционного равновесия первой стадии этого процесса Ка = k1/k2. Напишите кинетическое уравнение для скорости разложения H2O2 методом

15
квазиравновесных концентраций.
9.Реакция разложения бромметана 2СH3Br C2H6 + Br2 протекает по следующему механизму:
Используя метод квазистационарного приближения, найдите выражение для скорости образования этана.
Вариант 8.
1.В реакции второго порядка между веществами А и В начальная скорость имеет величину 7,2*10-8 моль/(л·с) при концентрации А = 0,1 моль/л и В=0,03 моль/л, Какова константа скорости реакции? Через сколько времени реакция пройдет на 10% по веществу с меньшей концентрацией?
2.Реакция восстановления хлорида железа(III) хлористым оловом протекает по
уравнению
2 Fe+3 + Sn2+ = 2 Fe+2 + Sn4+
и подчиняется уравнению 3-его порядка, Начальные концентрации реагентов
эквивалентны и равны [Fe+3]0 = [Sn2+]0 = 0,0625M, За кинетикой следили, определяя концентрации продукта [Fe+2] во времени титрованием проб бихроматом, Определите константу скорости по приведенным в таблице результатам титрования:
Время, мин |
1 |
3 |
7 |
17 |
40 |
[Fe+2], моль/л |
0,01434 |
0,02586 |
0,03612 |
0,04502 |
0,05058 |
3.Реакция йодирования ацетона в растворе соляной кислоты идѐт по уравнению:
СН3СОСН3 + I2 + Н2О = СН3СОСН2J + Н3О+ + I−
Изучалась зависимость скорости реакции от концентрации компонентов систепмы при 25О С,
Сац, ,102, моль/л |
2 |
2 |
2 |
1 |
Сйода,103, моль/л |
5 |
1,3 |
5 |
1,3 |
СHCl, моль/л |
0,1 |
0,1 |
0,025 |
0,1 |
r,106, моль/(л,мин) |
4,01 |
3,98 |
0,98 |
2 |
По приведенным данным выведите кинетическое уравнение реакции и рассчитайте константу скорости реакции,

16
4.Пользуясь зависимостью между временем полураспада и начальным давлением,
определите порядок для реакции конверсии пара-водорода в орто-водород при температуре 923оК, Значения давления пара-водорода и время полураспада для пара-орто-превращения водорода p-H2 o-H2 следующие:
Ро, мм рт,ст, |
50 |
100 |
200 |
400 |
1/2, с |
648 |
450 |
318 |
222 |
5. Кинетика реакции димеризации бутадиена
2 С4Н6 = С8Н12
Определите порядок реакции и константу скорости по изменению общего давления
(Робщ) |
в реакции при 326оС: |
|
|
|
|
|
|
|
, мин |
0 |
8,02 |
12,18 |
33,0 |
42,50 |
68,05 |
90,05 |
259,50 |
Робщ, |
632,0 |
599,4 |
584,2 |
527,8 |
508,8 |
474,6 |
453,3 |
381,0 |
мм.рт.ст. |
|
|
|
|
|
|
|
|
6. Константа омыления уксусно-этилового эфира едким натром |
|
|
||||||
H3CCOOC2H5 + NaOH = H3CCOONa + C2H5OH |
|
|
|
|||||
при 90С |
k = 2,37 л/(моль мин), а при 140С – k = 3,204 л/(моль мин). При какой |
|||||||
температуре константа скорости равна 5 л/(моль мин)?
7.Изопропенилаллиловый эфир в парообразном состоянии при температуре 1500С изомеризуется в аллилацетон
H2C |
|
O |
|
CH 3 |
|
|
|
O |
|
CH3 |
|
|
|
C |
|
H2 |
C |
C |
|||
HC |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
CH2 |
|
CH2 |
|
HC |
CH2 |
|||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Зависимость константы скорости от температуры описывается уравнением:
k = 5 1011  exp (-122200/RT), c-1; [E] = Дж/моль
exp (-122200/RT), c-1; [E] = Дж/моль
Рассчитайте энтальпию и энтропию активации и дайте интерпретацию последней.
8. Предполагается, что реакция I- + OCl- = OI−+Cl−
в растворе имеет следующий механизм:
В первой и третьей реакцией быстро устанавливается равновесие, а вторая стадия является лимитирующей. Выведите кинетическое уравнение реакции,

17
соответствующее этому механизму. Оказывает ли какое-либо вещество тормозящее влияние?
9.Суммарное уравнение разложения перекиси водорода при фотохимическом образовании щавелевой кислоты отвечает суммарной реакции:
Предполагая, что механизм этой реакции отвечает следующей схеме:
Выведите кинетическое уравнение для разложения перекиси водорода.
Вариант 9,
1.Реакция первого порядка проходит на 25% а 35 мин, Какова величина константы скорости этой реакции в с-1? Сколько исходного вещества останется непрореагировавшим через 5 ч?
2.При взаимодействии персульфата калия с йодидом выделяется йод,
K2S2O8 + 2KI = 2K2SO4 + I2
При изучении кинетики этой реакции сливали равные объемы 1/15 N растворов персульфата калия и иодистого калия, Через определенные промежутки времени отбирали пробы по 25 мл раствора и оттитровывали I2 0,01N раствором тиосульфата натрия, VNa2S2O3*NNa2S2O3 = VI2*NI2 , Результаты титрования:
, мин |
9 |
16 |
32 |
50 |
V Na2S2O3, мл |
4,52 |
7,80 |
14,19 |
20,05 |
Определите константу скорости 2-го порядка,
3.Некоторое вещество А смешано в равных молярных количествах с веществами В и С так, что концентрации их равны 1 моль/л, По истечении 1000 с половина А прореагировала, Сколько останется вещества А по истечении 2000 с, если считать, что соответствующая реакция: а) первого порядка; б) второго порядка; в) третьего порядка,
4.Термическая диссоциация окиси этилена протекает по уравнению:
(СН2-СН2)О(г) CH4 + CO
При температуре 687,70С и постоянном объеме общее давление реакционной смеси, измеренное в мм,рт,ст , изменяется со временем следующим образом:
Робщ, мм рт,ст, |
116,51 |
120,56 |
125,72 |
128,74 |
133,23 |
141,37 |
, мин |
0 |
3 |
7 |
9 |
12 |
18 |

18
5.Взаимодействие трифторида бора с аммиаком изучалось по начальным скоростям при V = const при различных концентрациях реагентов:
BF3(газ) + NH3(газ) = F3B∙NH3(газ)
[BF3], M |
0,250 |
0,250 |
0,200 |
0,350 |
0,175 |
[NH3], M |
0,250 |
0,125 |
0,1 |
0,1 |
0,1 |
ro, моль/(л,с) |
0,2130 |
0,1065 |
0,0682 |
0,1193 |
0,0596 |
Выведите кинетическое уравнение и определите константу скорости.
6. Константа скорости реакции окисления -аллилпалладиййодида под действием йода:
|
|
[ -С3Н5PdI] + I2 |
= C3H5I + PdI2 |
|
|
|
|
|
||||
изменяется с ростом температуры следующим образом: |
|
|
|
|
|
|||||||
|
|
t, 0C |
20 |
25 |
30 |
|
|
35 |
|
|
40 |
|
k2, л/(моль*с) |
1.47 |
1.80 |
2.44 |
|
3.06 |
|
|
4.73 |
||||
Определите предэкспоненциальный множитель уравнения Аррениуса. |
||||||||||||
константу скорости реакции при 10оС. |
|
|
|
|
|
|
|
|
||||
7. Для реакции бромирования бутен-2-дисульфоната-1,4 в жидкой фазе |
|
|||||||||||
H |
|
CH 2SO3N a |
|
|
Br |
|
CH 2 |
|
SO3N a |
|||
|
|
|
|
|
||||||||
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
+ Br 2 |
NaBr |
CH |
CH |
|
|||||||
|
|
|
+ |
|
|
|
|
|
|
|
||
|
C |
|
|
|
|
|
||||||
|
|
|
H 2C |
O |
|
|||||||
H |
|
CH 2SO3N a |
|
|
|
|||||||
|
|
|
|
SO2 |
|
|||||||
рассчитайте энтальпию и энтропию активации на основании следующих данных:
8.
Т, К |
293 |
298 |
303 |
k, 103, л/(моль с) |
8,9 |
11,0 |
13,7 |
8.Скорость реакции 2N0(г) + 2Н2(г N2(г) + 2Н20(г)
описывается кинетическим уравнением r = k*(cN0)2*c Н2. Для этой реакции был предложен механизм:
Первая и третья стадия этого процесса — быстрые химические реакции, а вторая
— медленная. Совместим ли этот механизм с экспериментальным кинетическим уравнением?
9.Реакция взаимодействия катализатора Уилкинсона RhClL3, где L=P(C6H5)3, с водородом, приводящая к образованию активной формы этого катализатора

19
RhClL2H2, способной вести процесс гидрирования алкенов, может быть описана следующей схемой:
RhClL3 |
RhClL2 + L |
k1, k-1 |
RhClL3 + H2 |
RhClL3H2 |
k2 |
RhClL2 + H2 |
RhClL2H2 |
k3 |
Используя метод квазистационарных концентраций для RhClL2, выведите уравнение расходования водорода. В каких условиях наблюдается первый порядок по водороду?
10.
Вариант 10.
1.Реакция димеризации циклопентадиена подчиняется кинетическому уравнению 2- го порядка
2 C5H6 |
C10Н12 |
|
|
|
||
Время, мин |
0 |
50 |
100 |
150 |
200 |
|
[C5H6], М |
0,04 |
0,03 |
0,024 |
0,020 |
0,0174 |
|
Рассчитайте аналитически среднюю константу скорости, |
|
|||||
2. Для газофазной реакции |
|
|
|
|
|
|
N2O5 = N2O4 + ½ O2 |
|
|
|
|
|
|
При 25оС получены следующие опытные данные: |
|
|||||
t , мин………,,0 |
20 |
30 |
40 |
50 |
60 |
|
Р(О2), атм…… 0 |
0,821 |
1,237 |
1,640 |
2,051 |
2,470 5,000 |
|
Показать: 1) это реакция нулевого порядка, 2) вычислить значение константы скорости
3.Период полураспада изотопа полония 210Ро составляет 140 дней, Вычислить константу скорости распада полония, (Реакция первого порядка,) Сколько времени потребуется, чтобы распалось 80% данной массы полония-210? Какая доля исходного количества распадается за один день?
4.Реакция разложения гидразина N2H4 + 2H2O2 = N2 + 4 H2O в присутствии катализатора – солей меди(II) изучалась по измерению начальных скоростей выделения газообразного азота N2 при 25ºС, Общий объем раствора 300 мл Получены следующие результаты:
[N2H4],103, М |
16 |
33 |
131 |
33 |
33 |
65 |
33 |
33 |
33 |
33 |
[H2O2],103, М |
65 |
65 |
65 |
33 |
131 |
131 |
65 |
65 |
65 |
65 |
[Cu2+],103, М |
1,23 |
1,23 |
1,23 |
1,23 |
1,23 |
1,23 |
0,33 |
1,3 |
1,64 |
2,46 |
ro, мл N2/мин |
7,3 |
7,4 |
7,4 |
3,6 |
15,0 |
15,0 |
1,95 |
8,3 |
10,4 |
16,2 |
Выведите кинетическое уравнение реакции, 5. Определите порядок реакции пиролиза диметилового эфира при 504 оС
СН3СОСН3(газ) = С2Н4+ Н2 + СО

20
по изменению общего давления в xоде реакции, Найдите среднее значение константы скорости реакции (V=const),
, с |
0 |
390 |
665 |
1195 |
2240 |
3155 |
|
Робщ, мм.рт.ст. |
312 |
408 |
468 |
562 |
714 |
779 |
931 |
6.Реакцию окисления бромистого водорода, протекающую по уравнению HBr + O2 = HO2∙+ Br∙ исследовали при различных температурах. При этом наблюдалась следующая зависимость константы скорости от температуры:
Т, К |
700 |
762 |
800 |
k 103, л/(моль с) |
5,1 |
46,2 |
151,0 |
Рассчитайте энергию активации и предэкспоненциальный множитель.
7. Для реакции пиридина с йодистым этилом в жидкой фазе
C5H5N + C2H5I = C5H5N-C2H5+ + I−
При температуре 303 К константа скорости равна 1,72 10-6 л/(моль с). Энтропия активации S с = −118,8 Дж/(моль К)(Сo=1 моль/л). Найдите энтальпию активации
и энергию активации.
8.Кинетика цепной реакции пиролиза диметилсульфоксида — CH3S0CH3изучалась путем измерения скорости образования метана. Экспериментально установлено, что реакция имеет первый порядок. Для описания процесса разложения предложен следующий механизм протекания элементарных стадий процесса:
Применив принцип квазистационарных концентраций и полагая, что скорость обрыва цепи (k4) существенно меньше скорости ее продолжения (k3), покажите,
что эта схема согласуется с экспериментальными кинетическими результатами. 9. Для реакции разложения пентоксида диазота при 700 К предложен
N2O5 = 2NO + 1/2O2
следующий механизм:
N2O5 |
NO3· + NO2 |
NO3· + NO2 |
NO2 + NO· + O2 |
NO + N2O5 |
3 NO2 |
k1
k-1
k2
Выведите кинетическое уравнение реакции, используя метод квазистационарных концентраций для NO и NO3·. Согласуется ли этот механизм со следующими данными?
, ч |
0 |
1 |
2 |
3 |
4 |
Робщ, мм.рт.ст. |
550 |
680 |
790 |
880 |
960 |
