
Вариант задач по кинетике_11
.pdf
Вариант 11.
1. Реакция между пропионовым альдегидом и синильной кислотой
С2Н5СHO + HCN = С2Н5СH(OH)CN
в водном растворе является реакцией второго порядка, При 25оС были получены следующие данные
, мин |
0 |
2,78 |
5,33 |
8,17 |
15,23 |
19,80 |
[HCN], моль/л |
|
0,0990 |
0,0906 |
0,0830 |
0,0706 |
0,0653 |
[C3H7CHO],моль/л |
|
0,0566 |
0,0482 |
0,0406 |
0,0282 |
0,0229 |
Постройте график в спрямляющих координатах для данного порядка и рассчитайте константу скорости реакции,
2. Константа скорости реакции омыления этилового эфира уксусной кислоты гидроксидом натрия при 283оК равна 2,28 л/моль мин. Вычислить сколько времени потребуется на омыление 50% этилацетата, если при этой же температуре смешать 1 л 0,05 N раствора этилацетата:
а) с 1 л 0,05 N раствора NаОН,
б) с 1 л 0,10 N раствора NаОН.
3.Период полураспада изотопа 11С равен 20 мин, Какая часть исходного количества останется через 3 ч, если распад изотопа идет как реакция первого порядка,
4.Для реакции разложения ацетальдегида были получены следующие данные:
Время, с |
0 |
42 |
105 |
242 |
480 |
840 |
|
|
|
|
|
|
|
РCH3CHO, |
363 |
329 |
289 |
229 |
169 |
93 |
мм.рт.ст. |
|
|
|
|
|
|
|
|
|
|
|
|
|
Определите порядок реакции методом Вант-Гоффа.
5. Кинетику реакции разложения диметилового эфира
CH3OCH3 → CH4 + H2 + CO
изучали по измерению общего давления системы при 5040С. По приведенным данным определите порядок реакции и константу скорости,
t, сек |
0 |
390 |
665 |
1195 |
2240 |
|
Робщ, мм,рт,ст |
312 |
408 |
468 |
562 |
714 |
931 |
6.Графическим методом определите величину энергии активации реакции разложения пентоксида диазота в газовой фазе
|
N2O5 = 2 NO + O2 |
|
|
|
|
|
|
по следующим данным: |
|
|
|
|
|
|
|
t, 0C |
25 |
30 |
35 |
40 |
45 |
50 |
55 |
k 105, с-1 |
3,38 |
5,58 |
13,5 |
24,7 |
48,9 |
75,9 |
150 |
7.Для реакции между бензилизоцианатом и н-бутиловым спиртом
C6H5CH5N=C=O + C4H9OH C6H5CH2NH-CO-OC4H9
получены следующие константы скорости второго порядка:
t, oC |
0 |
7,0 |
15,0 |
25,0 |
k, л/(моль с) |
4,04 10-5 |
7,72 10-5 |
1,29 10-4 |
2,50 10-4 |
Вычислите энергию активации, предэкспоненциальный множитель, энтальпию и энтропию активации. Дайте объяснение полученным активационным параметрам.
1. Для следующей схемы сложной реакции: k1
2A |
= X +2C |
|
k-1 |
|
k2 |
X +D |
→ Пр |
где Х промежуточная высокореакционная частица
Используя метод квазистационарных концентраций по Х выведите кинетическое уравнение реакции по реагенту А.
8.Кинетика фотохимического хлорирования муравьиной кислоты в газовой фазе описывается уравнением
d Cl 2 |
k Cl 2 |
HCOOH |
|
d |
|||
|
|
Получите это уравнение, зная, что цепная реакция идет по следующей
схеме:
|
k0 |
|
Cl2 + hν |
2Cl· |
зарождение цепи |
|
k-1 |
|
Cl· + HCOOH |
COOH· + HCl |
продолжение |
|
k2 |
|
Cl2 + COOH· |
HCl + CO2 + Cl· цепи |
|
|
k3 |
|
Cl· + стенка |
1/2Cl2 |
обрыв цепи |
Вариант 12.
1, Реакция распада -аллильного комплекса палладия в водных растворах описывается следующим стехиометрическим уравнением:
-C3H5PdCl NH2(C2H5)2 = [C3H5NH2(C2H5)2]Cl + Pd0
- комплекс
Изменение концентрации -аллильного комплекса (С ) во времени при 700С характеризуется следующими значениями:
Время, мин |
0 |
100 |
200 |
300 |
400 |
500 |
6000 |

С 102, моль/л |
1,5000 |
1,057 |
0,744 |
0,522 |
0,369 |
0,261 |
0,184 |
Подтвердите выполнимость |
первого |
порядка |
реакции |
и рассчитайте |
значение |
||
константы скорости и концентрацию комплекса через 700 минут после начала |
|||||||
реакции. |
|
|
|
|
|
|
|
2, Реакция окисления |
-аллилпалладийиодида в |
водных |
растворах описывается |
||||
следующим стехиометрическим уравнением:
-С3Н5PdI H2O + I2 = C3H5I + PdI2 + H2O
Начальные концентрации комплекса и йода одинаковы и равны 1,0 10-3 моль/л, Изменение концентрации йода во времени при 400С характеризуется следующими значениями:
Время , мин |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
[I2] 103, моль/л |
1,000 |
0,3083 |
0,182 |
0,129 |
0,100 |
0,082 |
0,069 |
Определите порядок реакции и рассчитайте значение константы скорости,
3.Нитрование п-нитротолуола (пнт) азотной кислотой в серной кислоте идѐт как
реакция псевдопервого порядка, если азотная кислота взята в избытке (СHNO3 = 0,546), Реакцию проводили при температуре 25оС в 74,5% Н2SО4, Концентрация п- нитротолуола изменялась следующим образом:
, мин, |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
Спнт,104,моль/л |
3,0 |
2,837 |
2,684 |
2,538 |
2,401 |
2,271 |
2,148 |
2,031 |
1,921 |
Методом Вант –Гоффа подтвердите первый порядок реакции и определите константу скорости реакции и время полупревращения,
4.Время разложения для фосфина РН3 на 50% при различных исходных давлениях приводится ниже:
РоРН3, мм рт,ст, |
139 |
52,5 |
1/2, с |
84 |
83 |
Определите порядок реакций и константу скорости,
5. При исследовании термического распада арсина на стекле при 350оС
AsH3 (г) Аs (тв) + 3/2 Н2
обнаружено изменение общего давления Робщ в системе со временем:
, ч |
0 |
4,33 |
16 |
25,5 |
37,66 |
44,75 |
Pобщ, мм рт, |
39,2 |
40,3 |
43,65 |
45,35 |
48,05 |
48,85 |
ст, |
|
|
|
|
|
|
Определите порядок реакции и константу скорости.
6. Реакция разложения диоксида азота является реакцией второго порядка
2NO2 =2 NO + O2

Были получены следующие данные о температурной зависимости константы скорости:
Т, К |
592 |
603 |
627 |
652 |
656 |
k, л/(моль с) |
0,522 |
0,765 |
1,700 |
4,020 |
5,030 |
Графически определите энергию активации и рассчитайте среднюю величину предэкспонента уравнения Аррениуса в указанном интервале температур.
7.Разложение пероксида ди-(трет-бутила) в газовой фазе представляет собой реакцию первого порядка в интервале температур 110 - 2800С. Константа скорости описывается уравнением:
k = 3,2 1016 exp (-163600/RT)с-1 [E] = Дж/моль.
Вычислите активационные параметры Sº и Нº реакции и дайте интерпретацию полученным значениям.
и Нº реакции и дайте интерпретацию полученным значениям.
8.Реакция образования фосгена CO + Cl2 COCl2 может протекать по следующему механизму:
|
Cl2 |
2Cl |
k0 |
Cl |
+CO |
COCl |
k1 |
COCl |
+ Cl2 |
COCl2 + Cl |
k2 |
|
COCl |
Cl +CO |
k3 |
|
2Cl |
Cl2 |
k4 |
Используя метод квазистационарного приближения, найдите выражение для скорости образования фосгена, оцените эффективную константу скорости и общий порядок реакции.
9. Для инициируемого радиацией распада некоторых органических нитратов при комнатной температуре предложен следующий механизм:
k1
RONO2 + h RONO + ·O·
RONO + ·O·
k-1
RONO + ·O· RONO2 k2
RONO2 k2
RONO2 + ·O·  RONO + O2
RONO + O2
Символ h обозначает некоторую дозу ионизирующей радиации. Сделав предположение о стационарной концентрации атомов ·O·, выведите уравнение для скорости образования NO2−.
обозначает некоторую дозу ионизирующей радиации. Сделав предположение о стационарной концентрации атомов ·O·, выведите уравнение для скорости образования NO2−.
10.
Вариант 13.
1. Константа скорости реакции первого порядка равна 3,5,10-4 с-1 а) какова начальная скорость, если исходная концентрация реагента
0,1 моль/л?
б) какова скорость реакции в момент, когда реакция пройдет на 90%? в) сколько времени потребуется, чтобы реакция прошла на 90%?
2.Реакция разложения аммиака на горячей вольфрамовой проволоке протекает по следующему стехиометрическому уравнению:

NН3 = 1/2 N2 + 3/2 Н2
За реакцией следили по изменению общего давления. В различные моменты времени давление увеличивалось следующим образом:
, с |
100 |
200 |
400 |
600 |
800 |
1000 |
Робщ, мм.рт.ст. |
211,0 |
222,1 |
244,0 |
266,3 |
287,9 |
310 |
(где Р=Робщ,-Р0 ). |
При условии, что начальное давление равнялось 200 мм.рт.ст, |
|||||
графически методом подбора определите порядок реакции и рассчитайте константу
скорости. |
|
|
|
|
|
3. При изучении кинетики реакции диоксида азота с этиленом |
наблюдалась |
||||
следующая зависимость начальной скорости от исходной |
концентрации |
||||
реагентов |
|
|
|
|
|
[NO2]·10-3, Па |
7,82 |
7,81 |
2,61 |
7,97 |
10,61 |
[С2H4]]·10-3, Па |
7,57 |
14,08 |
7,84 |
2,83 |
7,98 |
Оп ro, моль/(л,с) |
1066 |
1893 |
127 |
453 |
1333 |
ре |
|
|
|
|
|
делите порядок реакции по обоим реагентам и константу скорости,
4. При изучении взаимодействия между ионами брома и xлорноватистой кислоты
СlО + Br = BrО + Сl
при 25оС через определенные промежутки времени отбирали пробы и определяли в ниx содержание иона ВrО , Результаты анализов:
, мин |
0 |
3,65 |
7,65 |
15,05 |
26,00 |
47,60 |
90,60 |
[BrO−],102, моль/л |
0 |
0,0560 |
0,0953 |
0,1420 |
0,1800 |
0,2117 |
0,2367 |
Начальные концентрации NaClO и КВr соответственно равны 0,00323 и 0,002508 моль/л, Покажите, что скорость реакции подчиняется кинетическому уравнению второго порядка и рассчитайте константу скорости,
5.Время разложения для N2О (2) на 50% при различных исходных давлениях приводится ниже:
РоN2O,мм рт,ст, |
79 |
37,5 |
1/2, с |
470 |
860 |
Определите порядок реакции и константу скорости.
6.Для реакции термического разложения этана получены следующие значения константы скорости в зависимости от температуры:
Т, К |
823 |
833 |
843 |
853 |
863 |
873 |
883 |
893 |
903 |
k 105, с-1 |
2,5 |
4,7 |
8,2 |
12,3 |
23,1 |
35,3 |
57,6 |
92,4 |
141,5 |
Постройте график зависимости lnk от I/T. Рассчитайте энергию активации и предэкспоненциальный множитель.
7. Для реакции разложения оксида азота |
2NO N2 + O2 |
известны значения констант скорости: |
|
при Т1 |
= 1620 К |
k1 = 0,0108 л/(моль с) |
при Т2 |
= 1525 К |
k2 = 0,003 л/(моль с) |
Рассчитайте Нº , Sсº (при Сo=1 моль/л и Сo=1 моль/см3) и Sрº при средней температуре 1572 К.
при средней температуре 1572 К.
8.Известна кинетическая схема радикального хлорирования тетрахлорэтилена в растворе CCl4:
Используя метод квазистационарного приближения, найдите выражение для скорости образования гексахлорэтана.
2.Для следующей схемы сложной реакции:
k1
A +D = X +C
k-1
k2
X +D → Пр +C
где Х промежуточная высокореакционная частица
Используя метод квазистационарных концентраций по Х выведите кинетическое уравнение реакции по реагенту D.
Вариант 14.
1. Вытеснение бромида тиосульфат-ионом изучалась при 37,5оС:
C3H7Br + S2O32– = C3H7S2O3– +Br–
Были получены следующие данные
, 10-3, с |
0 |
1,11 |
2,010 |
3,192 |
5,052 |
11,232 |
[S2O32-], моль/л |
0,0966 |
0,0904 |
0,0863 |
0,0819 |
0,0766 |
0,0668 |
[C3H7Br], моль/л |
0,0395 |
0,0333 |
0,0292 |
0,0248 |
0,0196 |
0,0097 |
Рассчитайте константу скорости реакции, если по каждому реагенту порядок первый, а общий порядок реакции - второй,
2.Концентрация трития в воздухе приблизительно 5,10-15 моль/л, Период полураспада трития около 12 лет, Через сколько лет распадется 90% трития, если не учитывать пополнения содержания трития в воздухе за счет других процессов? ( Реакция первого порядка, )
3.Реакция окисления ионов As3+ ионами церия Се+4 протекает по уравнению

2 Се+4 + As3+ = 2 Се+3 + As5+
Реакционная смесь содержала эквивалентные концентрации реагентов, Зависимость концентрации ионов церия от времени представлена следующими экспериментальными данными:
Время, мин |
0 |
70 |
130 |
272 |
335 |
339 |
[Се+4], моль/л |
0,0234 |
0,0193 |
0,0171 |
0,0139 |
0,0130 |
0,0122 |
Определите константу скорости 3-его порядка,
4.По мере течения реакции между эквивалентными количествами окиси углерода и хлора, согласно уравнению СО + Сl2 = СОСl2 при 300 К в присутствии катализатора наблюдалось следующее уменьшение общего давления системы:
, мин |
0 |
5 |
10 |
15 |
21 |
Робщ, мм.рт.ст. |
724 |
675 |
654 |
622 |
600 |
Определите порядок реакции (V=const) графическим и аналитическим методом,
5.Методом Вант - Гоффа определите порядок реакции и константу скорости реакции разложения N2О5 в растворе тетрахлорида углерода при 45оС, Экспериментальные данные приводятся ниже:
, с |
0 |
184 |
319 |
626 |
867 |
1196 |
1877 |
2315 |
[N2O5], М |
2,35 |
2,08 |
1,91 |
1,67 |
1,36 |
1,11 |
0,72 |
0,55 |
6.Гидролиз некоторого алкилхлорида RCl в 80% этаноле протекает по первому порядку:
RCl + Н2О = RОН + НCl
Получены следующие значения константы скоростей:
t, 0С |
0 |
25 |
35 |
45 |
k, с-1 |
1,06 10-5 |
3,19 10-4 |
9,86 10-4 |
2,92 10-3 |
Постройте график зависимости lnk от I/T и определите энергию активации и предэкспоненциальный множитель.
7. Предэкспоненциальный множитель для газофазного разложения озона
O3 + M О2 + О + М
при низких температурах равен 4,6 1012 л/(моль с), а энергия активации составляет 100 кДж/моль. Каковы: а) энтальпия и энтропия активации Sрº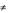 и Нº
и Нº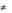 энтропия активации; б) константа скорости при 250С;
энтропия активации; б) константа скорости при 250С;
в) энергия активации Гиббса?
8.Реакция димеризации этана 2С2Н6 C4H10 +H2 протекает по следующему механизму:
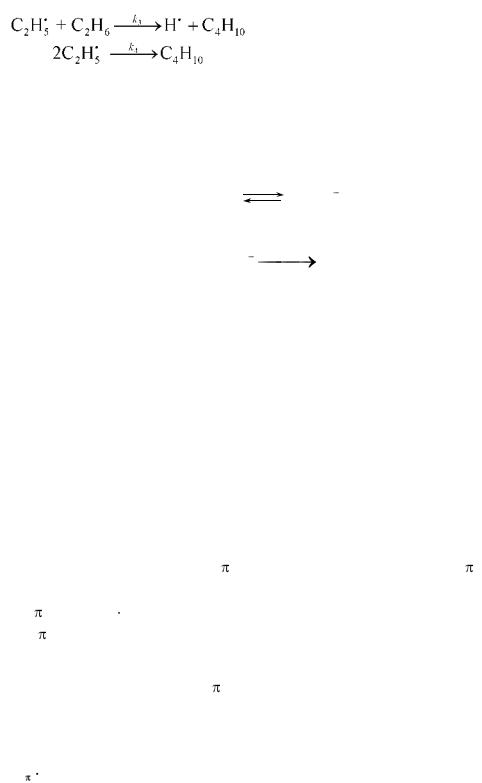
Используя метод квазистационарного приближения, найдите выражение для скорости образования бутана.
9. Реакции мономолекулярного нуклеофильного замещения в производных алканов (SN1) R-Х + Y- RY + X- протекают по схеме
|
k1 |
|
R-Х |
R+ + X , |
|
|
k-1 |
|
R+ + Y |
k2 |
RY |
В зависимости от условий реакции могут протекать либо а) в квазистационарном режиме по R+ ;
б) в предельных случаях лимитироваться реакцией гетеролиза RX (первая стадия) Выведите уравнения скорости для всех вариантов и выясните, различимы ли кинетически эти механизмы.
10.
Вариант 15.
1.Раствор уксусноэтилового эфира 0,01N концентрации омыляется при 25оС 0,002N раствором NaOH на 10% в течение 23 мин, За какое время тот же раствор эфира омыляется до такой же степени растворами NaOH концентрации а) 0,007 N,
б) 0,010 N, в) 0,005 N?
CH3COOC2H5 +NaOH CH3COONa + C2H5OH
2.Реакция кислотного распада -аллильного комплекса никеля ( ) описывается следующим стехиометрическим уравнением:
-С3Н5NiBr H2O + HBr C3H6 + NiBr2 + H2O
- комплекс
Начальные концентрации комплекса С и кислоты одинаковы и равны 0,00500 моль/л, Изменение концентрации -аллильного комплекса во времени при 270С характеризуется следующими значениями:
и кислоты одинаковы и равны 0,00500 моль/л, Изменение концентрации -аллильного комплекса во времени при 270С характеризуется следующими значениями:
Время , мин |
0 |
20 |
40 |
60 |
80 |
100 |
120 |
С 102, моль/л |
0,500 |
0,320 |
0,234 |
0,188 |
0,152 |
0,133 |
0,114 |
Подтвердите выполнимость |
второго |
порядка реакции и рассчитайте значение |
|||||
константы скорости, Определите время, за которое концентрация |
комплекса уменьшится |
||||||
до 0,005 моль/л , |
|
|
|
|
|
|
|
3.Пользуясь зависимостью между временем полураспада и начальным давлением,
определите порядок для реакции конверсии пара-водорода в орто-водород при температуре 923оК, Значения давления пара-водорода и время полураспада для пара-орто-превращения водорода p-H2 o-H2 следующие:

Ро, мм.рт.ст. |
50 |
100 |
200 |
400 |
1/2, с |
648 |
450 |
318 |
222 |
4. Графически методом подбора подтвердите, что реакция :
(СН3)3СОО(СН3)3 (газ)= 2 СН3СОСН3 + С2Н6
идет по первому порядку, Определите по графику константу скорости реакции при 147,2оС, За кинетикой реакции следили по изменению общего давления в системе, Были получены следующие данные:
, мин |
0 |
2 |
6 |
10 |
14 |
18 |
Робщ, мм,рт,ст, |
179,5 |
187,4 |
198,6 |
210,5 |
221,2 |
231,9 |
, мин |
26 |
30 |
34 |
38 |
42 |
46 |
Робщ, мм.рт.ст. |
252,5 |
262,1 |
271,3 |
280,2 |
288,9 |
297,1 |
5.Начальная скорость взаимодействия иона аммония с нитрит-ионом в зависимости от концентрации реагентов измерялась по количеству выделенного азота
NH4+aq + NO2−aq = N2 + 2H2O,
Найдите вид кинетического уравнения и константу скорости по следующим данным:
[NH4+], М |
0,01 |
0,02 |
0,04 |
0,06 |
0,2 |
0,2 |
0,2 |
0,2 |
[NO2−], М |
0, 2 |
0,2 |
0,2 |
0,2 |
0,0202 |
0,0404 |
0,0606 |
0,0808 |
ro 107, моль /с |
5,4 |
10,8 |
21,5 |
32,3 |
10,8 |
21,6 |
32,4 |
43,3 |
6.Константы скорости реакции второго порядка при 328 и 398 К соответственно равны 10-2 и 10-3 л/(моль мин). Вычислите скорость этой реакции при 343 К в начальный момент реакции, если начальные концентрации обоих веществ одинаковы и равны 0,005 моль/л.
7.Реакция замещения лигандов в плоско-квадратном комплексе платины в водном растворе
Pt(dien)Cl+ + Br- |
Pt(dien)Br+ + Cl- |
|
|
(dien = H2NCH2NHCH2CH2NH2) |
|
||
имеет следующие активационные параметры: Нº = 58,5 кДж/моль, |
Sº = 6,7 |
||
Дж/(моль К). Вычислите константу скорости при 250С. |
|
||
8. Для реакции термического разложения озона 2 O3 = 3 O2 |
|
||
предложен радикальный механизм: |
|
||
O3 |
k1 |
O2 + O. |
|
O. + O2 |
k-1 |
O3 |
|
O. + O3 |
k2 |
2 O2 |
|
Выведите кинетическое уравнение реакции в квазистационарном режиме. Как изменится это уравнение: если лимитирующей стадией будет: а) первая стадия механизма, б) вторая стадия механизма. Какие порядки по реагенту и продукту будут наблюдаться в этих случаях?

9.Реакция замещения лигандов в комплексах кобальта, протекающая в среде метилового спирта, часто описывается диссоциативным механизмом, например:
Co(en)2Cl2+  Co(en)2Cl2+ + Cl−
Co(en)2Cl2+ + Cl− Co(en)2Cl2+ + X
Co(en)2Cl2+ + X Co(en)2ClX+,
Co(en)2ClX+,
где en - бидентатный лиганд этилендиамин. Подтверждением этого механизма считается тот факт, что скорости замещения хлорид-иона на NO3 , Br , NCS , одинаковы. Какая стадия процесса в этом случае определяет скорость всей реакции? Выведите также кинетическое уравнение расходования Co(en)2Cl2+ методом квазистационарного режима реакции по комплексу Co(en)2Cl2+) и определите, в каких условиях оно переходит в предельную форму уравнения 1-го порядка.
10.
Вариант 16. Закончил здесь 2.70
1.Нитрование п-нитротолуола (пнт) азотной кислотой в серной кислоте идѐт как
реакция псевдопервого порядка, если азотная кислота взята в избытке (СHNO3 = 0,546), Реакцию проводили при температуре 25оС в 74,5% Н2SО4, Концентрация п- нитротолуола изменялась следующим образом:
|
, мин, |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
Спнт,104,моль/л |
3,0 |
2,837 |
2,684 |
2,538 |
2,401 |
2,271 |
2,148 |
2,031 |
1,921 |
|
|
Определите графически константу скорости реакции и время полупревращения, |
|||||||||
2. |
Константа скорости реакции : |
|
|
|
|
|
|
|||
|
СН3СООС2Н5 + NаОН = СН3СООNа + С2Н5ОН |
|
|
|
||||||
|
равна 5,4 л/моль мин, Сколько процентов эфира прореагирует за 10 мин, если |
|
||||||||
|
исходные концентрации щелочи и эфира одинаковы и равны |
0,02 моль/л? |
|
|||||||
3. |
Изучалась реакция газофазного разложения пентоксида диазота N2О5 при |
25ОС : |
||||||||
|
|
|
N2О5 = 2NО2 + ½ О2 |
|
|
|
|
|
||
|
Методом Вант-Гоффа определите порядок реакции по изменению |
концентрации |
||||||||
реагента N2О5 во времени: |
|
|
|
|
|
|
|
|||
|
, мин, |
0 |
20 |
100 |
120 |
200 |
220 |
300 |
320 |
|
|
N2О5, моль/л |
0,1 |
0,096 |
0,0816 |
0,0784 |
0,0667 |
0,0640 |
0,0544 0,0523 |
||
4. |
Изучалось гетерогенное разложение |
аммиака на |
вольфрамовой |
проволоке при |
||||||
|
Т = 1373 К : |
|
NН3 = 1/2N2 + 3/2 Н2 |
|
|
|
|
|
||
|
Период половины превращения ( 1/2) в зависимости от начального давления |
|||||||||
|
аммиака Ро указан в таблице: |
|
|
|
|
|
|
|
||
|
Ро, мм рт, ст, |
265 |
130 |
58 |
35 |
|
|
|||
|
1/2 |
, мин |
7,6 |
3,7 |
1,7 |
1,0 |
|
|
||
Определите порядок реакции и константу скорости,
