
КХ часть 5
.pdfУчебное пособие
И. А. Туторский
СТРУКТУРНО-МЕХАНИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ
СИСТЕМ. РАСТВОРЫ ВМС.
Федеральное агентство по образованию
Московская государственная академия
тонкой химической технологии
им. М. В. Ломоносова
Кафедра коллоидной химии
И. А. Туторский
КРАТКИЙ КУРС КОЛЛОИДНОЙ ХИМИИ.
ЧАСТЬ 5.
СТРУКТУРНО-МЕХАНИЧЕСКИЕ СВОЙСТВА
ДИСПЕРСНЫХ СИСТЕМ.
РАСТВОРЫ ВМС.
Учебное пособие
Подписано в печать…………..Формат 60x90/16. Бумага писчая. Отпечатано на ризографе. Уч. изд. Тираж 500 экз. Заказ №………..
Московская государственная академия тонкой химической технологии им. М. В. Ломоносова
Издательско-полиграфический центр. 119571 Москва, пр. Вернадского 86
Москва 2008
www.mitht.ru/e-library
ББК 24.6 УДК 541.18.046
И. А. Туторский Структурно-механические свойства дисперсных систем. Растворы ВМС Учебное пособие
М., МИТХТ им. М. В. Ломоносова, 2008 – 56 с.
Рецензент д.х.н. проф, Тверской В.А.
Данное учебное пособие соответствует программе лекционных курсов “Коллоидная химия” и “Поверхностные явления и дисперсные системы” для студентов 3 и 4 курсов для направления бакалавриата 510500 «Химия», 550800 «Химическая технология и биотехнология», 553500 «Защита окружающей среды», 551600 «Материаловедение и технология новых материалов», и по специальностям 070100 «Биотехнология», 250400 «Химическая технология природных энергоносителей и углеродных материалов», 250500 «Химическая технология высокомолекулярных соединений». В нем излагаются структурномеханические свойства дисперсных систем; сведения о растворах ВМС.
Утверждено Библиотечно-издательской комиссией МИТХТ в качестве учебного пособия.
© МИТХТ им. М. В. Ломоносова, 2008
Содержание.
13. Структурно–механические свойства дисперсных систем
13.1. Основные понятия. Реология как метод исследования |
|
структуры дисперсных систем |
3 |
13.2. Идеальные законы реологии |
4 |
13.3. Моделирование реологических свойств тел |
7 |
13.4. Классификация дисперсных систем по структурно- |
|
механическим свойствам |
11 |
13.5. Классификация дисперсных систем, основанная на |
|
реологических свойствах |
15 |
13.6. Зависимость вязкости от напряжения сдвига |
19 |
13.7. Вязкость жидких агрегативно устойчивых дисперсных |
|
систем |
20 |
13.8. Реологические свойства твердообразных тел |
23 |
14. Растворы высокомолекулярных соединений. Основные положения статистики полимерных цепей.
14.1. Гибкость и размеры цепи |
29 |
14.2. Количественные характеристики размеров макромолекул |
32 |
14.3. Свойства Гауссова клубка |
33 |
14.4. Состояния полимеров в растворе |
35 |
14.5. Термодинамика растворения полимеров |
37 |
14.6. Набухание как первая стадия растворения |
39 |
14.7. Разбавленные растворы полимеров |
40 |
14.8. Осмотическое давление растворов |
42 |
14.9. Термодинамическое сродство растворителя к полимеру |
46 |
14.10. Взаимодействия в растворах полимеров |
48 |
14.11. Концентрированные растворы полимеров |
49 |
14.12. Термодинамическая равновесность растворов |
|
полимеров и подчинение их правилу фаз |
50 |
2 |
www.mitht.ru/e-library |
55 |
жидкости на растворитель, вещество, вызывающее набухание, и
нерастворитель (рис.14.12).
Рис. 14.12 Фазовые диаграммы для растворителя ( а), агента набухания (б),
нерастворителя(в).
Для растворителя Tкрит лежит ниже комнатной температуры Tк .
Для агента набухания Tкрит Tк , концентрация жидкости в фазе
полимера велика (б). Для нерастворителя Tкр Tк Tтерм.разл. .
Концентрация жидкости в фазе полимера мала.
13. Структурно–механические свойства
дисперсных систем
13.1. Основные понятия. Реология как метод
исследования структуры дисперсных систем
Под структурой тел обычно понимают пространственное взаимное расположение составных частей тела: атомов, молекул мелких частиц. Образование структур в дисперсных системах с жидкой дисперсной средой связано с коагуляцией, т. е. слипанием,
агрегированием мелких частиц в более крупные вплоть до образования осадка (коагулюма).
В результате структурообразования свободнодисперсная система переходит в связнодисперсную. Появление и характер структур как правило, определяются по изменению механических свойств, таких, как вязкости, упругости, прочности, пластичности.
Так как эти свойства непосредственно связаны со структурой тел,
их называют структурно-механическими. Структурно-
механические свойства могут быть изучены методами реологии – науки о деформациях и течении материальных систем.
Реология изучает механические свойства систем через деформации под действием внешних напряжений. В коллоидной химии методы реологии используются для исследования структуры и вязкости дисперсных систем.
Термин “деформация” означает относительное смещение точек системы, при котором не нарушается ее сплошность. Упругие
(обратимые) деформации делятся на объемные (растяжение,
сжатие), сдвиговые и деформации кручения. Количественно они характеризуется относительными величинами.
Схематическое изображение деформации сдвига показано на
54 |
www.mitht.ru/e-library |
3 |
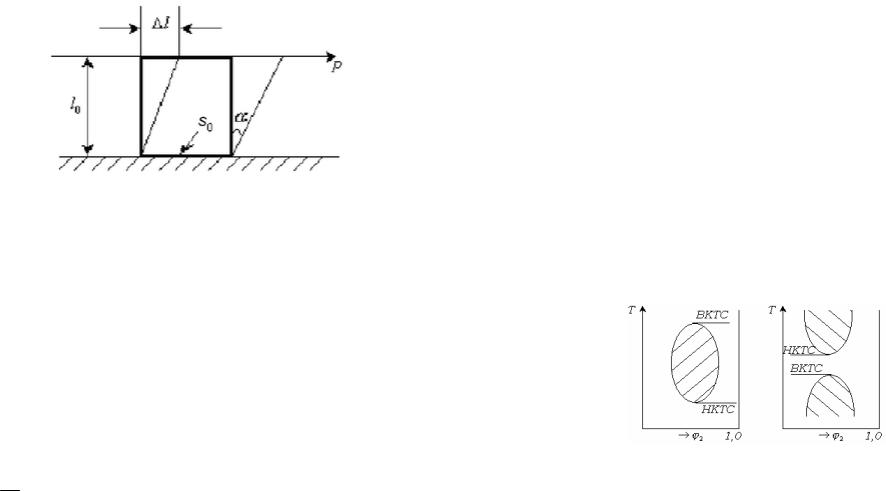
рис. 13.1
Рис. 13.1. Схематическое изображение деформации сдвига.
На прямоугольный элемент высотой l0 и площадью основания s0 тангенциально действует сила P . Элемент деформируется на
величину l . Касательное напряжение равно P /s0.
характерны для полимеров, растворяющихся с выделением тепла
( H 0), например целлюлозы в воде, нитроцеллюлозы в этаноле. При нагревании термодинамическое сродство компонентов уменьшается и система расслаивается. Понижение температуры приводит к повышению растворимости полимеров.
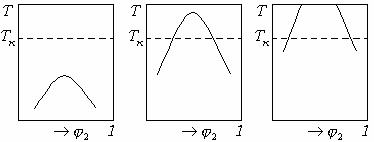
Часто полимерные растворы характеризуются бинодалью с двумя критическими температурами смешения (рис. 14.11). При этом могут быть два случая: ВКТС>НКТС и НКТС>ВКТС.
Положение критических температур смешения относительно друг друга определяется природой полимера и растворителя. При сильном взаимодействии полимера с растворителем, например когда полимер и растворитель сильно полярны, либо полимер диссоциирует (полиэлектролит), ВКТС>НКТС. В этом случае бинодаль имеет вид замкнутой кривой в виде овала (рис. 14.11).
Относительная деформация сдвига |
равна |
l |
tg . |
|
l0 |
||||
|
|
|
Для твердого тела зависимость деформации от напряжения устанавливается законом Гука: G , где G - модуль сдвига.
Для жидкости деформация развивается во времени, она неопределенна, т. к. жидкость течет. Поэтому находят зависимость между касательным напряжением и скоростью деформации
d
. dt
13.2.Идеальные законы реологии
Вреологии механические свойства материалов представляют в виде реологических моделей, в основе которых лежат три основные закона, связывающих напряжение с деформацией или скоростью деформации. Им соответствует три элементарных модели идеальных материалов, отвечающих трем характеристикам
Рис.14.11 Примеры бинодалей с двумя критическими температурами
смешения.
Примером системы с подобной бинодалью является система полипропиленоксид - вода. В большинстве случаев для таких систем наблюдается лишь часть замкнутой кривой.
Отсутствие низкотемпературного участка бинодали связано с кристаллизацией либо со стеклованием полимера, а отсутствие высокотемпературного участка связано с достижением температуры кипения растворителя.
По характеру фазовой диаграммы можно произвести деление
4 |
www.mitht.ru/e-library |
53 |
температурой смешения (Tk ) составы обеих фаз выравниваются,
граница раздела между ними исчезает, и образуется гомогенный раствор. Кривая сосуществования фаз характеризуется значительной асимметрией, максимум смещен в сторону, малых концентраций полимера. Форма кривой зависит от молекулярной массы и полидисперсности образца.
(упругость, пластичность, вязкость): идеально упругое тело Гука,
идеально пластичное тело Сен-Венана-Кулона и идеально вязкое тело Ньютона.
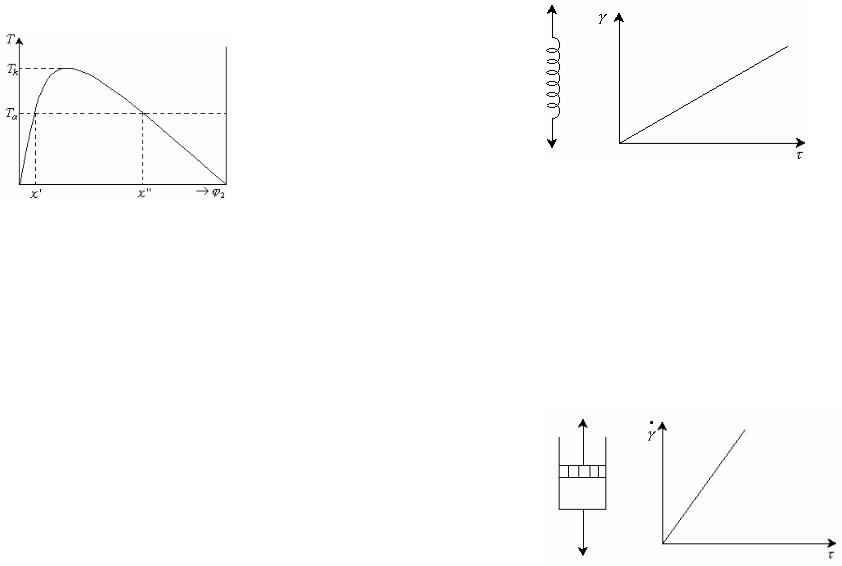
Идеально упругое тело Гука представляют в виде пружины с модулем G (рис. 13.2)
Рис. 14.10. Фазовая диаграмма раствора полимера.
Кривая фазового разделения отделяет область абсолютно неустойчивых смесей от области устойчивого состояния. Все точки над кривой относятся к гомогенной системе, образуя область полной смешиваемости компонентов. Точки под кривой характеризуют область, в которой возникают гетерогенные флуктуации, зародыши новой фазы.
Фазовая диаграмма позволяет установить термодинамический критерий разделения растворов полимеров на разбавленные и концентрированные. Левая ветвь бинодали служит правой границей разбавленных растворов, правая ветвь бинодали является левой границей концентрированных растворов.
Бинодаль с верхней критической температурой смешения
(ВКТС) соответствует полимеру, растворимость которого увеличивается с повышением температуры.
Бинодали с нижней критической температурой смешения (НКТС)
Рис.13.2. Модель идеально упругого тела Гука.
В соответствии с законом Гука деформация в пружине пропорциональна напряжению: G . Таким образом упругое поведение характеризуется линейной зависимостью между и .
Его характерной особенностью является полная механическая и термодинамическая обратимость.
Вязкое поведение характеризуется линейной зависимостью
между и . Идеально вязкую жидкость представляют в виде перфорированного поршня в вязкой среде (рис. 13.3)
Рис. 13.3. Модель идеально вязкой жидкости Ньютона.
52 |
www.mitht.ru/e-library |
5 |
Согласно закону Ньютона напряжение сдвига пропорционально
скорости деформации:
Коэффицент пропорциональности в этом уравнении называется
вязкостью и имеет размерность Па с или Н с м2 . Идеально
вязкое поведение полностью механически и термодинамически необратимо.
Моделью идеального пластического тела Сен-Венана-Кулона являются две дощечки, прижатые друг к другу с нормальной силой
FN , придвижении которых возникает сила тренияFтр fтр FN ,
где ƒтр-коэфициент трения. Сила трения равна предельному напряжению сдвига: . Деформация отсутствует, если напряжение сдвига меньше некоторого значения, называемого пределом
текучести T . При < т, =0 и =0. Если напряжение достигает
предела текучести, то деформация идеально пластического тела происходит беспредельно и течение происходит с любой
скоростью, т. е. при > т, 0, 0(рис. 13.4)
Рис.13.4 Модель идеального пластического тела.
Структура идеального пластического тела при = т
6
являются термодинамически равновесными системами и подчиняются правилу фаз. Правило фаз гласит, что между числом степеней свободы, т. е. числом независимых переменных,
определяющих состояние системы, F , числом компонентов, K , и
числом фаз, Ф существует простая зависимость: F K Ф 2
В растворах полимеров, представляющих собой конденсированные системы, не принимают во внимание давление в газовой фазе, т. к. оно не влияет на состояние системы, и для раствора полимера: F K Ф 1
Для двухкомпонентной однофазной системы
F 2, т. е. состояние системы однозначно определяется двумя переменными: температурой и концентрацией.
Условие равновесия двухфазной системы определяется равенством химического потенциала в обеих фазах. Аналитическое описание фазового равновесия затруднительно даже для низкомолекулярных соединений, а для растворов полимеров оно дополнительно затруднено полидисперсностью полимера. Поэтому прибегают к геометрическому описанию фазового равновесия путем построения диаграмм состояния, или фазовых диаграмм в
координатах: температура – состав. Экспериментально нагревают и охлаждают раствор разной концентрации и определяют температуру фазового расслоения по помутнению раствора и составы фаз (рис. 14.10). Кривая равновесия имеет максимум и называется бинодалью. Температуре Ta соответствуют две фазы
состава x' и x'' . Каждая фаза представляет собой насыщенный раствор одного компонента в другом. При повышении температуры первая фаза обогащается вторым компонентом, а вторая фаза обогащается первым компонентом, т. е. значения концентрации компонентов в обеих фазах изменяются, приближаясь друг к другу.
При некоторой температуре, называемой критической
51
распределены в растворе, что дает возможным применять модель квазикристаллической решетки к растворам полимеров.
Координационные сферы макромолекул в концентрированных растворах перекрываются, а при характеристической концентрации
С* концентрация сегментов внутри сферы равна их средней концентрации в растворе. Концентрированные растворы полимеров имеют как теоретическое, так и технологическое значение.
Через концентрированные растворы в настоящее время перерабатывается большое количество полимеров. Переработке через растворы подвергаются такие полимеры, как полиакрилонитрил, производные целлюлозы, термостойкие полимеры. Значительное количество полимерной пленки и мембран производится поливом из растворов. Широко применяемые полимерные клеи также являются концентрированными растворами полимеров.
14.12. Термодинамическая равновесность
растворов полимеров и подчинение их правилу фаз
До 30-х годов текущего столетия полимеры выделяли в группу лиофильных коллоидов. В этот период многие закономерности лиофильных коллоидов неправильно переносили на полимеры.
Так, большое распространение в свое время получила мицеллярная теория строения растворов полимеров. Длительное время в науке господствовали ошибочные представления о неподчинении растворов полимеров правилу фаз, о
неравновесности растворов полимеров. Оказалось, что наблюдаемые закономерности связаны не с термодинамическими,
а с кинетическими причинами, с медленностью установления равновесия в растворах полимеров вследствие больших времен релаксации и высокой вязкости растворов. Растворы полимеров
разрушается, после чего сопротивление напряжению полностью отсутствует. При пластическом поведении, в отличие от упругого и вязкого поведения, отсутствует пропорциональность между воздействием и деформацией, т. е. это поведение является нелинейным. Пластическое течение, как и вязкое, механически и термодинамически необратимо.
Энергия, затраченная на деформацию упругого тела Гука,
возвращается при разгрузке (консервативная система). При деформации вязкого и пластического тела энергия превращается в теплоту (диссипативные системы).
13.3. Моделирование реологических свойств тел
Реологические свойства реальных тел можно моделировать с помощью сочетаний различных моделей. Сложные модели состоят из идеальных моделей (элементов), соединенных последовательно или параллельно. При последовательном соединении элементов полное напряжение приходится на каждый элемент, т.е.
1 2 ... n
Следовательно, напряжение в каждом элементе равно полному
напряжению. Полная деформация или ее скорость являются суммой деформаций и скоростей составляющих элементов:
1 2 ... n
|
|
|
|
|
|
1 2 ... n |
|
||
При параллельном соединении элементов |
деформации и их |
|||
|
|
|
|
|
скорости |
одинаковы для всех элементов, а полное напряжение |
|||
распределяется по отдельным элементам |
и является суммой |
|||
напряжений отдельных элементов. |
|
|||
50 |
www.mitht.ru/e-library |
7 |
1 |
2 |
... n |
|
|
|
|
|
|
|
|
|
сегменты образуют контакты типа полимер - полимер. |
|
||||||||||||||||||||||||||||||||||||||||
|
1 |
|
2 |
... n |
|
|
|
|
|
|
|
|
|
Второй |
вириальный |
коэффициент |
связан с |
температурой и |
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
исключенным объемом следующим соотношением: |
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
θ |
|
|
|
|
|||||||
|
1 |
|
2 |
... n |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
1 |
|
|
F(x) |
(14.14) |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V ψ |
|
|
T |
|||||||||||||||||||||||||||||||||||
Максвелл выдвинул представление о том, что механические |
|
|
|
2 |
1 |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
свойства реальных тел являются промежуточными между |
где V1 |
и V2 – |
удельные объемы растворителя и полимера, |
- |
|||||||||||||||||||||||||||||||||||||||||||||||||
идеальными жидкостью и твердым телом. Модель Максвелла |
параметр, связывающий объемную долю полимера с изменением |
||||||||||||||||||||||||||||||||||||||||||||||||||||
является |
|
|
последовательным |
соединением |
элементов Гука и |
энтропии: |
ΔS1 R ψ1 V2. |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
Ньютона (рис.13.5) Общая деформация и ее скорость равны сумме |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
Легко видеть, что при T A2 |
0. |
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
деформации и скоростей составляющих элементов. |
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Г |
|
Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
При температуре, равной |
, раствор полимера ведет себя как |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
идеальный, т.е. как бы не взаимодействует с растворителем. |
|
|||||||||||||||||||||||||||||||||
|
d |
|
|
|
|
d Г |
|
|
d Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эта |
температура называется |
|
- |
точкой или температурой |
|||||||||||||||||||||||||||||||
|
dt |
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Флори. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Из закона Гука |
|
|
|
|
. Из закона Ньютона: |
|
При |
|
- |
температуре |
|
взаимодействия |
в растворе |
не |
|||||||||||||||||||||||||||||||||||||||
Г |
G |
dt |
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
устраняются, а лишь компенсируют друг друга. Происходит |
|||||||||||||||||||||
|
d Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
Н |
|
|
|
t |
|
|
|
|
|
|
|
|
|
компенсация дальнодействия и взаимодействия с растворителем. |
||||||||||||||||||||||||||||||||
|
|
dt |
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- температура подобна температуре Бойля для реального газа, |
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d |
|
|
1 |
|
|
d |
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
t, |
|
|
|
|
|
|
|
|
|
когда собственный объем молекул газа |
компенсируется силами |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
dt |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
G |
|
|
|
|
|
|
|
|
G |
|
dt |
|
|
|
|
межмолекулярного взаимодействия. Таким образом, разбавленный |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Эти |
|
|
уравнения |
|
|
|
являются |
|
линейной |
моделью уравнения |
раствор полимера при - температуре является моделью газового |
||||||||||||||||||||||||||||||||||||||||||
Максвелла. Для |
|
const |
|
|
|
|
|
|
|
|
состояния макромолекулы, когда индивидуальная макромолекула |
||||||||||||||||||||||||||||||||||||||||||
|
и 0: |
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
1 |
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
не возмущена никакими посторонними взаимодействиями. |
|
|||||||||||||||||||||||
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Измерение |
свойств |
разбавленных |
растворов полимеров |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
G |
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
позволяет определять молекулярную массу полимеров и |
|||||||||||||||||||||||||
|
d |
|
|
|
|
|
|
|
G |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
молекулярно-массовое распределение. |
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
G |
|
14.11. Концентрированные растворы полимеров |
|||
ln |
|
t |
|
|
|
|
||
|
|
При увеличении |
концентрации |
раствора до |
умеренной |
|||
0 |
|
|
||||||
|
|
|
|
|
концентрации (1-5%) |
сегменты |
макромолекул |
равномерно |
|
|
8 |
www.mitht.ru/e-library |
49 |
|
|
||

полимеру – величина второго вириального коэффициента А2 в
уравнении осмотического давления (рис. 14.9). Чем больше
значение А2 , тем лучше растворитель. Если А2 0, то такой
растворитель является идеальным. В плохом растворителе
значения А2 отрицательны. |
|
|
|
|
Четвертым |
критерием |
термодинамического |
сродства |
|
растворителя |
к полимеру |
является |
константа |
Хаггинса . |
Константа Хаггинса является важнейшим параметром в теории растворов полимеров. Ее величина характеризует избыточную энергию межмолекулярного взаимодействия, приходящуюся на один моль раствора и является мерой термодинамического сродства растворителя к полимеру. Константа Хаггинса представляет собой изменение свободной энергии, необходимое для переноса молекулы растворителя из чистого растворителя в полимерную фазу. В основном значения 1 равны 0,2 0,5. При
- температуре значение 1 0,5.
14.10.Взаимодействия в растворах полимеров
Врастворах полимеров существуют различные типы межмолекулярного и внутримолекулярного взаимодействия.
Межмолекулярные взаимодействия – это взаимодействия различных макромолекул и взаимодействие полимера с растворителем. Внутримолекулярные взаимодействия – это взаимодействие соседних сегментов, характеризующее термодинамическую жесткость цепи, так называемое близкодействие, и взаимодействие удаленных по цепи сегментов, но вследствие изгиба цепи оказавшихся рядом
(дальнодействие). При дальнодействии образуется петля минимального размера, зависящего от гибкости цепи, и удаленные
0 e t , где
, где
G
Согласно уравнению Максвелла, напряжение убывает со временем по закону: 0 e t (рис. 13.5.в).
(рис. 13.5.в).
|
|
|
|
|
Величина |
|
имеет размерность времени и |
называется |
|
|
||||
|
|
G |
|
|
временем |
релаксации. Численно равна времени, |
в течение |
||
которого напряжение в образце уменьшается в e раз (рис. 13.5.в).
Между жидкостями и твердыми телами нет принципиальной разницы. Поведение тела под нагрузкой определяется соотношением времени действия силы и времени релаксации. Так ледники и горные породы текут под действием собственного веса
(время действия силы очень велико по сравнению с временем релаксации).
Если время воздействия на типичную жидкость значительно меньше времени релаксации, то течение произойти не успевает, и
жидкость ведет себя как упругое твердое тело. Можно привести многочисленные примеры этого. Струя воды раскалывается пулей как хрупкое тело. Плоский камешек, брошенный параллельно поверхности воды, отскакивает от воды. Пловец, прыгающий с вышки под неправильным углом, получает сильный удар о воду.
λ
Рис. 13.5. ( а) - Модель упруго-вязкого тела Максвелла , (б) – изменение
48 |
www.mitht.ru/e-library |
9 |
деформации при const , (в) – изменение напряжения при const .
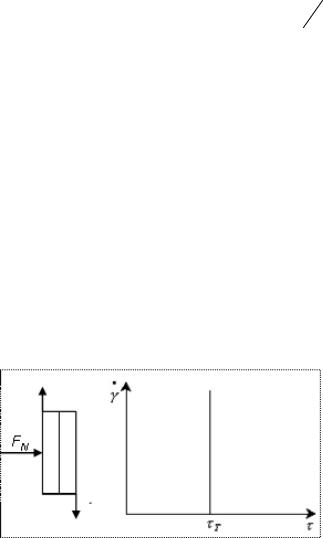
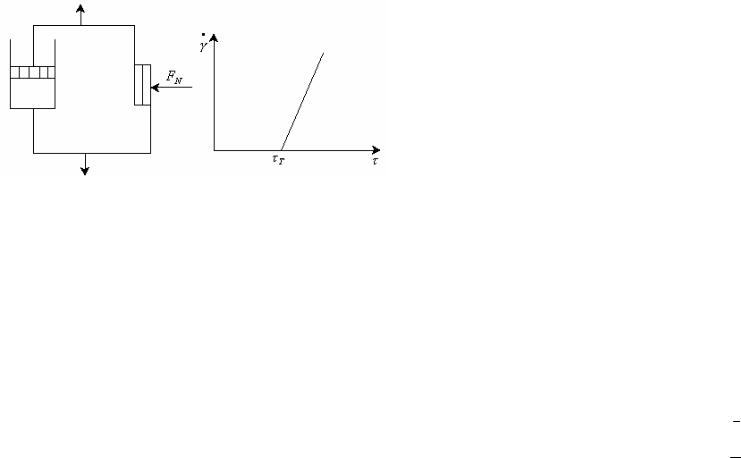
Модель вязкопластического тела Бингама, проявляющего вязкие и упругие свойства в зависимости от напряжения, представляет собой комбинацию элементов Гука, Ньютона и пластического тела Сен-Венана-Кулона (рис. 13.6).
Рис. 13.6. Модель вязкопластического тела.Бингама
Уравнение Бингама имеет вид:
T *
Скорость деформации равна 0 при T , а при |
T она |
возрастает с увеличением напряжения. Напряжение |
состоит из |
двух составляющих: напряжения T , необходимого для разрушения структуры и напряжения T , осуществляющего собственно течение.
Величина * называется пластической вязкостью. Графически она определяется ctg угла наклона прямой, выходящей из точки
T . По физическому смыслу ньютоновская вязкость отличается
от пластической вязкости * . Между ньютоновской и пластической вязкостью существует соотношение, которое получается комбинированием уравнений Ньютона и Бингама:
тем лучше идет растворение. Значение 1 характеризует не
скорость растворения, а взаимодействие растворителя с полимером. Растворитель, сильно взаимодействующий с полимером, называют хорошим растворителем. Хороший растворитель сильнее взаимодействует с полимером, чем молекулы полимера друг с другом. Молекулы хорошего растворителя стремятся окружить полимерные цепи и уменьшить число контактов полимер – полимер. Полимерный клубок сильно набухает в хорошем растворителе. Вследствие этого при увеличении концентрации увеличивается отталкивание соседних молекул полимера. В результате этого химическая активность а2
увеличивается сильнее, чем концентрация С2 , и в вириальном разложении:
d lna2 |
1 2A |
М С |
2 |
3A |
M C2 |
... |
|
||||||
2 |
|
3 |
3 |
|
||
d lnC2 |
|
|
|
|
|
|
второй коэффициент положителен.
Растворитель, который слабо взаимодействует с полимером,
называют плохим растворителем.
Другим критерием качества растворителя является
коэффициент набухания , равный отношению размера клубка макромолекулы, взаимодействующей с растворителем, к
размерам клубка, не возмущенного взаимодействиями:
|
|
|
1 |
|
|
|
||
α |
r |
|
2 |
|
|
|
|
|
|
2 |
|
(14.13) |
|||||
|
|
1 |
|
|||||
|
r0 |
2 |
|
|
|
|||
2 |
|
|
||||||
Изменение объема молекулярного клубка в результате его взаимодействия с хорошим растворителем называется объемным,
или осмотическим, эффектом.
Третий критерий термодинамического сродства растворителя к
10 |
www.mitht.ru/e-library |
47 |
