
КХ часть 3
.pdfФедеральное агентство по образованию Российской Федерации
Московская государственная академия тонкой химической технологии
им. М. В. Ломоносова
Кафедра коллоидной химии
И. А. Туторский
ВВЕДЕНИЕ В КОЛЛОИДНУЮ ХИМИЮ.
ЧАСТЬ 3.
ПОЛУЧЕНИЕ ДИСПЕРСНЫХ СИСТЕМ.
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ СВОЙСТВА
КОЛЛОИДНЫХ СИСТЕМ.
ОПТИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ СИСТЕМ.
Учебное пособие
Москва 2008
www.mitht.ru/e-library
ББК 24.6
УДК 541.18.05+539.219.1+541.18.043+541.18.051
И. А. Туторский
Получение дисперсных систем. Молекулярно-кинетические свойства коллоидных систем. Оптические свойства коллоидных систем. Учебное пособие М., МИТХТ им. М. В. Ломоносова, 2008 – 74 с.
Данное учебное пособие соответствует программе лекционных курсов “Колойдная химия” и “Поверхностные явления и дисперсные системы” для студентов 3 и 4 курсов для направления бакалавриата 510500 “Химия” и 550800 “Химическая технология и биотехнология” очной формы обучения. В нем излагаются диспергационные и конденсационные методы получения ультрадисперсных частиц и коллоидных систем, строение мицелл ионно-стабилизованных золей, оптические и молекулярно-кинетические свойства коллоидных систем, теории строения двойного электрического слоя.
Утверждено Библиотечно-издательской комиссией МИТХТ в качестве учебного пособия.
© МИТХТ им. М. В. Ломоносова, 2008
2
www.mitht.ru/e-library
Учебное пособие
И. А. Туторский
ВВЕДЕНИЕ В КОЛЛОИДНУЮ ХИМИЮ. ЧАСТЬ 3.
ПОЛУЧЕНИЕ ДИСПЕРСНЫХ СИСТЕМ. МОЛЕКУЛЯРНО-
КИНЕТИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ СИСТЕМ. ОПТИЧЕСКИЕ
СВОЙСТВА КОЛЛОИДНЫХ СИСТЕМ.
Подписано в печать…………..Формат 60x90/16. Бумага писчая. Отпечатано на ризографе. Уч. изд. Тираж 500 экз. Заказ №………..
Московская государственная академия тонкой химической технологии им. М. В. Ломоносова
Издательско-полиграфический центр.
119571 Москва, пр. Вернадского 86
74
8. Получение дисперсных систем
8.1. Введение
Дисперсные системы занимают промежуточное положение между макроскопическими гетерогенными системами и молекулярными растворами - гомогенными системами. Это позволяет получать дисперсные системы двумя путями: диспергированием макроскопических фаз (диспергационный путь образования) и конденсацией из истинных растворов или однокомпонентных гомогенных систем (конденсационное образование). В большинстве случаев образование дисперсных систем требует затраты работы, либо подводимой извне, например в виде механической энергии, либо за счет протекания внутренних, в частности химических, процессов в самой системе. Возникшие таким образом дисперсные системы являются термодинамически неравновесными и требуют для своего сколько-нибудь длительного существования специальной стабилизации. Их называют лиофобными.
Существуют также дисперсные системы, способные возникать в результате самопроизвольного (т.е. без затраты подводимой извне механической работы) диспергирования макроскопоческой фазы. Такие системы термодинамически равновесны и не нуждаются в дополнительной стабилизации. Их называют лиофильными. К ним относятся растворы высокомолекулярных соединений, мицелярные растворы поверхностно-активных веществ. Основным свойством лиофобных дисперсных систем, как уже отмечалось, является их термодинамическая неустойчивость. Она связана с большим запасом свободной поверхностной энергии на развитой межфазной поверхности. Наличие большой поверхностной энергии обусловлено коллоидным состоянием, точнее высокой дисперсностью и
3
www.mitht.ru/e-library
гетерогенностью системы, что следует из фундаментального |
Содержание |
|
|||||||||
уравнения Гиббса |
для |
гетерогенных |
систем. При постоянных |
|
|||||||
температурах |
и |
составе поверхностная |
энергия |
определяется |
8. Получение дисперсных систем |
3 |
|||||
произведением поверхностного натяжения на площадь поверхности |
|||||||||||
8.1. Введение |
3 |
||||||||||
S : |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
8.2. Конденсационные способы образования дисперсных систем ........ |
4 |
||
|
|
|
F S |
(8.1) |
|
|
8.3. Строение мицелл различных золей............................................... |
10 |
|||
Поэтому в них самопроизвольно |
происходит процесс слипания |
8.4. Диспергационные методы получения дисперсных систем............ |
13 |
||||||||
частиц дисперсной фазы – коагуляция. |
|
|
|
|
8.5. Образование лиофильных коллоидных систем............................. |
23 |
|||||
Для придания устойчивости против слипания – агрегативной |
9. Молекулярно-кинетические свойства коллоидных систем............... |
25 |
|||||||||
устойчивости – необходимо создавать на поверхности частиц |
9.1. Введение......................................................................................... |
25 |
|||||||||
защитные слои: двойные электрические слои, приводящие к |
9.2. Броуновское движение.................................................................... |
26 |
|||||||||
возникновению |
|
электростатического |
отталкивания |
(ионно- |
9.3. Диффузия........................................................................................ |
30 |
|||||
электростатический |
фактор |
устойчивости). |
Этот |
фактор |
9.4. Седиментация и методы седиментационного анализа ................. |
36 |
|||||
реализуется при введении в коллоидную систему электролитов, |
10. Оптические свойства коллоидных................................................... |
44 |
|||||||||
имеющих в своем составе один из ионов, входящих в состав агрегата |
систем..................................................................................................... |
44 |
|||||||||
дисперсной фазы коллоидной системы или изоформный ему. |
|
10.1. Явления, наблюдаемые при взаимодействии видимого света с |
|||||||||
При введении в коллоидную систему поверхностно-активных |
веществом.............................................................................................. |
44 |
|||||||||
веществ и высокомолекулярных соединений |
образуются сольватные |
10.2. Рэлеевское рассеяние света........................................................ |
45 |
||||||||
или адсорбционно-сольватные слои, которые в силу своих особых |
10.3. Рассеяние малыми частицами. .................................................... |
47 |
|||||||||
структурно-механических свойств препятствуют соприкосновению и |
10.4. Рассеяние большими частицами.................................................. |
50 |
|||||||||
слипанию частиц (структурный фактор устойчивости) |
|
10.5. Анализ уравнения Рэлея............................................................... |
52 |
||||||||
8.2. Конденсационные способы образования |
10.6. Поглощение света дисперсными системами................................ |
54 |
|||||||||
10.7. Турбидиметрический метод определения коллоидных частиц |
55 |
||||||||||
|
|
дисперсных систем |
|
|
|||||||
|
|
|
|
10.8. Световая микроскопия |
61 |
||||||
|
|
|
|
|
|
|
|
|
|||
При образовании дисперсных систем под конденсацией понимают возникновение новой фазы путем соединения молекул, ионов или атомов в гомогенной среде.
Процессы возникновения и роста зародышей новых фаз лежат в основе конденсационных методов образования дисперсных систем.
4 |
73 |
www.mitht.ru/e-library
Наиболее важной частью микроскопа является колонна,
заключающая в себе электронно-оптическую систему. В состав последней входят осветительная система (электронная пушка),
камера объектов, фокусирующая система и фотографическая камера.
Электронный пучок в колонне электронного микроскопа формируется с помощью электрического и магнитного полей, которые действуют подобно линзам.
Электронный пучок существует только в высоком вакууме. Длина свободного пробега электронов при напряжении 60 кэВ в воздухе при атмосферном давлении равна всего 1 10 4 м. С помощью вакуумной системы в колонне создается остаточное давление
10 4 10 5 мм рт.столба. При этом давлении длина свободного пробега электронов составляет 1,5 м.
С помощью системы высокого напряжения создается ускоренный пучок электронов. В современных электронных микроскопах применяется высокое напряжение до 150 кВ. Большое значение имеет стабильность высокого напряжения, которая обеспечивается применением электронных стабилизаторов.
72
Образование систем высокой дисперсности по конденсационному механизму возможно, если, с одной стороны, возникает большое число зародышей новой, термодинамически более стабильной фазы,
с другой стороны, скорость роста этих зародышей лежит в области определенных умеренных значений.
Факторы, приводящие к появлению новой фазы, можно разделить на две группы: химические, т.е. протекание химических реакций,
приводящие к возникновению высоких концентраций слаборастворимого соединения и физические такие как изменения давления, температуры.
Химические методы создания перенасыщения чрезвычайно разнообразны. Любая реакция, приводящая к образованию нерастворимого, а в случае конденсированных фаз и летучего продукта (или, наоборот, нелетучего – при взаимодействии газов),
может использоваться для получения коллоидной системы. К
образованию золей приводят различные химические реакции:
окисления-восстановления, обмена, гидролиза и др. Эти реакции рассматриваются ниже.
Реакция обмена
С помощью реакции обмена можно получить различные золи. Этим способом получают золи галогенидов, сульфидов и гидроксидов металлов. Характерным примером синтеза золей с использованием реакции обмена является получение гидрозолей иодида серебра. Эти золи часто служат моделями при изучении различных коллоидных процессов.
AgNO3 KCl AgI KNO3
5
www.mitht.ru/e-library
Реакции восстановления
Эти реакции лежат в основе многочисленных методов получения золей золота и серебра при взаимодействии солей этих металлов с различными восстановителями: фосфором (Фарадей), таннитом
(Оствальд), формальдегидом (Зигмогди), ацетоном (Девис), например:
2KAuO2 2HCHO 2Au HCOOK KHCO3 H2O
Реакция окисления
Они широко распространены в процессов является образование сероводорода, растворенного в кислородом.
природе. Примером таких золя при взаимодействии гидротермальных водах, с
2H2S O2 2S 2H2O
Гидролиз солей
Процессы гидролиза солей широко распространены в природе и имеют важное значение в технике. Эти процессы применяются для очистки сточных вод. Высокая удельная поверхность образующихся при гидролизе гидроксидов позволяет эффективно адсорбировать примеси. Примером является реакция гидролиза хлорного железа.
FeCl3 3H2O Fe(OH)3 3HCl
В природных условиях часто протекает реакция гидролитического окисления растворимых солей железа с образованием гидроксида железа. На большой глубине при отсутствии кислорода эта реакция не идет и вода, содержащая Fe(HCO3 )2 , прозрачна. На воздухе быстро протекает гидролитическое окисление по схеме:
4Fe(HCO3)2 2H2O O2 4Fe(OH)3 8CO2
6
(растровые). Принцип действия просвечивающего микроскопа рассмотрен выше.
В настоящее время для изучения поверхности различных объектов широко применяются сканирующие электронные микроскопы. В этом случае не требуется специального препарирования образца, что исключает изменение структуры образца при препарировании и наблюдение ложной структуры
(артефактов). Сканирующий микроскоп применяется для получения изображения поверхностей непрозрачных объектов. В отличие от просвечивающего микроскопа, в сканирующем микроскопе изображение формируется за счет вторичных электронов. Вторичные электроны, исходящие с поверхности объекта под действием электронного пучка, улавливаются и усиливаются. Электронный пучок,
имеющий диаметр 2 10 8 м , с помощью отклоняющих систем перемещается по зигзагу, то есть сканирует поверхность образца.
Изображение на экране формируется так же, как в телевизоре, отчего микроскоп называется сканирующим. В сканирующем микроскопе диэлектрические материалы непосредственно исследоваться не могут, так как на их поверхности накапливается заряд, мешающий получению изображения. На такие материалы напыляют тонкий проводящий слой, чаще всего золота.
Основные части электронного микроскопа и их назначение.
Электронный микроскоп является сложным устройством,
состоящим из различных частей (систем), каждая из которых имеет свое назначение. Этими частями являются электронно-оптическая система, вакуумная система, система высокого напряжения, система управления и автоматизации.
71
www.mitht.ru/e-library
и плотные участки выглядят на экране более темными по сравнению с тонкими и менее плотными участками, то есть создается контрастное
изображение.
Характеристики изображения.
Электронно–микроскопическое изображение характеризуется следующими параметрами.
1.Предел разрешения, о котором говорилось выше.
2.Контраст, то есть освещенность светлой и темной части изображения.
3.Глубина резкости, то есть максимальная толщина образца, в
которой можно получить резкое изображение. Глубина резкости соответствует высоте неровностей образца.
4.Интенсивность определяется временем, в течение которого можно получить изображение.
Для увеличения контраста изображения надо, чтобы разные участки объекта различались по рассеивающей способности.
Контрастирование достигается введением в образец контрастных атомов химическим или физическим путем. Контраст бывает двух типов. Первый тип контраста возникает в разнотолщинных образцах.
Участки разной толщины по-разному рассеивают электроны и вызывают разное свечение экрана или почернение пластинки. Второй тип контраста, называемый дифракционным, связан с избирательным отражением электронов от кристаллографических поверхностей в кристалле в определенных направлениях.
Типы электронных микроскопов.
По способу исследования электронные микроскопы делятся на просвечивающие, отражающие, эмиссионные и сканирующие
70
Эта реакция приводит к бурой окраске болот и к выпадению бурого осадка Fe(OH)3 при стоянии вначале прозрачной воды из водопроводной сети, если вода содержит хорошо растворимый
Fe(HCO3 )2 .
При физической конденсации образование новой фазы обычно связано с изменением температуры или давления в системе.
Конденсация паров
Сущность метода заключается в том, что в газообразной системе при изменении температуры давление пара может стать выше равновесного давления пара над жидкостью или твердым телом и в газообразной фазе возникает новая жидкая или твердая фаза.
Система становится гетерогенной, образуются аэрозоли (туман, дым).
Путем испарения и конденсации паров в потоке несущего газа получают коллоидные частицы (наночастицы) металлов, углерода,
кремния. Наночастицы осаждают на подложку при изменении температуры стенок камеры. В момент плавления для стабилизации наночастиц вводят поверхностно-активные вещества. Существуют различные методы испарения твердых веществ: плазмохимический,
взрывной, под действием лазерного излучения и др.
Плазмохимическим методом получают нанопорошки металлов и кремния. Взрывной метод заключается в регулируемом взрыве смеси углеродсодержащих взрывчатых веществ, в результате чего образуется порошкообразный наноалмаз. В специальных условиях образуются другие аллотропные формы наноуглерода - углеродные нанотрубки и фуллерены С60 и С70 , представляющие собой полые наносферы с икосаэдрической упаковкой. Порошкообразный технический углерод (сажа) получается сжиганием углеродного сырья.
7
www.mitht.ru/e-library

Замена растворителя
Метод основан на изменении состава среды таким образом, что химический потенциал компонента в дисперсной среде становится выше равновесного и тенденция к переходу в равновесное состояние приводит к образованию новой фазы. Так может быть получен золь канифоли. Если насыщенный раствор канифоли в этиловом спирте влить в большой объем воды, то полученный раствор в спирто-водной среде оказывается пересыщенным. Пересыщение приводит к агрегированию частиц канифоли, система становится гетерогенной,
образуется коллоидная система – золь канифоли.
Таким путем могут быть получены гидрозоли серы, фосфора,
мышьяка, многих других веществ.
По теории П. Веймарна размеры образующихся частиц зависят от соотношения между скоростями двух одновременно идущих процессов: образования зародышей (нуклеации) Vн и их роста
(кристаллизации) Vк .
Рис. 8.1. Зависимость размера частиц BaSO4 от концентрации.
8
Схема формирования изображения в электронном микроскопе
показана на рис. 10.9.
Рис. 10.9. Схема формирования изображения в электронном микроскопе
просвечивающего типа.
В формировании изображения большое значение имеет апертурная диафрагма, имеющая очень малый диаметр (порядка нескольких сотых мм). Даже при небольшом рассеянии через диафрагму проходит только часть электронов, остальные задерживаются ею. Чем больше толщина объекта, тем на большие углы рассеиваются электроны и меньше электронов проходит через диафрагму и попадает на флюоресцирующий экран. Пучок электронов в точке C , прошедший наиболее толстую часть образца и имеющий наибольший угол рассеяния, доходит до экрана C' значительно ослабленным. В этом месте интенсивность свечения экрана мала.
Пучок электронов, прошедший через тонкую часть объекта в точке B
рассеивается на меньший угол, поэтому через отверстие диафрагмы проходит больше электронов, что вызывает более яркое свечение экрана в точке B'. В точке A, где объект отсутствует, пучок электронов попадает на экран без заметного рассеяния. экран в точке
A' будет светиться с наибольшей яркостью. Таким образом, толстые
69
www.mitht.ru/e-library

формировании изображения в электронном микроскопе принимают участие электроны, рассеянные вследствие упругих соударений.
Кроме того, при взаимодействии электронов с атомами образуются
вторичные электроны (e3 ) и -кванты, используемые в сканирующей
электронной микроскопии.
Формирование изображения в электронном микроскопе.
Принципы, на которых основано формирование изображения в световом и электронном микроскопе, различны. В световом микроскопе изображение образуется вследствие различного поглощения света различными участками объекта. В электронном микроскопе изучают такие объекты, которые прозрачны для электронов, ибо поглощение электронов вызывает нагревание и разложение образца. Это достигается применением ультратонких образцов.
Образование изображения в электронном микроскопе связано с различным рассеянием электронов разными участками объекта.
Количество соударений электронов с атомами объекта зависит от толщины объекта, его плотности и скорости электронов. Угол отклонения электрона от первоначального направления тем больше,
чем тяжелее атом (больше его порядковый номер) и чем больше путь электрона, то есть толщина образца. Зависимость угла отклонения электронов от названных величин выражается формулой
tg K d z U0
где d – толщина образца; z – атомный номер элемента; U0 –
ускоряющее напряжение; K – константа.
68
Размер частиц коллоидных систем зависит от концентрации реагирующих веществ при образовании умеренно растворимых веществ. Такая зависимость имеет максимум при получении сульфата бария (рис. 8.1):
Ba(СNS)2 MgSO4 BaSO4 Mg(CNS)2
В области 1 скорость нуклеации Vн достаточна, но Vк скорость
роста кристаллов невелика, так как концентрация C небольшая.
Поэтому образуется коллоидная система - золь. В области 2 с
увеличением концентрации Vк роста увеличивается, частицы быстро укрупняются и под действием силы тяжести оседают, образуется осадок. В области 3 при высокой концентрации вещества,
образующего дисперсную фазу, вязкость возрастает, скорость диффузии вещества из раствора к поверхности зародыша уменьшается. При высокой скорости нуклеации образуется много мелких частиц, которые соединяются друг с другом, образуя структированную коллоидную систему – гель.
Другим примером влияния концентрации реагирующих веществ при получении коллоидных систем является получение золя берлинской лазури.
K4[Fe(CN )6 ] 4FeCl 3 |
Fe4[Fe(CN )6 ]3 12KCl |
желтая кровяная соль |
берлинская лазурь |
При использовании очень разбавленных растворов реагентов образуется устойчивый золь берлинской лазури. Если сливать концентрированные растворы реагентов, то образуется густой гель берлинской лазури. А при сливании 10-кратно разбавленных концентрированных растворов реагентов никогда не получится золь -
образуется осадок.
9
www.mitht.ru/e-library
Во время образования коллоидной системы можно вводить вещества, препятствующие возникновению зародышей или тормозящие их рост.
Действие этих веществ вызвано их адсорбцией на поверхности зародышей и образованием слоя, препятствующего дальнейшей достройке кристаллической решетки зародыша. Под влиянием специальных добавок может по-разному изменяться скорость роста отдельных граней кристаллика.
Важная особенность конденсационного получения коллоидных дисперсных трудно растворимых веществ заключается в том, что высокое пересыщение может приводить первоначально к возникновению аморфизированных частиц. Дальнейшая кристаллизация может сопровождаться их измельчением, по-
видимому, из-за возникающих при кристаллизации больших внутренних напряжений. В зависимости от природы вещества аморфизированное состояние может сохраняться от нескольких минут
(золь золота) до часов, дней или даже лет (золи кремниевой кислоты).
8.3. Строение мицелл различных золей
Мицелла - это отдельная частица дисперсной фазы коллоидной системы с жидкой дисперсионной средой, состоящая из кристаллического или аморфного ядра и поверхностного слоя,
включающего сольватно связанные молекулы окружающей жидкости.
Поскольку размер мицеллы составляют несколько десятков нм, для частиц такого типа названия «мицелла» и «нано частица» являются синонимами.
Рассмотрим образование мицеллы на примере реакции хлорида бария с сульфатом натрия
10
предел разрешения электронного микроскопа равен 4 10 10 м. При
U0 , равном 100кВ , 4 10 12 м. При значении апертурного угла
0,02 рад разрешающее расстояние микроскопа достигает 2 10 10 м.
Если предел разрешения электронного микроскопа принять равным
2 10 10 м, а светового – 2 10 7 м, то количество информации,
получаемое с помощью электронного микроскопа, превышает количество информации, получаемое с помощью светового, в 106 раз.
Взаимодействие электронов с объектом.
Для понимания формирования изображения в электронном микроскопе необходимо рассмотреть основные физические процессы,
происходящие при прохождении пучка электронов через объект.
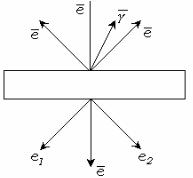
Рис. 10.8. Прохождение электронов через образец.
При прохождении через образец электроны сталкиваются с атомами вещества, из которого состоит образец. Соударения могут быть упругими (e1 ), то есть не связанными с потерей энергии
электрона, и неупругими (e2 ), при которых электрон теряет часть своей энергии. В обоих случаях направление движения электронов изменяется. Часть электронов проходит через объект без соударений с атомами и не меняет своего первоначального направления. В
67
www.mitht.ru/e-library
