
3_2009_primer (1)
.pdfСтуденческий портал МИТХТ http://www.mitht.org
3.2.Решение задач
Пр и м е р 3.2.1. Для обратимой реакции первого порядка
А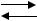 В (k1, k-1, K)
В (k1, k-1, K)
константа равновесия К= 4, а константа скорости прямой реакции k1=0,02 мин-1. Рассчитайте время, за которое концентрации реагента и продукта сравняются, если начальная концентрация [B]0 = 0.
Решение. Из величины константы равновесия и материального баланса находим равновесную концентрацию продукта
[B]∞ = К [А]∞ = К([А]0 − [В]∞) = К([А]0 /(1+К) = 0,8 [А]0
и константу скорости обратной реакции
k-1 = k1 /К = 5.10-3 мин-1.
Подставляем полученные данные в уравнение (3.3) и находим
τ= |
|
|
1 |
|
ln |
[B] |
|
1 |
ln |
0,8[A]0 |
39,2 мин. |
||
k |
1 |
+ k |
-1 |
[B] [B] |
|
0.025 |
0,8[A] |
0,5[A] |
|||||
|
|
|
|
|
|
|
|
0 |
0 |
|
|||
П р и м е р 3.2.2.
В системе протекают 2 параллельные реакции
А + В = Х |
(k1) |
A + C = Y |
(k2) |
Отношение констант скоростей k1/ k2 = 4. Начальные концентрации В и С одинаковы. Сколько продукта Y получится к моменту времени τ, когда концентрация Х составит половину начальной концентрации В?
Решение. Напишем уравнения материального баланса и кинетические уравнения по продуктам
|
[А]0 = [А] + [Х] + [Y]; |
[В]0 = [В] + [Х]; [С]0 = [С] +[Y]; |
||||||||||
|
d[X] |
|
k |
1 |
[A] [B] k |
1 |
[A] |
[X] [Y] [B] |
[X] ; |
|||
|
|
|||||||||||
|
d |
|
|
|
0 |
0 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|||
|
d[Y] |
k |
2 |
[A] [C] k |
2 |
[A] |
[X] [Y] [C] |
[Y] |
||||
|
|
|||||||||||
|
d |
|
|
0 |
0 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|||
Найдем соотношение изменений концентраций продуктов и проинтегри- |
||||||||||||
руем полученное дифференциальное уравнение после разделения переменных
d[X] |
k1 |
[B]0 |
[X] |
|
x |
d[X] |
|
k1 |
y |
d[Y] |
||||||
|
|
|
|
|||||||||||||
|
k |
|
[C] |
[Y] |
; |
|
|
|
|
k |
|
|
|
|
|
|
d[Y] |
|
2 |
d [B] |
|
[X] |
2 |
d [C] |
[Y] |
||||||||
|
|
|
0 |
|
|
0 |
0 |
|
|
|
0 |
0 |
|
|
||
Студенческий портал МИТХТ http://www.mitht.org

Студенческий портал МИТХТ http://www.mitht.org
ln |
[B]0 |
|
k1 ln |
[C]0 |
. |
|
[B] [X] |
|
|||||
|
k |
2 |
[C] [Y] |
|||
|
0 |
|
|
0 |
|
|
Подставляя численные значения из условия задачи [X] = 0,5 [B]0, получим
(ln 2)/4 = 0,172 = −ln (1 − [Y]/[C]0); [Y]/[C]0 = 0,16 [X]/[Y] = 0,5/0,16=3,1
Таким образом, концентрация второго продукта будет примерно в 3 раза меньше концентрации первого.
П р и м е р 3.2.3.
Пентамминофосфатный комплекс кобальта(Ш) (А) последовательно преобразуется в присутствии избытка щелочи при 5ºС:
|
|
(H3N)4Co -O-P=O + |
OH O |
|
(H3N)5Co-O-P=O OH− |
OH− (H3N)4Co |
P=O |
||
(А) |
X O |
H2N O (+X−) |
H2N |
O |
Все 3 формы комплекса дают разные сигналы от атома 31Р в спектре ЯМР, что позволило измерить изменение их относительных количеств во времени.
Зависимость % содержания исходной формы представлена так:
τ, мин |
0 |
4 |
10 |
15 |
20 |
30 |
[A]/ [A]0, % |
100 |
83 |
68 |
58 |
45 |
27 |
Максимальное содержание промежуточной формы (30%) достигается через 21 мин. Определить константы скорости k1 и k2.
Решение. Константу скорости k1 легко определить по кинетической кривой реагента, построив график ln[A]/ [A]0 − τ. Отсюда k1=0,0375 мин-1; k2 может
быть найдена по уравнению 3.10: [P]max/[A]0 = exp(-k2τmax). k2 = -(ln 0,3)/21 = 0,0573 мин-1.
П р и м е р 3.2.4.
Взаимодействие брома с водородом
H2 + Br2 = 2 HBr
протекает по следующему механизму:
|
k1 |
|
|
Вr2 + M |
2 Br + M, |
r1 = k1[Br] [M] |
|
|
k2 |
|
|
H2 + Br |
HBr + H, |
r2 = k2 H2 Br |
|
|
k3 |
|
|
H + Br2 |
HBr + Br, |
r3 = k3 H Br2 |
(3.12) |
|
k4 |
|
|
HBr + H |
H2 + Br, |
r4 = k4 HBr H |
|
|
k5 |
r5 = k5 Br 2 [M], |
|
2 Br + M |
Br2 + M , |
|
Студенческий портал МИТХТ http://www.mitht.org

Студенческий портал МИТХТ http://www.mitht.org
где М - любая частица, отводящая или подводящая энергию. Вывести кинетическое уравнение образования продукта в приближении МКСК.
Решение. Механизм реакции содержит три линейно независимые стадии, так как пары реакций 1 и 5, 2 и 4 являются обратными друг другу. Следовательно, из 5 кинетических уравнений стадий можно составить только 3 независимых уравнения скорости по веществам. Удобнее всего написать кинетические уравнения по активным промежуточным частицам - атомам брома и водорода - и скорость по продукту
rBr = 2 r1 - r2 + r3 + r4 - 2r5 = 0; |
|
r1 |
= r5 ; |
(3.13) |
|
rH = r2 - r3 - r4 = 0; |
|
|
r2 |
= r3 + r4 ; |
|
|
|
(3.14) |
|||
rHBr = r2 + r3 - r4 0. |
|
|
rHBr = 2 r3 = 2 k3 [Br2].[H]. |
|
|
Рекомендуем найти соотношения между скоростями стадий, не подставляя их выражения (3.12), чтобы облегчить алгебраические преобразования. Только после этого, используя полученные соотношения между скоростями стадий и кинетические уравнения стадий, найдем квазистационарные концентрации активных частиц
k1 Br2 = k5 Br |
2 |
|
|
Br = |
|
|
k1 |
Br2 |
1/2 |
, |
|
(3.15) |
||||||||||||
|
|
|
|
k5 |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k2 H2 Br = H (k3 |
Br2 + k4 HBr ) |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
2 |
[H |
2 |
] |
k1 [Br ]2 |
|
|||||||
|
|
|
k2 [H2 ][Br] |
|
|
|
|
|
|
|
|
k5 |
|
2 |
|
|
|
|||||||
H = |
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
. |
(3.16) |
||||||
k |
3 |
[Br ] + k |
4 |
[HBr] |
|
|
k |
3 |
[Br ] + k |
4 |
[HBr] |
|||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
||||||
Теперь можно вывести уравнение скорости для продукта, не содержащее концентраций активных частиц, а включающее только измеряемые концентрации реагентов и продуктов.
|
|
|
|
|
|
|
|
|
] k |
3 |
|
|
|
|
|
|
|
1 |
|
|
|
2k |
2 |
k |
3 |
[H |
2 |
1 [Br ]2 |
|
2k |
2 |
[H |
2 |
] |
|
k1 [Br ]2 |
|
||||
|
|
|
|
|
k |
2 |
|
|
|
|
|
2 |
|
|||||||
rHBr = |
|
|
|
|
|
|
|
|
5 |
= |
|
|
|
|
|
|
k5 |
. |
||
k |
3 |
[Br ] k |
4 |
[HBr] |
|
|
|
k4[HBr] |
||||||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
1 + k |
|
[Br ] |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
Кроме кинетических уравнений, метод квазистационарных концентраций позволяет упростить уравнения материального баланса, исключив из них кон-
Студенческий портал МИТХТ http://www.mitht.org

Студенческий портал МИТХТ http://www.mitht.org
центрации активных частиц, что делает их идентичными с уравнениями баланса простых реакций и позволяет описывать кинетику сложной реакции одним приближенным кинетическим уравнением.
Для рассматриваемой реакции 2 уравнения материального баланса по брому и водороду принимают вид:
H2 0 = H2 + 1/2 HBr ;
Br2 0 = Br2 + 1/2 HBr .
Отсюда скорость реакции может быть выражена через изменение концентрации любого стабильного вещества - реагента или продукта:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
k |
2 |
[H |
2 |
] |
k1 [Br ]2 |
|
||
|
d |
|
d |
|
1 |
d |
|
|
|
|
k5 |
2 |
|
|||
r = - |
[H2] = - |
[Br2] = |
[HBr] = |
|
|
|
|
|
|
(3.17) |
||||||
d |
d |
|
|
|
|
|
k4[HBr] |
|||||||||
|
|
|
2 d |
|
|
|
1 + |
|
||||||||
|
|
|
|
|
|
|
|
|
|
k |
3 |
[Br ] |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
Таким образом, получено уравнение скорости реакции в квазистационарном режиме. В МКСК при интегрировании этого дифференциального уравнения пренебрегают временем установления квазистационарного режима, т.е. в качестве нижнего предела интегрирования подставляют нуль.
Пр и м е р 3.2.5. Вывести кинетическое уравнение образования продукта
вреакции взаимодействия брома с водородом на начальном этапе реакции в условиях квазиравновесного режима. Определить лимитирующую стадию реакции.
Решение. Обратимся снова к анализу реакции брома с водородом, механизм которой и кинетическое уравнение в квазистационарном режиме рассмотрены в предыдущем примере. Если использовать формальный признак скорость определяющей стадии, то легко видеть, что в качестве лимитирующей выступа-
ет вторая стадия механизма, так как именно ее константа скорости k2 присутствует в кинетическом уравнении в виде абсолютного значения, в то время как остальные константы скорости содержатся в кинетическом уравнении в виде отношения.
Если отвлечься от знаменателя в кинетическом уравнении реакции, связанным с обратным маршрутом общего процесса взаимодействия брома и водорода (такое допущение справедливо в начале реакции, когда продукт еще не накоплен, и можно пренебречь отношением k4[HBr]/k3[Br2] по сравнению с единицей в знаменателе общего кинетического уравнения), то механизм реакции можно представить в виде двух стадий, первая из которых обатима:
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
Br2 |
k1 |
2Br |
k5 |
||
H2 + Br |
k2 |
H + HBr |
|
Первая стадия представляет собой быстро устанавливающееся равновесие, термодинамическая константа (К) которого равна отношению равновесных концентраций атомного и молекулярного брома
[Br] 2 K = [Br2 ] .
Если равновесная концентрация атомарного брома мала по сравнению с концентрацией молекулярного брома, то последнюю можно заменить текущей концентрацией реагента (в противном случае следует воспользоваться уравнениями материального баланса). Отсюда равновесная концентрация атомарного брома, который служит промежуточной формой, равна
1
[Br]∞ =  K [Br2 ]2 ,
K [Br2 ]2 ,
а скорость реакции равна скорости второй, лимитирующей стадии при равновесной концентрации атомарного брома
|
1 |
|
r = k2[Br] [H2] = k2 |
K [Br ]2 |
[H2], |
|
2 |
|
константа равновесия, в свою очередь, равна отношению констант скоростей прямой и обратной реакции в равновесной стадии
К = k1 / k5 .
Отсюда скорость взаимодействия брома с водородом на начальном этапе будет описываться кинетическим уравнением:
|
k1 |
1 |
|
|
r = k2 |
[Br ]2 |
[H2], |
||
|
||||
|
k5 |
2 |
|
|
|
|
|
которое совпадает с числителем общего уравнения. Порядок по водороду равен 1 и совпадает с модулем стехиометрического коэффициента этого вещества в лимитирующей стадии. Порядок по брому равен 1/2, что соответствует модулю его стехиометрического коэффициента в предшествующей равновесной стадии, которую следует записать в виде
1/2 Br2 = Br
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
чтобы коэффициенты при атомарном броме были численно одинаковыми в oбеих реакциях. Третья и четвертая стадии реакции как следующие после лимитирующей не отражаются на виде кинетического уравнения начального этапа процесса, когда реакцию можно считать одномаршрутной, пренебрегая обратной реакцией. В общем уравнении скорости отношение k4[HBr]/k3[Br2] в знаменателе отражает конкуренцию двух маршрутов превращения атомарного водорода при взаимодействииего с бромом или с бромистым водородом после лимитирующей стадии.
Студенческий портал МИТХТ http://www.mitht.org
