
2_2009_theory-primer (1)
.pdfСтуденческий портал МИТХТ http://www.mitht.org
2.ТЕОРИИ ХИМИЧЕСКОЙ КИНЕТИКИ
2.1.Зависимость константы скорости от температуры
2.1.1.У р а в н е н и е А р р е н и у с а. Скорость химических реакций обычно сильно зависит от температуры. Так, по правилу Вант-Гоффа для реакций в растворах при повышении температуры на десять градусов скорость увеличивается в 2-3 раза. Математически зависимость константы скорости от температуры выражается экспоненциальным уравнением
Аррениуса |
k = А exp(- |
E |
), |
(2.1) |
|
R T |
|||||
|
|
|
|
параметры которого называются: А - предэкспонентом, Е - энергией активации.
В логарифмической форме уравнение Аррениуса принимает линейную
форму от обратной температуры |
|
|
|
|
|
|
|
|
ln k = ln B − |
E |
|
, |
(2.2) |
||||
RT |
||||||||
|
|
|
|
|
||||
или в дифференциальном виде |
|
|
|
|
|
|
|
|
dlnk |
|
E |
|
|
||||
dT |
|
RT2 |
. |
|
(2.3) |
|||
Параметры уравнения Аррениуса определяются экспериментально при изучении температурной зависимости константы скорости. Если имеются значения константы скорости при двух температурах, то энергия активации рассчитывается по формуле
|
E |
RT1T2 ln k2 |
/ k1 |
(2.4) |
|
|
|
T2 T1 |
|
|
|
При большем количестве опытных точек, строят график зависимости |
|||||
lnk = f(1/T), |
угловой коэффициент |
наклона |
которого равен -Е/R в |
||
соответствии |
с уравнением |
(2.2). |
Так |
как |
температурный интервал |
экспериментальных данных обычно не превышает нескольких десятков градусов, графическое определение предэкспонента А затруднено из-за необходимости далекой экстраполяции. Поэтому величину А рассчитывают аналитически из уравнения 2.1, используя экспериментальные значения k при разных температурах и найденное значение энергии активации.
Студенческий портал МИТХТ http://www.mitht.org

Студенческий портал МИТХТ |
|
||||||
|
http://www.mitht.org |
|
|
||||
П р и м е р 2.1.1 |
|
|
|
|
|
|
|
Для реакции йодистого этила с алкоголятом натрия в этиловом спирте |
|||||||
|
|
CH3I + C2H5O- = CH3OC2H5 + I- |
|
||||
найдены следующие значения константы скорости второго порядка |
|||||||
t, 0C |
|
|
0 |
6 |
12 |
18 |
24 |
k 105, л/(мол с) |
|
5,00 |
11,8 |
24,5 |
48,8 |
100 |
|
Определить энергию активации реакции и предэкспоненциальный член |
|||||||
уравнения Аррениуса, рассчитать константу скорости при 15 о С. |
|||||||
Решение. |
Рассчитаем необходимые для |
построения графика 2.2 |
|||||
величины |
|
|
|
|
|
|
|
|
T, K |
|
273 |
279 |
285 |
291 |
297 |
T-1 103, К- 1 |
3,663 |
3,584 |
3,508 |
3,436 |
3,367 |
||
|
ln k |
|
1,609 |
2,468 |
3,199 |
3,888 |
4,605 |
(Обращаем Ваше внимание на то, что при расчете величин 1/T нужна |
|||||||
учитывать третий знак после запятой, так как область изменения аргумента |
|||||||
составляет всего 0,3 единицы и в противном случае точность определения |
|||||||
искомой величины не будет соответствовать точности экспериментальных |
|||||||
данных) |
|
|
|
|
|
|
|
Построим график |
ln k - 1/T и найдем угловой коэффициент его наклона |
||||||
(рис. 2.1) |
|
|
|
|
|
|
|
0,0033 |
0,0034 |
0,0035 |
0,0036 |
0,0037 |
|
|
|
-6 |
|
|
|
|
|
|
|
ln k |
|
|
|
|
|
y = 26,8326 -10020,76 x: |
|
|
|
|
|
|
r = 0,999716 |
||
-7 |
|
|
|
|
|
|
|
-8 |
|
|
|
|
|
ln k |
|
|
|
|
|
|
|
||
-9 |
|
|
|
|
|
|
|
-10 |
|
|
|
|
|
|
|
|
|
|
1/ T |
|
|
|
|
Рис. 2.1. Зависимость логарифма константы скорости реакции от |
|||||||
обратной температуры. |
|
|
|
|
|
||
Студенческий портал МИТХТ http://www.mitht.org

Студенческий портал МИТХТ http://www.mitht.org
tg = -9,74 + 7,237/(3,65 - 3,4) 10-3 = -10,02 103 К, такое же значение коэффициента при аргументе в регрессионном уравнении.
E = - R tg = 8,314 |
Дж/(моль К) 10,02 103 К = 83306 Дж/моль = |
= 83,3 кДж/моль. |
|
Для расчета предэкспонента используем значение k при 24оС (точка хорошо лежит на графике)
lnА = ln k + E/RT = - 6,905 + 10020/297 = -6,905+33737 =26,83.
Можно использовать также значение свободного члена в регрессионном уравнении. Отсюда А = 4, 50 1011 л/(моль с)
Используя найденные параметры уравнения Аррениуса можно определить константу скорости данной реакции при любой температуре в рабочем интервале, например при 15оС
k15 =4,50 1011 exp[-83300/(8,314 288)]= 4,50 1011 7,786 10-16 = =35,0.10-5 л/(моль.с) или так
ln (k15/k24) = E (T2 -T1) /R T2 T1 = 83300 (- 9)/ (8,314 288 297 ) = - 1,054 k15/k24 = 0,349 k15 = 0,349 10-3 = 3,49 10-4 л/(моль с)
2.2. Теория активных столкновений
Теория активных столкновений предполагает, что для протекания элементарного акта химической реакции необходимо столкновение активных молекул, т.е., в первую очередь, таких энергия относительного поступательного движения которых превышает некоторый уровень,
называемый энергией активации а :
pzA2/2mA + pzB2/2mB > а, где pzi - проекция импульса i-частицы на |
|||
направление встречного движения обеих частиц (р = m u ) (см. рис. 2.2). |
|||
|
|
y |
|
|
pA |
|
|
|
|
|
рzB |
A |
pzA |
0 |
B |
|
|
||
|
x |
|
pB |
Рис.2.2. Проекции импульса относительного встречного движения двух сталкивающихся частиц.
Студенческий портал МИТХТ http://www.mitht.org

Студенческий портал МИТХТ http://www.mitht.org
Доля таких столкновений (Zакт) от общего числа столкновений в единице объема за единицу времени (Z) определяется законом распределения по энергии Больцмана Zакт /Z = exp(- а./kT).
Скорость реакции в таком случае может быть записана так :
r |
Zакт |
Z |
exp( ε a/kT) = |
Z |
exp( Ea / RT ), ( 2.5 ) |
|
|
||||
|
NA |
NA |
NA |
||
где NA - число Авогадро. Общее число двойных столкновений может быть рассчитано, если определить, сколько соударений испытывает одна молекула за единицу времени.
Все молекулы, сталкивающиеся за единицу времени с выбранной заключены в цилиндре столкновений, длина которого равна средней относительной скорости молекул (u), а сечение равно 2, где - средний газокинетический диаметр сталкивающихся молекул (см. рис 2.3.).
|
|
|
вне цилиндра |
|
|
|
А |
A |
Аi |
|
А |
А |
2 |
||
|
|
|
|
|
|
|
А |
uср
Рис.2.3. Цилиндр столкновений молекулы.
Объем цилиндра столкновений следует умножить на концентрацию молекул, с которыми сталкивается выбранная молекула. Относительная скорость молекул по закону распределения равна
u = 8 k T/ = |
8RT/ Mприведенная , |
(2.6) |
где k - постоянная Больцмана, а - приведенная масса молекул Отсюда число столкновений одной молекулы А с одноименными молекулами z(АА) составит:
z(АА) = 2u CA NA = 2 |
8k T CA NA = |
2 2 |
8RT |
CA NA, (2.7) |
|
M |
|||||
|
|
|
|
где М - молярная масса молекул А, а множитель  2 введен для учета того: что приведенная масса меньше, чем реальная масса каждой молекулы.
2 введен для учета того: что приведенная масса меньше, чем реальная масса каждой молекулы.
Число столкновений молекул А с молекулами другого типа (В) за единицу времени будет равно
Студенческий портал МИТХТ http://www.mitht.org

Студенческий портал МИТХТ http://www.mitht.org
2 |
|
2 |
8 k T |
|
2 |
8RT |
|
z(АB)= АB |
uАBCB NA= |
|
|
CB NA= |
|
|
CB NA, (2.8) |
|
|
|
M AB |
||||
|
|
|
|
|
|
где МАВ - приведенная молярная масса веществ А и В.
Формула (2.5) позволяет определить длину свободного пробега молекул, т.е. путь, проходимый молекулой между столкновениями
= |
u |
= |
1 |
1 |
. |
(2.9) |
|
zAA |
2 |
|
2CАNA |
||||
Для получения общего числа двойных столкновений одинаковых молекул в единице объема за единицу времени Z(АА) нужно умножить z(АA) на концентрацию молекул А и поделить на 2, чтобы не учитывать каждое столкновение дважды, таким образом
Z(АА)= 2 u С2 NA2 =
 2
2
|
|
|
|
|
|
1 |
|
|
2 |
8k T |
2 |
2 |
|
|
|
1 |
|
2 |
8RT 2 |
2 |
|||
|
|
|
|
|
= |
|
|
|
|
|
C NA |
|
= |
|
|
|
|
|
M C |
NA , |
|||
|
|
|
|
|
2 |
|
|
|
|
2 |
|
||||||||||||
а скорость реакции |
типа 2А = В |
получим, |
подставляя Z(АА) в уравнение |
||||||||||||||||||||
скорости (2.5) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
1 |
|
|
8 RT |
exp( |
|
E |
|
|
|
RT |
exp( |
E |
|
||||||||||
r = |
|
2 |
|
|
|
) C2 NA= 2 2 |
|
M |
|
|
) C2 NA .(2.10) |
||||||||||||
2 |
|
M |
RT |
|
|
RT |
|||||||||||||||||
Отсюда константа скорости равна |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
k = 2 2 |
RT |
NA exp ( |
|
E |
|
), |
|
|
|
|
|
(2.11) |
|||||||
|
|
|
|
M |
RT |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
где Е а.NA и представляет собой Аррениусовскую энергию активации.
Общее число столкновений разных молекул получим, умножая z(АB) на концентрацию молекул А :
Z(АB) = АB2 uАB СA СBNA = 2 |
8 k T |
NA2 СA СB = |
|
||
|
|
||||
|
|
|
|
|
|
= 2 |
8 RT |
NA2 СA СB, |
(2.12) |
||
|
|||||
|
M AB |
|
|
|
|
Подставляя (2.12) в выражение (2.5) получим уравнение скорости для бимолекулярной реакции разных молекул типа А + В = D
Студенческий портал МИТХТ http://www.mitht.org

Студенческий портал МИТХТ http://www.mitht.org
r = АB 2uАB NA exp( RTE ) СA СB =
= 2 |
8 RT |
NA exp( |
E |
)СA СB, |
(2.13) |
|
M AB |
RT |
|||||
|
|
|
|
а также выражение для константы скорости
k = 2 |
8 RT |
NA exp( |
E |
) . |
(2.14) |
|
M AB |
RT |
|||||
|
|
|
|
Сравнивая с уравнением Аррениуса, можно видеть, что предэкспонент А равен общему числу столкновений молекул в единице объема за единицу времени при стандартных условиях, т.е. при единичной концентрации реагентов
Атеор= |
Z |
2 |
8 RT |
NA. |
|
|
|
= |
|
|
(2.15) |
||
|
|
M AB |
||||
|
NA |
|
|
|
||
Для объяснения отклонений экспериментальных значений предэкспонента от рассчитанных по формуле (2.15) вводят стерический множитель (р), который должен учитывать роль других факторов, кроме энергетических ограничений, на протекание элементарного акта химической реакции, в частности пространственных эффектов. В этом случае
Аэксп. = р 2 |
|
8 RT |
NA, и |
|
|||||
|
M AB |
|
|||||||
|
|
|
|
|
|
|
|
||
р = Аэксп / ( |
Z |
|
Aэксп. |
|
|||||
|
) = |
|
|
|
. |
(2.17) |
|||
NA |
2 |
NA |
8RT |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
πMAB |
|
||||
|
|
|
|
|
|
|
|||
П р и м е р 2.2.1
Рассчитать теоретическое значение предэкспонента уравнения Аррениуса и константы скорости при 500 К для реакции
Н + С2Н6 = Н2 + С2Н5,
если принять, что средний газокинетический диаметр молекул реагентов равен =3,5 Å, а энергия активации составляет 26,8 кДж./моль. Сравнить теоретическое значение предэкспонента с его экспериментальной величиной А = 2,3 109 л/(моль с) и вычислить значение стерического множителя. Вычислить также число двойных столкновений молекулы этана с атомами
Студенческий портал МИТХТ http://www.mitht.org

Студенческий портал МИТХТ http://www.mitht.org
водорода за 1 секунду и общее число столкновений молекул реагентов за 1 секунду в 1 л при парциальных давлениях реагента Р = 1 атм.
Решение Определяем приведенную молярную массу реагентов
Mприв.= 1 30/(1+ 30) = 0,968 г/моль = 0,968 10-3 кг/моль и их среднюю относительную скорость по формуле (2.6)
u= 8 8,314 кДж/(моль.К) 500 К/(3,14 0,968 10-3 кг/моль) =3307 м/с,
Вычисляем значение предэкспонента по формуле (2.15) и константы скорости по уравнению (2.14)
А= 3,14 (3,5 10-10)2 м2 3307 м/с 6,02 1026 кмоль-1 = = 7,66 1011 м3/(кмоль с) = 7,66 1011 л/(моль с).
kтеор=7,66 1011л/(моль с) exp(-26800Дж/моль/[8,314Дж/(моль К) 500 К] = = 1,21.109 л/(моль с).
Рассчитаем значение стерического множителя по формуле (2.17)
р = 2,29 109/7,66 1011 = 3,0 10-3 1
Величина стерического множителя позволяет отнести реакцию к типу “медленных”.
Число столкновений одной молекулы рассчитаем по формуле (2.8) z (АВ)= АB2 uАB СB NA = АB2 uАB Р/(RT) NA =
=3,14 (3,5 10-10)2 м2 3307м/с 1,013 105 Па/[(8,314 Дж/(моль К) 500К] 6,02 1023 моль-1 = 1,86 1010 с-1,
и общее число столкновений в 1 л
Z(АB) = z (АB) CB = z (АB) Р /(RT) NA =
=1,86 1010 1атм/[0,082л атм/(моль К) 500 К] 6,02 1023моль-1 =
=2,7 1032 л-1 с-1 = 2,7 1035 м-3с-1.
2.3. Теория активированного комплекса
По теории активированного комплекса для протекания элементарного акта химической реакции реагирующая система должна достичь критической конфигурации атомов, называемой активированным комплексом, который соответствует вершине потенциального барьера на оптимальном пути реакции, характеризующемся минимальной высотой этого барьера на поверхности потенциальной энергии (ППЭ) реакции. Отсюда скорость реакции будет определяться концентрацией активированного комплекса (С ) и частотой его превращения в продукт. Это справедливо для адиабатических
Студенческий портал МИТХТ http://www.mitht.org

Студенческий портал МИТХТ http://www.mitht.org
реакций, элементарные акты которых протекают в пределах одного электронного терма реагирующей системы (одной ППЭ),
r = С
Концентрация активированного комплекса может быть найдена в предположении, что активированный комплекс находится в равновесии с реагентами, а частота превращения комплекса в продукты равна универсальному частотному множителю
kT
= h , где k - постоянная Больцмана, а h - постоянная Планка.
Для реакции А + В 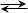 [ AB ] D концентрация активированного комплекса будет равна
[ AB ] D концентрация активированного комплекса будет равна
[AB ] = Кс ·[A]·[B]·(Сº)-1,
где Кс - безразмерная константа равновесия между активированным комплексом и реагентами, а множитель (Сº)-1 введен для согласования размерности константы скорости. Отсюда скорость реакции можно записать так:
|
r = |
k T |
Кс [A][B], |
(2.18) |
|
|
|||
|
|
h |
|
|
а константу скорости |
k = k T Кс ·(Сº)-1. |
(2.19) |
||
|
|
h |
|
|
Используя термодинамический подход к описанию равновесия, можно |
||||
выразить константу равновесия через термодинамические функции |
|
|||
|
−RT ln Кр = Go = H o − T So , |
(2.20) |
||
где Go , Ho и So - стандартные значения соответственно знергии Гиббса, энтальпии и энтропии процесса образования активированного комплекса из реагентов. Для реакций в растворах Кс = Кр . Для газовых реакций за стандарт принимается давление компонентов, равное 1 атм. При изменении стандарта константу скорости в единицах концентрации следует пересчитать по формуле
k [1/(атмn-1·время)] = k [(л/моль)n-1/время]·(RT/Po)1-n,
(2.21)
где R = 0,082 л·атм/(моль·К)
При использовании уравнений (2.19) − (2.21) получим выражение для константы скорости:
k[1/(атм |
n-1 |
·время)] = |
k T |
exp(− |
H |
) exp( |
Spo |
) . |
(2.22) |
|
|
h |
|
RT |
|
||||||
|
R |
|||||||||
|
|
|
|
|
|
|
||||
Величина Ho примерно соответствует энергии активации Аррениуса, более точно
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
Ho = Е − nRT, |
(2.23) |
где n равно числу молекул, образующих активированный комплекс, для реакции газов и n = 1 для реакций в растворах. В таком случае предэкспонент уравнения Аррениуса можно представить в виде
|
n-1 |
|
|
|
kT |
n |
|
|
Sp |
o |
|
|||
А[1/(атм |
|
|
·время)] |
= |
h |
e |
exp( |
|
|
|
|
) . |
(2.24) |
|
|
|
|
R |
|
|
|||||||||
А[(л/моль) |
n-1 |
/время] |
= |
kT |
e exp( |
|
Sc o |
|
||||||
|
|
h |
|
|
|
) . |
(2.25) |
|||||||
|
|
|
R |
|
||||||||||
Из уравнений (2.23) − (2.25) могут быть определены активационные параметры реакции H o и S o:
Spo = R{lnА[1/(атмn-1·время)]·h/( k T) − n} |
(2.26) |
Sco = R{ln(А[(л/моль)n-1/время]·h/ k T) − 1} (Сº=1моль/л) или |
(2.27) |
Sco = R{ln(А[(см3/моль)n-1/время]·h/ k T) − 1} (Сº = 1см3/л) |
|
Отметим, что правая часть уравнений 2.24 и 2.25 определяется частотным множителем (с-1), что совпадает с размерностью предэкспонента для реакций первого порядка, для реакций других порядков численное значение А зависит от выбора стандартного состояния. Для реакций первого порядка и реакций в растворах
Spo = Sco
П р и м е р 2.3.1.
Рассчитать H o, S o и G o реакции, рассмотренной в предыдущем
примере, для разных стандартных состояний 1) Со = 1 моль/л = 1 кмоль/м3; 2) Со = 1 моль/см3; 3) Ро = 1 атм.
Решение
H o = Е - nRT = 26800 Дж/моль − 2·8,314 Дж/(моль.К) ·500 К = = (26800 - 8314) Дж/моль = 18,5 кДж/моль.
При расчете So по уравнениям 2.26 и 2.27 следует отнести величину предэкспонента к стандартному значению концентрации, чтобы под знаком логарифма была безразмерная величина, т.е. определить приведенное значение предэкспонента, имеющее размерность с-1, так как такова же размерность множителя kT/h.
Sco =8,314{ln(2,3·109(л/моль)/с ·6,63·10-34Дж/К/(1,38·10-23Дж/К·500К) −1}= =8,314(-8,42 – 1) = -78,3 Дж/(моль·К) при Сo= 1 М,
2)А = 2,3·109(л/моль)/с = 2,3·1012(см3/(моль.с)
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
Sco =8,314{ln(2,3·1012см3/(моль·с)·6,63·10-34Дж/К/(1,38·10-23Дж/К·500К)−1}= =8,314(-1,51 -1) = -20,9 Дж/(моль·К) при Сo= 1моль/см3.
Следует отметить, что при таком выборе стандарта, величина стерического множителя может быть оценена по простой формуле 2.28
р = ехр( Sco /R). |
(2.28) |
р = ехр(-20,9/8,314) ~ 4.10-2 3)Ар = 2,3·109(л/моль)/с : (0,082л.атм/с· 500К) = 5.6·107(атм.с)-1,
Sрo =8,314{ln(5,6·107(атм.с)-1·6,63·10-34Дж/К/(1,38·10-23Дж/К·500К) −2}= = 8,314(−12,13−2) = −117,5 Дж/(моль·К) при Рo= 1 атм.
G o = H o- Т· S o = 18,5·103 Дж/моль + 500 ·117,5 Дж/моль = 77 кДж/моль
Студенческий портал МИТХТ http://www.mitht.org
