
kinetics_collok1_theory
.pdf1
Лекция 1. Введение. Предмет исследования.
В качестве основных разделов современного курса физической химии для студентовхимиков чаще всего принято выделять строение вещества, включая квантовую химию и электронную теорию химической связи - теорию валентности, химическую термодинамику и химическую кинетику.
Строение вещества изучает физические принципы организации и превращений материи на уровне химических явлений. Общие законы взаимодействия микрочастиц изучает квантовая механика, а её раздел, изучающий свойства электронно-ядерных систем - атомов и молекул, называется квантовой химией. Помимо чистой теории взаимодействия частиц в неё вошла непрерывно расширяющаяся интернациональная библиотека современных алгоритмов и компьютерных программ расчёта электронного строения молекул - прежде всего на основе теории МО ЛКАО. В этом качестве она стала настолько неотделима от современной информатики и вычислительной техники, что получила название компьютерной химии.
Немыслимые ещё совсем недавно возможности, предоставляемые современными электронными средствами коммуникации, в первую очередь сетью ИНТЕРНЕТ, породили иллюзию общедоступности электронно-вычислительной “виртуальной химии” (якобы для любого пользователя). Однако как только такой исследователь получает в руки огромные массивы численных результатов квантово-химического расчёта электронно-ядерной структуры молекулы, он нередко чувствует себя весьма неуютно. Выясняется, что настоящие проблемы лишь начинаются. Для корректной научной интерпретации полученной теоретической информации далее требуется разносторонняя подготовка, сочетающая строгие количественные методы теоретической физики с преимущественно качественными, специфическими образами химии.
Химическая термодинамика изучает общие условия установления термодинамического равновесия в системе реагирующих веществ. В феноменологической термодинамике превращения материи рассматриваются на основе формального анализа макроскопических параметров, энергии, энтропии и различных функций состояния, построенных на их основе. В статистической термодинамике макроскопические характеристики и термодинамические функции состояния вещества выводятся непосредственно из свойств микромеханических движений атомно-молекулярных структур. Обе теории неразрывно связаны и взаимно дополняют друг друга.
Химическая кинетика изучает закономерности химических превращений веществ во времени уже непосредственно в процессе перехода реагирующей системы к термодинамическому равновесию, исследуя скорости образования продуктов и исчезновения реагентов в системе, а также механизмы элементарных актов. Изучая химическую реакцию на уровне взаимодействия отдельных частиц, она превращается в химическую физику.
Вообще же говоря, все эти деления и границы наук весьма условны...
Основы формальной кинетики. Понятия и определения.
1)Вещества - участники реакции подразделяют на реагенты и продукты.
2)В любой момент времени они строго связаны материальным балансом.
3)Цель кинетического описания химической реакции состоит в количественном прогнозе концентраций всех реагентов и продуктов в любой момент времени от начала превращения до установления равновесия в системе. Основа материального баланса -
стехиометрическое уравнение.
4)Ему строго подчиняются все приращения количеств реагентов и продуктов, и на его основе определяется материальный баланс веществ на любой глубине превращения.
Количества веществ принято измерять в молях (ni). При необходимости через них выражают иные массовые характеристики системы.
aA + bB +... = pP + qQ +...; |
(no |
; no |
; no |
; no |
) |
Время |
(n |
|
;n |
|
;n |
|
;n ). |
→ |
A |
B |
P |
||||||||||
|
A |
B |
P |
Q |
|
|
|
|
|
Q |
http://www.mitht.org

2
2) Материальный баланс реагентов и продуктов на любой глубине превращения учитывается в виде термодинамической координаты реакции (синонимы: степень завершённости, глубина превращения - по IUPAC):
ξ = nA −n0A |
= nB −nB0 |
= nP −nP0 |
= |
nQ −nQ0 |
= ni −ni0 |
; νi (−a, −b,... p, q,...) (1.1) |
|
q |
|||||||
−a |
−b |
p |
|
νi |
|
3) Через координату реакции ζ вводятся понятия скорости реакции v или r (от англ. rate). Принято различать:
-скорость реакции в реакционной системе v,
-скорость реакции, отнесённую к единице объёма реакционной системы r. Отсюда вытекают некоторые важные определения.
4)Скорость химической реакции в исследуемой системе это первая производная координаты реакции по времени
v = dξ |
= − |
1 dnA = − |
1 dnB |
= |
1 dnE |
= |
1 |
dnF |
= |
1 |
|
dni |
. |
(1.2) |
|
|
|
||||||||||||
dt |
|
a dt |
b dt |
|
e dt |
|
f dt |
|
νi dt |
|
||||
5) При изменении объёма реакционной системы эта формула обретает вид:
|
1 |
|
d(Vc |
) |
|
1 |
dc |
|
|
|
dV |
|
||
v = |
|
|
i |
|
= |
|
V |
|
i |
+ c |
i |
|
. |
(1.3) |
νi |
|
dt |
|
|
|
dt |
||||||||
|
|
|
|
νi |
dt |
|
|
|
||||||
6) Скорость химической реакции, отнесённая к единице объёма, - переменная уже более универсальная. Обычно её и называют скоростью реакции:
r = |
1 dξ |
= − |
1 |
dnA = − |
1 |
dnB |
= |
1 |
dnE |
= |
1 |
dnF |
= |
1 |
|
dni |
. |
(1.4) |
|
|
|
|
|
|
|
|
|
||||||||||||
V dt |
aV |
|
eV |
fV |
ν V |
|
|||||||||||||
|
|
dt |
bV dt |
|
dt |
|
dt |
|
|
dt |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
7) Скорость реакции, отнесённую к единице объёма, можно представить также в виде:
r = |
v |
|
1 |
|
d(Vc |
) |
|
1 dc |
|
+ c |
|
d lnV |
||||
|
= |
|
|
i |
|
= |
|
|
|
|
i |
i |
dt |
. |
||
V |
ν V |
dt |
|
ν |
|
|
||||||||||
|
|
|
|
|
i |
|
dt |
|
|
|||||||
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
8) Скорость реакции, протекающей в статическом реакторе (V = const через мольные концентрации (ci), и формула (1.3) принимает вид:
r = − |
1 dcA = − |
1 dcB |
= |
1 dcE |
= |
1 |
dcF |
= |
1 |
|
dci |
. |
|
a dt |
b dt |
|
e dt |
|
f |
dt |
|
νi |
|
dt |
|
(1.5)
), удобно выразить
(1.6)
9) Типичные концентрационные функции исчерпания продукта и накопления реагента (кинетические
кривые) имеют вид монотонно изменяющихся зависимостей, которые асимптотически приближаются к некоторому определённому пределу. Содержание каждого реагента в системе уменьшается, и содержание каждого продукта увеличивается. В статическом реакторе это выражается в том, что с те - чением времени концентрации реагентов увеличиваются, а концентрации продуктов уменьшаются. Графики кривых расходования и накопления приводятся на рис.1.
10) При протекании некоторых сложных реакций концентрации отдельных веществ-участников реакции могут изменяться и более сложным образом, в том числе и с признаками периодических изменений системы во времени, например, так, как показано на рисунке справа. Кинетика таких процессов является результатом наложения нескольких простых стадий...(рис.2)
|
|
CA,B |
|
CE,F |
|
|
|
|
|||
|
|
Кривая |
|
|
|
|
|
расходования |
|
Кривая |
|
|
|
реагента |
|
накопления |
|
|
|
|
|
|
продукта |
|
|
|
|
|
|
0 |
t 0 |
|
t |
||
http://www.mitht.org
3
Рис. 1
Рис. 2
Гипотеза и определения (по Вант-Гоффу) :
11)Простейшие химические превращения (элементарные стадии любого сложной реакции) могут быть лишь мономолекулярными, бимолекулярными и тримолекулярными реакциями.
Очевидная причина этих ограничений состоит в том, что для протекания химической реакции необходимо пространственное сближение реагирующих молекул в пространстве. Наиболее велика вероятность сближения двух частиц в пространстве. Одновременное сближение сразу трёх частиц уже намного менее вероятно, а одновременной встречи большего числа частиц уже столь незначительна, что не имеет никакого значения для протекания стадий химического превращения.
Для протекания элементарного акта химического превращения необходимо, чтобы система взаимодействующих частиц преодолела некоторое промежуточное активированное состояние. В этом нестабильном состоянии энергия увеличена по сравнению и с исходным, и с конечным состояниями реагирующих частиц. Стадия активации играет центральную роль во всём превращении.
Очень часто молекулы и активируются, и превращаются в продукты настолько быстро, что весь процесс протекает предельно компактно - практически за время соударения частиц. В этом случае число актов превращения за определённый интервал времени пропорционально числу столкновений между молекулами. Так возникают би- и тримолекулярные реакции, и это соответственно ведёт к реакциям второго и третьего порядка. Число столкновений определяется произведением чисел сталкивающихся частиц.
Нередко бывает и так, что основная стадия превращения в продукт либо сравнительно немного, либо значительно запаздывает за предшествующей стадией активации, происходящей во время соударения.
12)Основной закон химической кинетики - закон действующих масс - закон Гульдберга-Вааге:
Скорость всякой простой реакции описывается уравнением степенного вида:
r = k cAn cBm , или r = k [A]n [B]m . |
(1.7) |
Для реакций, протекающих в газовой фазе концентрации веществ – участников реакции удобно заменить пропорциональными им парциальными давлениями:
r = k pAn pBm . |
(1.8) |
Важно! Продукты каждой элементарной стадии не являются её «действующими массами».
12.1) Простая реакция и её кинетические параметры, как-то: -порядок реакции (показатель степени при концентрации), и
порядки по отдельным реагентам: n,m, порядок суммарный: N=n+m.
-константа скорости k , представляющая собою удельную скорость. Она равна скорости при единичных концентрациях реагентов.
12.2) Возможные порядки простых (элементарных) реакций и их молекулярности: по Вант-Гоффу бывают: - n = 0, 1, 2, 3 ,
12.3) Сложные реакции являются наложением простых стадий. Следует различать:
-суммарный процесс и составляющие его
-элементарные реакции.
Суммарные порядки сложных реакций могут быть:
-целыми, -кратными половине, т.е. 1/2, 3/2, ...
-дробными, даже отрицательными,... и вообще -произвольными.
Наблюдаемые произвольные порядки сложных реакций всё же обычно не более 3-4.
http://www.mitht.org
4
Последний порядок численно уже «запредельный» и является прямым свидетельством сложного механизма реакции, включающего последовательные стадии.
Кинетические кривые участников сложной реакции могут внешне быть похожи на аналогичные зависимости в простых реакциях, но могут иметь и значительно более сложную форму, в том числе, иметь признаки периодичности (рис.2).
Периодические химические процессы во времена Вант-Гоффа и Аррениуса не были известны, и первой реакцией такого типа стала открытая лишь в самом начале 1950-х годов реакция Белоусова.
13) Кинетическое уравнение (при постоянном объёме реагирующей системы)
Для химической реакции вида aA + bB +... = mM + nN +... составляется дифференциальное уравнение, называемое кинетическим уравнением. В качестве переменной можно использовать концентрацию любого из реагентов или продуктов. Все они связаны условием материального баланса, и потому получаем:
r = |
1 dξ |
= − |
1 |
dcA |
= − |
1 |
dcB |
=... = |
1 |
|
dcM |
= |
1 |
dcN |
=... = k cAn cBm cCl . |
(1.9) |
||
|
|
|
|
|
|
|
|
|||||||||||
|
aV dt |
|
a dt |
|
b dt |
|
m dt |
|
n dt |
|
|
|||||||
Отсюда выбираются наиболее удобные переменные. Так скорость всегда можно выразить через концентрацию лишь одного из реагентов, или одного из продуктов, а именно:
− |
1 dCA = k CAnCBmCCl |
или |
1 |
dCM = k CAnCBmCCl . |
(1.10) |
|
|||||
|
a dt |
|
m dt |
|
|
Эти выражения записаны здесь на чисто формальном основании закона действующих масс. Оба выражения не являются линейно независимыми и связаны между собой уравнениями материального баланса (см. уравнение для числа пробегов реакции). На основе материального баланса все концентрации заменяются единой переменной, и это даёт возможность разделить переменные в кинетическом уравнении. Результатом его интегрирования являются зависимости концентраций всех участников от времени. Выбор конкретной переменной для разделения переменных и интегрирования уравнения зависит лишь от соображений удобства и в первую
очередь от имеющихся в распоряжении исследователя экспериментальных данных.
Основные задачи химической кинетики (см. Эмануэль и Кнорре, стр. 179-180)
А) Прямая задача:
-Известна схема реакции, и известны параметры всех её элементарных стадий ks , k−s .
-Требуется найти концентрации компонентов как функции времени.
Б) Обратная задача:
- Имеются экспериментальные кинетические зависимости в виде: а) зависимостей концентраций веществ (Ci) от времени или
б) зависимостей скоростей (ri) от концентраций компонентов реакции.
-Требуется выяснить механизм реакции, т.е. установить совокупность элементарных стадий и подобрать оптимальную систему кинетических уравнений для описания опытных данных, а
именно: порядки и константы скоростей элементарных стадий ks ,k−s .
Кинетические уравнения простых реакций.
Рассмотрим следующие случаи :
-реакции 0-го; 1-го; 2-го; 3-го порядков:
-с различными начальными концентрациями различных реагентов,
-с равными начальными концентрациями различных реагентов;
-для реакции 3-го порядка ограничимся равными начальными концентрациями реагентов;
-превращение единственного реагента при произвольном порядке реакции.
1) Односторонняя реакция 0-го порядка:
|
|
1 dCA = k |
C |
|
aA + bB = eE + fF. − |
∫AdCA = −∫t kdt CA = CA0 − kt . (1.11) |
|||
|
|
a dt |
C A0 |
0 |
|
|
|||
2) Односторонняя реакция 1-го порядка:
http://www.mitht.org
5
A = eE + fF. |
− dCA = k CA − dCA = k dt ∫A dCA = −k∫t |
dt |
|
|||||
|
|
|
|
|
C |
|
|
|
|
|
|
dt |
CA |
C A0 CA |
0 |
|
|
|
|
|
|
|
||||
C 0 |
|
|
|
0 |
|
|
|
|
∫Ad lnCA = k∫t |
dt |
ln CA = kt lnCA = lnCA0 |
− kt CA = CA0 |
e−kt . (1.12) |
||||
C A |
0 |
|
|
CA |
|
|
|
|
Лекция 2. Простейшие кинетические уравнения. Кинетические кривые.
3) Односторонняя реакция 2-го порядка и её стехиметрическое уравнение:
A + B = E + F Представим текущий материальный баланс для этой реакции в виде таблице:
|
|
|
|
|
|
|
Реагенты и продукты |
A |
B |
= |
E |
F |
|
Концентрации веществ |
Вначале |
|
|
|
|
|
a |
B |
|
0 |
0 |
||
в ходе реакции |
Во времени |
a-x(t) |
b-x(t) |
|
x(t) |
x(t) |
3.1) Если текущие концентрации реагентов различны, то удобно ввести лишь одну переменную x:
CA = a − x |
CB = b − x |
|
|
|
||||
− dCA = k CACB |
|
dx |
= k (a − x)(b − x) |
dx |
= kdt. |
(2.1) |
||
dt |
(a − x)(b − x) |
|||||||
dt |
|
|
|
|
|
|||
http://www.mitht.org

5
Если кинетика реакции исследуется от начального момента времени t=0, и в исходной смеси отсутствовал конечный продукт: x=0, то искомая функция концентрации продукта от времени выражается в виде:
∫x dx = kt;
0 (a − x)(b − x)
|
1 |
|
|
= |
A |
+ |
B |
|
|
= |
A(b − x)+ B(a − x) |
|
|
(a − x)(b − x) |
(a − x) |
(b − x) |
(a − x)(b − x) |
||||||||
известная |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
Ab + Ba =1; |
|
|
A =1 b − a |
|||||
|
|
|
|
|
|
|||||||
|
A + B = 0. |
|
B = −A |
|||||||||
подстановка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Результат
|
1 |
|
|
|
1 |
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
− |
|
|
; |
|
|
|
|
|
(a − x)(b − x) |
|
|
(a − x) |
|
|
|
||||||||||
|
|
|
(b −a) |
|
|
(b − x) |
|
|
||||||||||
|
|
dx |
|
|
|
|
|
dx |
|
|
|
|
dx |
|
|
|
||
x |
|
= |
(b −a) x |
|
|
−x |
|
= kt; |
|
|||||||||
∫ |
|
|
|
|
|
|
|
|
|
|||||||||
0 |
(a − x)(b − x) |
|
|
0 |
(a − x) |
0 |
(b − x) |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
b − x a |
= kt. |
(2.2) |
|||
|
|
ln |
|
|
|||
(b −a) |
|||||||
a − x b |
|
|
|||||
Полученную зависимость x(t) удобно оставить в виде неявной функции, которая хорошо приспособлена для обработки экспериментальных данных:
b − x |
b |
+ (b − a)kt ; |
||
ln |
|
= ln |
|
|
a − x |
a |
|
||
Используя обозначения y = ln |
b − x |
; α = ln b |
; β = (b − a)k , |
|
a − x |
||||
|
a |
|
||
линейный вид |
y = α + βt . |
|
||
(2.3)
придаём уравнению (2.3)
(2.4)
3.2) Односторонняя реакция 2-го порядка:
- если начальные концентрации с обоих реагентов равны a, то до самого окончания реакции равными останутся и их текущие концентрации a- x (у продуктов x), и получаем:
A + |
B |
M + N; |
− d(a − x) |
= k(a − x)2 ; |
− dx |
= kx2 ; |
или − dc = kc2 |
; |
||||||||||
a - x a − x |
x x |
dt |
|
|
|
|
|
|
|
dt |
|
|
dt |
|
|
|||
|
|
a− |
x |
t |
|
|
|
1 |
|
1 |
= kt или x(t)= a − |
a |
|
(2.5) |
||||
c−2dc = −kdt; ∫c−2dc = −k∫dt; |
|
|
− |
; |
||||||||||||||
a − x |
a |
1+ akt |
||||||||||||||||
|
|
a |
0 |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
1 |
= kt + |
1 |
. |
|
|
|
|
|
|
|
|
|||
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
c0 |
|
|
|
|
|
|
|
|
|||
Аналогичное выражение имеет место и для одного реагента, превращающегося по реакции второго порядка, но в этом случае скорость исчезновения реагента возрастает вдвое:
2A M + N |
− |
1 dc |
= kc2 ; |
|
1 |
= 2kt + |
1 |
. |
(2.6) |
2 dt |
c |
|
|||||||
a - x x x |
|
|
|
|
c0 |
|
|||
Идеальный лабораторный пример, прямо-таки стандарт, химического превращения 2-го порядка представляет собою щелочное омыление сложных эфиров, и не случайно эту превосходно воспроизводимую реакцию с очень доступными, недорогими реагентами находим в ассортименте обязательного лабораторного студенческого практикума в любом химическом вузе мира...
RCOOR'+KOH → RCOOK + R'OH; |
R, R' (− CH3 ; − C2 H5 ; ... − Cn H2n+1 ). |
||
4) Односторонняя реакция 3-го порядка и её возможные кинетические варианты: |
|||
4.1) |
– начальные концентрации все различны: |
||
A + B + C M + N; |
dx = k(a − x)(b − x)(c − x) |
||
a - x b − x c − x |
x x |
dt |
|
4.2) |
– начальные концентрации равны у двух реагентов: |
||
A + B + C M + N; |
dx = k(a − x)2 (b − x) |
||
a - x b − x a − x |
x x |
dt |
|
4.3) |
– все начальные концентрации равны: |
||
http://www.mitht.org

|
A + B + C M + N; |
|
|
|
|
6 |
|
|
|
|
|
dx |
3 |
= k∫dt; |
||||||||
|
dx = k(a − x)3 ; ∫ |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
dt |
|
|
0 |
|
|
|
|
|
||||||
a - x a − x a − x |
x x |
|
|
|
|
|
|
(a − x) |
0 |
|||||||||||||
|
|
|
∫x (a − x)−3 dx = kt; |
|
|
|
1 |
|
|
= |
|
1 |
+ 2kt. |
|||||||||
|
|
|
|
|
|
|
2 |
|
2 |
|||||||||||||
|
|
|
0 |
|
|
|
|
|
|
|
|
(a − x) |
|
a |
|
|
|
|||||
5) Односторонняя реакция произвольного n-го порядка при (с0=a): |
||||||||||||||||||||||
|
|
A M + N; |
|
|
dx = k(a − x)n ; |
|
∫ |
dx |
n = k∫dt; |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
|
|
|
|
|
t |
|||
|
|
|
|
|
|
dt |
|
|
|
|
|
0 |
|
|
|
|||||||
|
|
a - x |
x x |
|
|
|
|
|
|
|
|
(a − x) |
0 |
|||||||||
|
∫x (a − x)−n dx = kt; |
(a − x)1−n |
|
x = kt; (a − x)1−n = a1−n +(n −1)kt. |
||||||||||||||||||
|
|
|||||||||||||||||||||
0 |
|
|
|
|
n −1 |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2.7)
(2.8)
т.е. |
c1−n = c01−n + (n −1)kt . |
(2.9) |
Последнее уравнение (2.8) справедливо для любой реакции, но с некоторыми обязательными оговорками. Так в случае реакции 1-го порядка возникает неопределённость, устраняемая с помощью правила Лопиталя. Для этого порядок реакции n считаем дифференцируемым параметром, представим формулу
(2.9) дробью (c1−n − c01−n )/(n −1)= kt и получим обычное выражение... : |
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
1−n |
1−n |
|
|
|
d |
|
(c1−n −c1−n ) |
|
d |
|
(c1−n −c1−n ) |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
dn |
|
|
|
|
||||||||||
lim c |
|
|
−c0 |
= kt; lim |
dn |
0 |
|
= kt; lim |
|
|
|
0 |
|
= kt; |
|||||||||||
|
n→1 |
|
|
n −1 |
|
|
n→1 |
|
d |
n→1 |
|
d |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
(n −1) |
|
|
|
(n − |
1) |
|
|
|
(2.10) |
|||
|
d |
|
(c1−n −c1−n ) |
|
|
dn |
|
|
dn |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
dn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
lim |
|
|
|
0 |
|
d(1− n) |
= kt; |
lim[(ln c0 )c01−n −(ln c)c1−n |
]= kt; |
ln |
c0 |
= kt. |
|||||||||||||
|
|
|
d |
|
|
|
|
c |
|||||||||||||||||
n→1 |
|
(n −1) |
|
dn |
|
|
|
|
n→1 |
|
|
|
|
|
|
|
|
|
|||||||
|
|
dn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Примечание: Производная степенной функции вычисляется по формуле: dadxx = (lna)a x
6) Период полупревращения. Это время t1/2, в течение которого концентрация вещества изменяется вдвое: c(t1/ 2 )= c0 / 2 . Это один из удобных формально-кинетических крите-риев... .
Для реакции произвольного n-го порядка из формулы (2.9) получаем:
|
c |
|
1−n |
|
|
|
|
|
1− 21−n |
|
|||
c1−n −c01−n |
= k(n −1)t; |
|
0 |
|
−c01−n |
= k(n −1)t1/ 2 |
; t1/ 2 |
= c01−n |
|
|
|
|
. |
2 |
2 |
1−n |
|
||||||||||
|
|
|
|
|
|
|
|
|
k(n −1) |
||||
Используя обозначение B = (1 − 21−n ) |
21−n k(n −1), |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||||
получаем |
t1/ 2 =B c01−n . |
|
|
(2.11) |
|
|
|
|
|
|
|
|
|
Проводят серию экспериментов, изменяя |
|
|
|
|
|
|
|
||||||
начальную концентрацию одного из реагентов. |
|
|
|
|
|
|
|
||||||
Определяют время убыли его концентрации вдвое, |
|
|
|
|
|
|
|
||||||
и обрабатывают данные в спрямляющих перемн- |
|
|
|
|
|
|
|
||||||
ных согласно уравнению ln t1/ 2 |
= lnB + (1 − n)lnc0 . |
(2.12) |
|
|
|
|
|
|
|||||
Отсюда можно найти порядок реакции по данному реагенту.
Методы кинетических измерений
(очень разнообразны! ..см. книги Н.М.Эмануэля):
-химические (Это основа основ! Важен исчерпывающий качественный и количественный анализ системы),
-физико-химические, включая:
- спектроскопические: ИКС, оптическая электронная |
Рис. 3. ... у реакции 1-го |
спектроскопия (УФ, видимая), ЯМР, ЭПР и др., |
порядка t1/2 не зависит от |
- электрохимические: -полярография, кондуктометрия, |
|
потенциометрия (ионометрия, pH-метрия,...), |
исходного содержания |
- дилатометрия – кинетика изменения объёма |
реагента в системе. |
(особенно в кинетике полимеризации!), |
|
|
|
- манометрия – кинетика изменения давления (в газах), |
|
- рефрактометрия –измерение показателя преломления, |
|
http://www.mitht.org |
|
7
- поляриметрия - кинетика изменения угла вращения плоско-поляризованого светового луча во время превращений оптически-активных (хиральных) соединений),
-калориметрия - кинетика температурных изменений - в рапидных процессах...,
-а также любые методы, в которых измеряемое свойство непосредственно и однозначно связано с
материальным балансом в реагрирующей системе...
Успех кинетического эксперимента полностью определяется научным уровнем исследовательской лаборатории: тщательностью химической подготовки, качеством физико-химического и приборного оформления, достоверностью и корректностью измерений... Уже созданы огромные современные химические производства (в США и Германии - заводы DUPON и BASF), проектирвание которых целиком построено на основе компью-терного моделирвания всех без исключения физико-химических процессов (и кинетических !!! тоже).
Для подобных целей исходные лабораторные данные должны быть безукоризненными.
Оптимизация условий и критерии постановки кинетического эксперимента:
-Подбор диапазона концентраций, удобного для регистрации,
-Понижение порядка по отдельным реагентам. Для этого почти все реагенты вводятся в реакцию в большом избытке по отношению к одному – исследуемому. Его концентрация значительно меняется на фоне почти
неизменных прочих, и возникает возможность измерения кинетики именно по недостаточному реагенту. По нему и
определяется частный порядок реакции...
-Возможность серийных экспериментов и воспроизводимость данных. Эти критерии в большой степени экономические. Стоимость пионерских измерений обычно значительна.
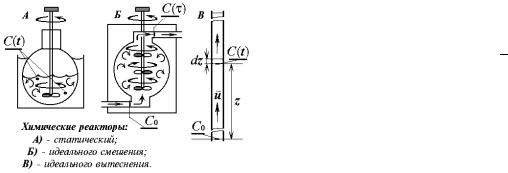
Химические реакторы. Кинетика и диффузия.
Устройства, предназначенные для кинетических измерений, называют химическими реакторами.
Реактором может служить любой сосуд или его фрагмент, в том числе и такой, которому приданы какие-либо специальные геометрические формы. Различают реакторы статические и проточные. В свою оч ередь идеальные проточные бывают идеального смешения и идеального вытеснения. Концентрации веществ в реакторе во времени могут изменяться за счёт: а) химического превращения, б) массопереноса.
Химическая реакция это переход системы в термодинамически - равновесное состояние за счёт перестройки молекулярно-атомной структуры её компонентов. Неравновесное распределение концентраций в реакционном пространстве является причиной массопереноса, и возникает диффузия. В гомогенной среде с однородным распределеним концентраций в статическом реакторе градиент концентраций отсутствует, и диффузии нет, но в проточных реакторах необходимо специально
предусмотреть условия для количественного разделения концентрационных изменений чисто кинетической и диффузионной природы. Примеры химических реакторов показаны на рисунке. Эффективное (а в статическом реакторе полное) устранение градиента концентрации достигается искусственно механическим перемешиванием реакционной среды.
|
|
|
Выражения скорости химической |
|
||||||||||||||||||||
|
|
|
реакции в различных реакторах: |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
dc |
|
|
|
r |
|
∆c |
|
||||||
|
|
А) |
|
|
|
|
|
r = |
|
|
|
= |
; |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
∆t |
|
||
|
|
Б) |
t = |
z |
|
; |
r = |
|
dc |
|
|
= u |
|
dc |
(z) |
|
|
; |
||||||
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
u |
|
dt |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dz |
|
|
|
|||||
|
|
|
|
V |
|
|
|
|
|
|
|
∆c |
|
|
|
c0 − c |
|
|
|
|||||
|
|
В) |
τ = |
|
; |
r = |
|
|
= |
|
|
. |
||||||||||||
Рис. 4. Химические реакторы. |
|
w |
|
τ |
|
|
|
|
τ |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t -время; c0 –стартовая (начальная) концентрация... и c(t) –текущая концентрация реагента; z- линейное смещение фронта гидродинамического потока (расстояние от стартового сечения);
u- модуль линейной скорости потока в реакторе идеального вытеснения; w- объёмная скорость потока
в реакторе идеального смешения ; V- объём реактора идеального смешения; τ- время контакта в реакторе идеального смешения; r - скорость химической реакции;
Способы математической обработки кинетических данных различают графические и численные статистические (компьютерные).
Методы определения порядков и констант скоростей химических реакций :
(см. учебник Краснова, стр. 540-541; кафедральный практикум МИТХТ; семнарские занятия)
-графический и статистический подбор оптимальных спрямляющих координат;. -прямая подстановка в кинетические уравнения и оптимизация постонных (k, n); -установление взаимосвязи времени полупревращения и начального содержания; -метод начальных скоростей; -метод графического дифференцирования (ограниченно и лишь для простых реакций);
-понижение порядка реакции (одно из условий оптимального эксперимента см. выше).
http://www.mitht.org
8
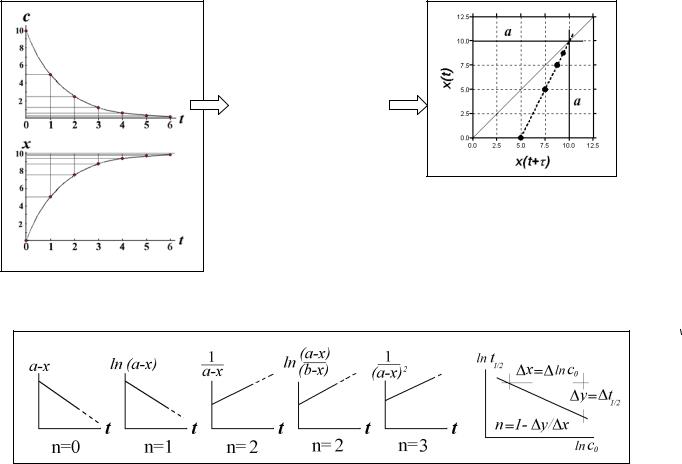
Некоторые полезные сведения о кинетических признаках реакций первого порядка:
1)Время полупревращения не зависит от начального содержания реагента (парциального давления или концентрации) (см. рис. на предыдущей странице).
2)Ещё одно свойство не столь явное, но очень полезное выясняется после некоторых
преобразований (рис.). Текущая концентрация реагента равна c=c0 e-kt, а накопившегося |
||||||||||||||||
продукта |
|
|
x(t)= c0 - c(t)= c0(1- e-kt). |
|
(2.13) |
|
||||||||||
По окончании реакции получаем τ = ∞; |
x(∞)= x∞ = c0 (1 − e−k∞ )= c0 ; |
x∞ = c0 |
||||||||||||||
Преобразуем (2.13) к виду |
|
e-kt =1- [x(t)/ c0]. |
|
|
|
(2.14) |
||||||||||
Через интервал времени τ временная переменная равна уже t+τ, и получается |
|
|||||||||||||||
|
|
|
|
|
e-k(t+τ) =1- [x(t+τ)/ c0] |
|
|
|
(2.15) |
|||||||
или e-k τ e-k t =1- [x(t+τ)/ c0]. Разделив почленно (2.14) на (2.15), получаем выражения |
||||||||||||||||
|
|
|
c − x(t) |
|
|
|
|
|
|
|
|
e |
kτ |
|
||
e |
kτ |
|
x(t) = c0 |
(1−e |
kτ |
)+e |
kτ |
x(t +τ); |
|
|
= A |
|||||
0 |
; |
|
|
|
|
|
||||||||||
|
= |
|
|
|
c |
(1− A)= B |
|
|||||||||
|
c − x(t +τ) |
|
|
|||||||||||||
|
|
0 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x(t) = B + A x(t +τ); |
|
|
|
(2.16) |
|
|||||
|
|
|
|
|
|
|
|
t →∞; |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
x(∞) = x(∞+τ) = x |
|
|
|
(2.17) |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
∞ |
|
|
|
|
|
Согласно формуле (2.13) значение x∞ = c0, а согласно (2.17) эта величина лежит на биссектрисе угла между осями декартовых координат (если их масштабы равны) на пересечении
с графиком функции (2.16). Так получается один из способов экстраполяционного определения начального содержания реагента. Это особенно важно в тех случаях, когда по каким-то причинам измерить точно эту величину затруднительно. Для этой цели кинетические данные
измеряют или представляют через равные интервалы времени. Вся процедура определения x∞ = c0 = a показана ниже на модельном примере.
t |
x(t) |
x(t+τ) |
0 |
0 |
5 |
1 |
5 |
7.5 |
2 |
7.5 |
8.75 |
3 |
8.75 |
9.375 |
4 |
9.375 |
9.6875 |
5 |
9.6875 |
9.84375 |
6 |
9.84375 |
... |
... |
... |
... |
Рис.5-6. Определение начального содержания реагента
для односторонней реакции первого порядка.
В завершение главы приведём рисунок-сводку (формулы см. в тексте).
Рис.7. Спрямляющие координаты для простых односторонних реакций разных порядков 
http://www.mitht.org

9
Лекция 3. Формальная кинетика сложных реакций.
Основные принципы:
-независимость скоростей элементарных стадий;
-принцип детального равновесия;
-материальный баланс по отдельным реагентам и продуктам. Рассмотрим их подробнее.
1)Принцип независимости скоростей элементарных реакций в системе.
Если в системе возможны несколько простых реакций, то каждая из них протекает со скоростью, определяемой своим собственным дифференциальным уравнением и своей константой скорости. Если в системе протекает несколько реакций, то общая скорость реакции по каждому реагенту равна алгебраической сумме скоростей отдельных реакций. (Примеры обычные из области сложных реакций)
2)Принцип детального равновесия.
Вравновесной системе скорость прямой реакции каждой стадии механизма равна скорости обратной реакции той же стадии. Этот принцип особо важен, когда реакция протекает по двум или более путям. Из этого принципа вытекает связь констант скоростей с термодинамической константой равновесия. Например:
|
[C]*[D]* |
|
|
|
|
|
A + B C + D; K = |
[A]*[B]* ; |
r = r |
k[A]*[B]* = k[C]*[D]* |
|||
|
|
|
|
|
|
|
|
[C]*[D]* |
= |
k |
= K |
|
(3.1) |
|
[A]*[B]* |
|
||||
|
|
k |
|
|
|
|
3) Состав реагирующей системы и материальный баланс.
Формула координаты реакции выражает материальный баланс реагентов и продуктов согласно стехиометрии превращения. Необходимо также учесть динамику материального баланса во времени в реакторе, включая и изменение концентраций во времени, и гидродинамику потока в проточных реакторах.
При выводе дифференциальных уравнений скоростей реакций необходимо соблюдать материальный баланс по каждому реагенту и продукту и для простых, и в особенности для сложных реакций. Условие материального баланса и для открытых, и для закрытых систем имеет вид:
(приход реагента в систему) -(расход реагента в системе)=(изменение количества реагента в системе)
Для процессов при постоянном объёме это условие можно отнести к единице объёма:
(приход реагента в единице объёма) - (расход реагента в единице объёма) = (изменение концентрации реагента). Поступление реагента определяется скоростью его введения в систему из окружающей среды (для открытых систем) и суммой скоростей его образования в объёме V. Расход реагента определяется скоростью его отвода из системы (в открытых системах) и сумой скоростей его исчезновения в параллельно протекающих
реакциях. Для открытой системы получается: w(ci 0 − ci ) +V ∑νis rs =V |
dci |
, |
|
|
(3.2) |
|
|
|||||||||||||||||
dt |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где |
w -объёмная скорость поступления реагента в реактор, t |
-время, |
rs -скорость одной из химических ре- |
|||||||||||||||||||||
акций, V - объём реактора, νis -стехиометрический коэффициент реагента в реакции (по правилу IUPAC), |
|
ci 0 - |
||||||||||||||||||||||
начальная концентрация реагента в реакторе, ci |
-текущая концентрация реагента в реакторе. |
|
|
|
|
|||||||||||||||||||
Для закрытых систем w=0, и получаем равенство ∑νis rs = |
dci |
|
|
|
|
|
|
|
|
(3.3) |
||||||||||||||
dt . |
|
|
|
|
|
|
|
|||||||||||||||||
Основные виды сложных реакций: |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
1) |
Параллельные односторонние реакции: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
1.1) Две реакции первого порядка (кинетическая схема): |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
→ |
|
|
→ |
|
r = k [A] |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
A |
k1 |
B |
|
|
k1 |
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
A→C |
|
|
→C |
|
r2 |
= k2 [A] |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
k2 |
|
|
|
k2 |
|
|
|
|
|
|
|
|
|
|
|
|
[B] |
|
[C ] |
|
|
|
|
d[B]= r |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
d[B] |
|
d[C] |
|
|
∫d[B] |
|
∫d[C |
] |
||||||
|
dt |
1 |
|
r1 / r2 = k1 / k2 |
= d[B]/ d[C] |
= |
|
0 |
|
= |
0 |
|
|
|||||||||||
|
d[C] |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
k1 |
k2 |
|
k1 |
k2 |
|
|
||||||||||||||||
|
dt |
= r2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
http://www.mitht.org
