
БИЛЕТЫ
.pdfфорумстудентов.рф
1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 000 (ОБРАЗЕЦ) 1. Состояние гетерогенного равновесия
5CO(Г)+I2O5(Т) 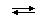 5CO2(Г)+I2(Г)+Q
5CO2(Г)+I2(Г)+Q
установилось при концентрациях 0,2; 10,0; 0,4 и 1,2 моль/л соответственно. Составьте выражение для константы равновесия и рассчитайте ее значение. Повысится ли выход продуктов при нагревании (p=const)?
Изменится ли при этом значение константы равновесия? Дайте мотивированный ответ.
2. Составьте уравнение фазового равновесия в насыщенном растворе фторида магния. Приведите название, значение и выражение (по закону действующих масс) для константы этого равновесия.
Используя справочные данные, укажите, сместится ли фазовое равновесие (и если "да", то в какую сторону) при добавлении: а) фторида калия; б) хлорида магния, в) нитрата калия. Изменится ли масса осадка при этих воздействиях?
Дайте мотивированные ответы.
3. Составьте уравнения реакций в водном растворе:
а) иодид калия + серная кислота + перманганат калия = б) дихромат калия + серная кислота + щавелевая кислота = в) вода + гидроксид натрия (конц) + цинк
Используя справочные данные, сделайте вывод о возможности самопроизвольного протекания этих реакций в стандартных условиях.
4. Составьте уравнения гидролиза гидроортофосфата калия.
Используя справочные данные, укажите, какое значение рН (<7, >7, =7) имеет водный раствор этой соли.
Рассчитайте степень протолиза слабой кислоты HA в 0,01М растворе, рН которого равен 5._____
Как изменится степень протолиза слабой кислоты HA в водном растворе, если: а) добавляют соль NaA,
б) добавляют кислоту HCl,
в) выпаривают из раствора НА воду в вакууме при постоянной температуре?
Дайте обоснованные ответы.__________________________________________________________
5. Составьте электронные формулы и постройте энергетические диаграммы для атомов элементов со следующими координатами в Периодической системе:
а) 3, VА; б) 4, VIIIБ2.
Укажите значения всех квантовых чисел для электрона, последним заселяющего электронную оболочку атома (а) и (б).
Покажите, как изменится электронная формула атома (а) при переходе его в Э−III; атома (б) - при переходе его в Э+III.
6. Почему в ионах [BrF4]+, [BrF4]− и [BrF2]+ валентные углы (между сигма–связями) различны? Дайте обоснованный ответ.

форумстудентов.рф
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова
2
Кафедра неорганической химии Дисциплина «Общая химия» Курс I , семестр 1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ №001
1.5. Состояние гомогенного равновесия 4 NH3 + 3 O2 ↔ 2 N2 + 6 H2O: + Q установилось при концентрациях 0.5; 0.8; 1.0 и 0.3 моль/л соответственно. Составьте выражение для константы равновесия и рассчитайте ее значение. Повысится ли выход продуктов при нагревании (p=const)? Изменится ли при этом значение константы равновесия? Дайте мотивированный ответ.
2.7. Составьте уравнение фазового равновесия в насыщенном растворе хромата свинца(II). Приведите название, значение и выражение (по закону действующих масс) для константы этого равновесия. Используя справочные данные, укажите, сместится ли фазовое равновесие (и если «да», то в какую сторону) при добавлении: а) хромата калия; б) нитрата свинца(II). Изменится ли масса осадка при этих воздействиях? Дайте мотивированные ответы.
3.13. Составьте уравнения реакций в водном растворе:
а) нитрит калия + серная кислота + дихромат калия =
б) оксид свинца(IV) + азотная кислота + пероксид водорода = в) диоксид серы + вода + бром =
Используя справочные данные, сделайте вывод о возможности самопроизвольного протекания этих реакций в стандартных условиях.
4.30. Составьте уравнения гидролиза а) сульфата меди(II); б) сульфита натрия в водном растворе. Используя справочные данные, укажите, какое значение pH (<7,>7, =7) имеют водные растворы этих солей. Рассчитайте молярность раствора хлорида аммония при 25оС, если его pH равен 6.
Предложите три способа уменьшения степени гидролиза а) сульфата меди(II); б) сульфита натрия. Ответ должен быть обоснованным.
5.5. Составьте электронные формулы условных ионов для элементов со следующими координатами в Периодической системе: а) Э+II (4, IБ); б) Э–I (5, VIIA). Определите атомные номера элементов, постройте энергетические диаграммы их атомов. Установите, диаили парамагнитными являются каждый из данных ионов и соответствующий ему нейтральный атом.
6.43. В чем причина различия дипольных моментов молекул BrF5 и PF5? Дайте обоснованный ответ.

форумстудентов.рф
3
1.5. Состояние гомогенного равновесия 4 NH3 + 3 O2 ↔ 2 N2 + 6 H2O: + Q установилось при концентрациях 0.5; 0.8; 1.0 и 0.3 моль/л соответственно. Составьте выражение для константы равновесия и рассчитайте ее значение. Повысится ли выход продуктов при нагревании (p=const)? Изменится ли при этом значение константы равновесия? Дайте мотивированный ответ.
2.10. Составьте уравнение фазового равновесия в насыщенном растворе фторида кальция. Приведите название, значение и выражение (по закону действующих масс) для константы этого равновесия. Используя справочные данные, укажите, сместится ли фазовое равновесие (и если «да», то в какую сторону) при добавлении: а) фторида калия; б) хлорида кальция. Изменится ли масса осадка при этих воздействиях? Дайте мотивированные ответы.
3.19. Составьте уравнения реакций в водном растворе:
а) перманганат калия + серная кислота + нитрит калия = б) пероксид водорода + бромоводород = в) алюминий + гидроксид натрия(конц.) + вода =
Используя справочные данные, сделайте вывод о возможности самопроизвольного протекания этих реакций в стандартных условиях.
Используя справочные данные, сделайте вывод о возможности самопроизвольного протекания этих реакций в стандартных условиях.
4.17. Составьте уравнения диссоциации гидроксида бария и уравнение протолиза гидрата аммиака в водном растворе. Используя справочные данные, укажите, в каком из растворов этих веществ при одинаковых молярности и температуре значение pH будет ниже. Рассчитайте значение рН в 0.1 М растворе сульфата аммония при 25оС.
Как изменится степень диссоциации гидроксида бария при добавлении гидрата аммиака? Как изменится степень протолиза гидрата аммиака при добавлении гидроксида бария?
5.25. Составьте электронные формулы условных ионов для элементов со следующими координатами в Периодической системе: а) Э+III (5, IIIA); б) Э+II (4, IБ). Определите атомные номера элементов, постройте энергетические диаграммы их атомов. Установите, диаили парамагнитными являются каждый из данных нейтральных атомов.
6.36. В чем причина различия дипольных моментов молекул РОF3 и PF5? Дайте обоснованный ответ.

форумстудентов.рф
|
4 |
Министерство образования |
Кафедра неорганической химии |
Российской Федерации |
Дисциплина «Общая химия» |
Московская государственная академия |
Отделение: дневное – ЕНФ |
тонкой химической технологии |
|
им. М.В. Ломоносова |
Курс I , семестр 1 |
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ №
1.17.Состояние равновесия N2О4(ж) ↔ 2 NO2(г) установилось при концентрации каждого вещества, равной 3.5 моль/л. Составьте выражение для константы равновесия и рассчитайте ее значение. Сместится ли равновесие (и если «да», то в какую сторону) а) при введении некоторого количества жидкого реагента; б) при понижении давления (Т=const)? Изменится ли при этом значение константы равновесия? Дайте обоснованный ответ.
2.13.Составьте уравнение фазового равновесия в насыщенном растворе хромата бария. Приведите название, значение и выражение (по закону действующих масс) для константы этого равновесия. Используя справочные данные, укажите, сместится ли фазовое равновесие (и если «да», то в какую сторону) при добавлении: а) хромата калия; б) хлорида бария. Изменится ли масса осадка при этих воздействиях? Дайте мотивированные ответы.
3.10.Составьте уравнение реакции:
нитрит калия |
+ |
серная кислота |
+ |
перманганат калия = |
…… |
(избыток) |
|
(разб.) |
|
(0.05 М, 400 мл) |
|
Используя справочные данные, подтвердите возможность самопроизвольного протекания этой реакции в стандартных условиях. Рассчитайте массу прореагировавшего восстановителя а) по закону эквивалентов, б) по уравнению реакции.
Изменится ли масса прореагировавшего восстановителя, если данную реакцию проводить
внейтральной среде? Дайте обоснованный ответ.
4.34.Составьте уравнения гидролиза а) сульфида калия; б) гидросульфида калия
в водном растворе. Используя справочные данные, укажите, в каком из растворов этих веществ при одинаковых молярности и температуре значение pH будет ниже. Как изменится степень протолиза в растворе (а) при разбавлении? Дайте обоснованный ответ.
5.7.Составьте электронные формулы условных ионов для элементов со следующими координатами в Периодической системе: а) Э+III (5, IIIБ); б) Э–IV (2, IVA). Определите
атомные номера элементов, постройте энергетические диаграммы их атомов. Установите, диаили парамагнитными являются каждый из данных нейтральных атомов.
6.16. Одинакова или различна геометрическая форма ионов РО43– и SO42–? Дайте обоснованный ответ.
Заведующий кафедрой неорганической химии |
А.Ю. Цивадзе |

форумстудентов.рф
|
5 |
Министерство образования |
Кафедра неорганической химии |
Российской Федерации |
Дисциплина «Общая химия» |
Московская государственная академия |
Отделение: дневное – ЕНФ |
тонкой химической технологии |
|
им. М.В. Ломоносова |
Курс I , семестр 1 |
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 24
1.4. Состояние гомогенного равновесия N2 + O2 ↔ 2 NО; + Q установилось при концентрациях 0.5; 0.8 и 0.3 моль/л соответственно. Составьте выражение для константы равновесия и рассчитайте ее значение. Повысится ли выход продукта при охлаждении (p=const)? Изменится ли при этом значение константы равновесия? Дайте мотивированный ответ.
2.18. Кратко опишите способы приготовления а) ненасыщенного; б) насыщенного растворов нитрата свинца(II). Используя справочные данные, схематично изобразите диаграмму растворимости, и на ней покажите два способа перевода раствора (б) в (а). Что произойдет, если из раствора (а) длительное время при постоянной температуре испарять воду? Дайте мотивированный ответ.
3.18. Составьте уравнения реакций в водном растворе:
а) сульфат железа(II)+ серная кислота + дихромат калия = б) иодид калия + вода + хлор (избыток) = в) перманганат калия + гидроксид каия + сульфит калия =
Используя справочные данные, сделайте вывод о возможности самопроизвольного протекания этих реакций в стандартных условиях.
4.18. Составьте уравнения протолиза серной и угольной кислот в водном растворе. Используя справочные данные, укажите, в каком из растворов этих веществ при одинаковых молярности и температуре значение pH будет ниже. Рассчитайте значение pH в 0.1М растворе цианида бария при 25оС.
Что произойдет при смешивании растворов водных растворов серной и угольной кислот? Как при этом изменится степень протолиза каждой из кислот?
5.24. Каков физический смысл различий атомных орбиталей со следующим набором квантовых чисел: а) n=4, l=1, ml=0; б) n=4, l=2, ml=0. Составьте электронную формулу атома элемента с координатами: 5 период, VIIБ группа, и постройте для этого атома энергетическую диаграмму. Укажите на ней атомные орбитали с набором квантовых чисел
(а) и (б).
6.38. В чем причина различия дипольных моментов молекул РF3 и AlF3? Дайте обоснованный ответ.
Утвержден на заседании кафедры «20» сентября 2002 года, протокол №2 Заведующий кафедрой чл.-корр. РАН

форумстудентов.рф
6
1.6. Состояние гетерогенного равновесия 2N2O(г) + C(т) ↔ 2N2(г) + 2CO2(г); +Q установилось при концентрациях 0.2; 10.0; 0.4 и 1.2 моль/л соответственно. Составьте выражение для константы равновесия и рассчитайте ее значение. Повысится ли выход продуктов при нагревании (V=const)? Изменится ли при этом значение константы равновесия? Дайте мотивированный ответ.
2.17. Кратко опишите способы приготовления а) ненасыщенного; б) насыщенного растворов нитрата натрия. Используя справочные данные, схематично изобразите диаграмму растворимости, и на ней покажите два способа перевода раствора (а) в раствор (б). Что произойдет, если из раствора (а) длительное время при постоянной температуре испарять воду? Дайте мотивированный ответ.
3.6.Составьте уравнение реакции:
сероводород |
+ |
перманганат калия |
= …… |
(избыток) |
|
(0.2 М, 200 мл) |
|
Используя справочные данные, подтвердите возможность самопроизвольного протекания этой реакции в стандартных условиях. Рассчитайте объем (при н.у.) прореагировавшего газа: а) по закону эквивалентов; б) по уравнению реакции.
Изменится ли (а если изменится, то как: увеличится, уменьшится) объем (н.у.) прореагировавшего газа в данной реакции, если ее проводить в щелочной среде? Дайте обоснованный ответ.
4.31.Составьте уравнение гидролиза а) хлорида аммония; б) хлорида алюминия в водном растворе. Используя справочные данные, укажите, в каком из растворов этих веществ при одинаковых молярности и температуре значение pH будет ниже. Как изменится степень протолиза в растворе (б) при добавлении хлороводородной кислоты? Дайте обоснованный ответ.
5.26.Каков физический смысл различий атомных орбиталей со следующим набором
квантовых чисел: а) n=5, l=2, ml=2; б) n=5, l=2, ml=–2. Составьте электронную формулу атома элемента с координатами: 5 период, IIБ группа, и постройте для этого атома энергетическую диаграмму. Укажите на ней атомные орбитали с набором квантовых чисел (а) и (б).
6.60.В чем состоит сходство и различие в геометрии и электронном строении частиц
NO3– и C32–?
