
лабораторная АФ-2
.pdf7. Контрольные вопросы
7.1.Сформулируйте постулаты Бора.
7.2.Выведите формулу для радиуса n-ой орбиты и скорости электрона на ней.
7.3.Выведите на основании теории Бора формулу для полной энергии электрона на n-ой орбите. Объясните смысл отрицательного значения энергии электрона в атоме.
7.4.Нарисуйте и объясните диаграмму энергетических уровней атома водорода.
7.5.Какая величина называется постоянной Ридберга?
7.6.Дайте характеристику линейчатых спектров.
7.7.Дайте характеристику молекулярных и сплошных спектров.
7.8.В чем особенность спектров поглощения?
7.9.Какие исследования проводятся в данной работе?
7.10.Каково устройство монохроматора?
7.11.Объясните ход лучей в оптической системе монохроматора.
7.12.Дайте определение угловой и линейной дисперсии монохроматора.
Библиографический список
Савельев И.В. Курс физики. Т.3. Квантовая оптика. Атомная физика. Физика твердого тела. - СПб.:Изда-
тельство "Лань", 2006г. - 320 с.(§§ 21, 22, 29)
22
Лабораторная работа АФ2.
Изучение спектров испускания и поглощения при помощи монохроматора
1. Цель работы
Ознакомление с устройством спектрального прибора - монохроматора УМ2, построение градуировочного графика монохроматора, получение и изучение спектров испускания и поглощения.
2.Теоретические основы работы
Взависимости от того, свет какого источника исследуется, спектры бывают: линейчатые или атомные, молекулярные, сплошные. Все это спектры испускания
или эмиссионные.
2.1.Линейчатые или атомные спектры
Излучение изолированных атомов, например,
атомов разреженного одноатомного газа или пара металлов (Na, Hg), отличается наибольшей простотой. Спектры таких газов состоят из ряда дискретных спектральных линий разной интенсивности, соответствующих различным длинам волн.
Линейчатый спектр можно возбудить разными способами. Он появляется при различных видах электрического разряда в газах, при нагревании паров металлов в пламени горелки и т. д. Во всех этих случаях появляются спектральные линии, длины волн которых характерны для изучаемого атома. Совокупность этих линий и со-
3
www.mitht.ru/e-library
ставляет характерный для данного атома линейчатый спектр.
Спектры различных атомов отличаются чрезвычайным разнообразием, причем в некоторых из них, например, в спектре атома железа, насчитывается несколько тысяч линий.
Изучение линейчатых спектров показывает, что в расположении спектральных линий, образующих спектр, наблюдаются определенные закономерности: спектральные линии группируются в серии, расположенные в различных областях спектра. Каждая серия состоит из ряда линий, расстояние между которыми уменьшается с уменьшением длины волны, приближаясь к некоторому пределу, вблизи которого линии расположены очень тесно.
Впервые связь между частотами линий спектра водорода установил Бальмер в 1885г. Впоследствии Ридберг и Ритц (в 1890г.) представили частоты всех линий спектра атома водорода следующей формулой
|
c |
|
1 |
|
1 |
|
(1) |
|
|
Rc |
|
|
|
. |
|
|
|
m2 |
|||||
|
n2 |
|
|
|
|||
Здесь ν - частота данной линии, R - постоянная Ридберга (R= 109677,581см-1), c - скорость света, n и m - целые числа, причем m > n.
Для серии Лаймана, находящейся в ультрафиолетовой области спектра, имеем n = 1, m = 2,3,4…..
Для серии Бальмера в видимой области спектра n = 2, m = 3,4,5…..
Для серии Пашена в инфракрасной области спектра n = 3, m = 4,5,6…..
4
6.3.6. Поставьте перед щелью монохроматора столик. Поместите на столик первую кювету с исследуемым раствором и наблюдайте спектр поглощения. На фоне сплошного спектра видны темные области поглощения (или темные полосы).
|
|
|
|
Таблица 4. |
|
№ |
Название |
Положение по |
Длина |
Характер |
|
волны по |
поглощения |
||||
|
раствора |
шкале |
|||
|
графику |
раствора |
|||
|
|
|
|||
|
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
… |
|
… |
… |
|
|
|
|
|
|||
|
|
|
|
|
|
n |
|
|
|
||
|
|
|
|
|
6.3.7.Отметьте границы этих областей (или полос) по шкале, а затем по градуировочному графику определите длины волн в нм, соответствующие каждой области поглощения. Отметьте характер поглощения раствора: общий или избирательный, сильный или слабый. Результаты занесите в таблицу 4.
6.3.8.Повторите измерения по п.п. 6.3.6.-6.3.7., используя другие кюветы с исследуемым раствором.
21
www.mitht.ru/e-library

6.2.4. По полученным данным постройте график зависимости линейной дисперсии от длины волны l=f(λ), взяв в качестве λ среднее значение длины волны для данной области спектра.
6.3. Задание 3. Исследование спектров поглощения некоторых растворов.
6.3.1.Снимите с оптической скамьи конденсор и ртутную лампу, поставьте на их место лампу накаливания.
6.3.2.Включите лампу накаливания и осветите светом от нее щель монохроматора.
6.3.3.Вращая барабан 3 (рис.2) монохроматора, наблюдайте в окуляр сплошной спектр, даваемый лампой накаливания.
6.3.4.На глаз найдите крайнюю красную границу
спектра φкр и крайнюю фиолетовую границу φф. По шкале барабана 3 определите эти значения φкр и φф. По градуировочному графику определите длины волн, соответствующие границам видимого спектра. Запишите полученные значения в таблицу 3.
|
|
|
|
Таблица 3. |
Границы |
Крайняя красная |
Крайняя фиолетовая |
||
сплошного |
кр |
кр |
ф |
ф |
спектра |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.3.5. Возьмите кюветы с исследуемыми жидкостями, название которых указано на боковой поверхности.
20
Таким образом, в обобщенной формуле (1) число n дает номер серии, а m - номер спектральной линии в данной серии.
Спектральные закономерности в спектре водорода можно объяснить исходя из теории Бора.
Согласно модели Бора-Резерфорда, атом водорода состоит из ядра, положительный заряд которого равен по абсолютной величине заряду электрона, и одного электрона, вращающегося вокруг ядра. Теория водородного спектра построена на трех постулатах Бора, содержание которых сводится к следующему.
1). Электрон может вращаться вокруг ядра только по таким орбитам, на которых момент количества движения электрона равен целому кратному от некоторого числа
h , которое можно трактовать как элементарный
2
момент количества движения, т.е.:
m |
r n |
h |
, |
(2) |
|
||||
e |
n n |
2 |
|
|
|
|
|
|
где me – масса электрона, n - его скорость на n-ой орбите, дозволенной первым постулатом Бора, rn – радиус этой орбиты, h – постоянная Планка (h = 6,625.10-34 Дж.сек), n – любое целое число (n = 1,2,3,….. ). Это число n называется главным квантовым числом.
2). Электрон, движущийся по любой из орбит, дозволенных первым постулатом, не излучает энергию.
3). Атом при переходе электрона с какой-либо дальней орбиты на орбиту, расположенную ближе к ядру, излучает один квант энергии.
Это положение может быть выражено следующим равенством:
5
www.mitht.ru/e-library
Wm Wn h mn , |
(3) |
где n и m – номера орбит, дозволенных первым постулатом, причем m > n; Wn и Wm – полные энергии электронов на этих орбитах, mn - частота кванта света,
излучаемого атомом при переходе электрона с m-ой орбиты на n-ую орбиту.
Применим постулаты Бора к выводу формулы, позволяющей рассчитать частоты и длины волн, соответствующие линиям водородного спектра.
Электрон в водородном атоме будет вращаться по орбите радиусом rn, если центростремительная сила, удерживающая электрон на орбите, будет равна кулоновской силе притяжения электрона к ядру.
e |
2 |
|
m 2 |
|
|
|
|
|
e n |
. |
(4) |
4 |
r2 |
|
|||
|
r |
|
|||
|
0 n |
|
n |
|
|
Решая совместно уравнения (2) и (4), можно найти значение радиуса n-ой орбиты и скорость электрона на ней:
|
n |
|
|
nh |
|
, |
(5) |
||||
2 m r |
|||||||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
e |
n |
|
|
|
r |
|
|
n |
2 |
0 |
h2 |
. |
(6) |
|||
|
mee2 |
||||||||||
|
n |
|
|
|
|
||||||
Электрон в атоме водорода находится в электрическом поле ядра. Его потенциальная энергия в этом поле равна
WП |
e2 |
. |
(7) |
|
4 0rn
6
6.2. Задание 2. Определение линейной дисперсии монохроматора УМ2.
Линейная дисперсия определяется по градуировочному графику, построенному в задании 1.
6.2.1. В данной работе дисперсия определяется для нескольких областей спектра, внесённых в таблицу 2. В качестве спектрального интервала длин волн dλ возьмите 50нм, соответствующие значения dφ берите по градуировочному графику. При этом следует учесть цену деления шкалы барабана: 2º по барабану соответствуют 20" поворота призмы. Вычислите dφ в градусах поворота призмы и переведите в радианы. Данные занесите в таблицу 2.
6.2.2.Угловую дисперсию β вычислите по формуле (13). Представьте данные в радианах на нанометр (рад/нм) и занесите в таблицу 2.
6.2.3.Для вычисления линейной дисперсии по формуле (14) необходимо угловую дисперсию (в рад/нм) умножить на фокусное расстояние зрительной трубы (f = 28см). Линейную дисперсию представьте в миллиметрах на нанометр (мм/нм) и занесите в таблицу 2.
|
|
|
|
|
|
|
Таблица 2. |
||
№ |
Области |
Δλ |
Δφ |
Δφ |
Δφ |
β |
|
l f |
|
|
спектра |
нм |
дел. |
гра |
рад |
рад/нм |
|
мм/нм |
|
|
|
|
шка |
д. |
|
|
|
|
|
|
|
|
лы |
|
|
|
|
|
|
1 |
красно- |
650-600 |
|
|
|
|
|
|
|
|
оранжевая |
|
|
|
|
|
|
|
|
2 |
оранжево- |
630-580 |
|
|
|
|
|
|
|
|
жёлтая |
|
|
|
|
|
|
|
|
3 |
зелёная |
550-500 |
|
|
|
|
|
|
|
4 |
сине- |
500-450 |
|
|
|
|
|
|
|
|
фиолетовая |
|
|
|
|
|
|
|
|
5 |
фиолетовая |
480-430 |
|
|
|
|
|
|
|
19
www.mitht.ru/e-library
делению шкалы φ = 1000º. Масштаб выберите так, чтобы график был достаточно большой и позволял чётко определить длину волны до 1нм.
Градуировочный график должен распространяться на длины волн от 400 до 700 нм, т.е. на всю видимую часть спектра.
Градуировочный график должен представлять собой плавную кривую. Эту кривую строят с помощью лекала.
|
|
|
Таблица 1. |
|
|
|
Длина |
Отсчет |
|
№ |
Цвет линии |
волны, |
по |
|
нм |
шкале, |
|||
|
|
|||
|
|
|
град |
|
1 |
Красная (сильная) |
690 |
|
|
2 |
Оранжевая (сильная) |
623 |
|
|
3 |
Оранжевые (сильные) |
612 |
|
|
3а |
|
607 |
|
|
4 |
Жёлтая (сильная) |
579 |
|
|
5 |
Жёлтая (сильная) |
577 |
|
|
6 |
Зелёная (сильная) |
546 |
|
|
7 |
Голубая (сильная) |
496 |
|
|
8 |
Голубая (сильная) |
492 |
|
|
9 |
Синяя (сильная) |
435 |
|
|
10 |
Синяя (слабая) |
434 |
|
|
11 |
Синяя (слабая) |
433 |
|
|
12 |
Фиолетовая (очень |
410 |
|
|
|
слабая) |
|
|
|
13 |
Фиолетовая (слабая) |
408 |
|
|
14 |
Фиолетовая (слабая) |
405 |
|
18
Кроме того, электрон имеет кинетическую энергию, которая равна
WK |
m 2 |
e2 |
(8) |
||
e n |
|
|
. |
||
2 |
|
||||
|
|
8 0rn |
|
||
Полная энергия электрона на n-ой орбите
W WП WK |
|
e2 |
. |
(9) |
|
||||
|
|
8 0rn |
|
|
Подставляя в формулу (9) выражение для rn из (6), получаем
m |
e4 |
|
(10) |
|
W |
e |
|
. |
|
|
|
|||
8 02h2n2 |
|
|
||
Из формулы (9) видно, что энергия электрона обращается в нуль, если радиус орбиты бесконечно велик. Знак минус показывает, что энергия уменьшается с уменьшением радиуса орбиты. Таким образом, низшее энергетическое состояние электрона соответствует орбите, наиболее близкой к ядру.
К тому же выводу можно придти на основании формулы (10). Энергия электрона обращается в нуль для орбиты с бесконечно большим значением главного квантового числа n. При уменьшении главного квантового числа энергия убывает, принимая все большие отрицательные значения. Следовательно, состояние с минимальной энергией получается при наименьшем значении n. Это соответствует наиболее близкой к ядру орбите.
Здесь рассматривается простейший возможный случай – движение электрона на плоских орбитах. При этом электрон имеет одну степень свободы и для полного описания его движения достаточно задания одной постоянной. Такой постоянной может служить энергия
7
www.mitht.ru/e-library

электрона. Энергия квантована с помощью главного квантового числа n. Таким образом, для описания состояния электрона на круговой орбите в атоме водорода достаточно одного квантового условия.
Рис. 1. Диаграмма энергетических уровней атома водорода
Из сказанного следует, что электрон может находиться лишь на определенных энергетических уровнях, задаваемых значениями n = 1,2,3… и т.д. (согласно формуле (10)). Промежуточные энергетические уровни невозможны.
На рис. 1 приведена диаграмма энергетических уровней круговых орбит атома водорода и показано образование серий спектральных линий. Энергия уровня отложена на вертикальной оси. Горизонтальные линии
8
6.1.4. Поставьте тумблер «сеть» на лицевой панели источник тока в положение «ВКЛ».
6.1.5.Включите осветительные лампы монохроматора с помощью выключателя 9.
6.1.6.Для зажигания ртутной лампы поставьте на блоке питания тумблер «Лампа ДРШ» в положение «ВКЛ» и нажмите чёрную кнопку «ПУСК», удерживая её в нажатом состоянии до загорания лампы.
6.1.7.Поворачивая барабан 3, просмотрите через окуляр весь спектр от фиолетовых до красных линий. При правильном положении ртутной лампы все линии должны быть ровно и ярко освещены. Если спектр виден не полностью, обратитесь к лаборанту или преподавателю.
6.1.8.Совместите с индексом окуляра зелёную линию и сделайте пробный отсчёт, который предъявите преподавателю.
6.1.9.Последовательно совмещайте с индексом линии спектра ртути от красной до фиолетовой и делайте
отсчёты φ в градусах по барабану монохроматора 3, отмечая цвет линий и записывая значения в таблицу 1. Всего должно быть 14 линий.
6.1.10. После проведения измерений с помощью ртутной лампы выключите ее тумблером «Лампа ДРШ», находящимся на блоке питания, опустив его вниз.
6.1.11. Взяв из таблицы 1 значение длин волн λ для ртутного спектра и соответствующие им отсчёты по шкале барабана 3 в градусах, постройте на миллиметровой бумаге градуировочный график λ=f(φ). По оси абсцисс откладывайте деления по барабану, по оси ординат – соответствующие длины волн λ. Начало координат соответствует длине волны 400нм и угловому
17
www.mitht.ru/e-library

Дисперсия спектральных аппаратов имеет различное значение в разных участках спектра. Поэтому угловое и линейное расстояние между спектральными линиями, отличающимися по длине волны на одну и ту же величину, будут также различными в разных участках спектра.
В данной работе предлагается определить линейную дисперсию спектрального аппарата - монохроматора УМ2 во всём диапазоне видимого спектра и найти графический закон изменения дисперсии с длиной волны.
5. Приборы и принадлежности
Монохроматор УМ2, ртутная лампа, лампа накаливания, блок питания для ртутной лампы, кюветы с исследуемой жидкостью.
6. Порядок выполнения работы
6.1 Задание 1. Градуировка шкалы монохроматора УМ2. Шкала барабана монохроматора градуируется для того, чтобы выразить показания шкалы барабана в длинах волн. Для градуировки используется линей-
чатый спектр ртутной лампы.
6.1.1.Поставьте перед щелью монохроматора 5 (рис.2.) на оптическую скамью конденсор 6 на расстоянии 13см и закрепите его с помощью винта на штативе.
6.1.2.На расстоянии 35-40см от щели поместите ртутную лампу, проверьте включение её вилки в гнёзда блока питания 10 (ЭПС-III).
6.1.3.Включите блок питания 10 в сеть переменного тока напряжением 220 В.
16
соответствуют разрешенным энергетическим уровням, т.е. целым значениям главного квантового числа n. При больших n расстояние между соседними разрешенными уровнями становится все меньше, и при n = ∞ уровни следуют непрерывно, образуя так называемый континуум. Нормальное положение электрона, соответствующее наименьшей возможной энергии, будет при n = 1.
Если электрон переходит с одного уровня на другой, то его энергия изменится скачком на величину h . В случае перехода на более низкий уровень испускается фотон, или квант лучистой энергии.
Этот квант лучистой энергии, испускаемый атомом при переходе электрона с m-ой орбиты на n -ую орбиту, согласно (10), будет равен:
h mn |
Wm Wn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
h mn |
|
m e4 |
|
|
m |
|
e4 |
|
|
|
m |
e4 |
|
1 |
|||||
|
e |
|
|
|
|
e |
|
|
|
|
|
e |
|
|
|
|
|
||
8 02h2m2 |
8 02h2n2 |
8 02h2 |
|
|
|||||||||||||||
|
|
|
|
|
n2 |
||||||||||||||
Частота излучаемого кванта |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
m |
e |
e4 |
1 |
|
|
1 |
|
|
|||||
|
|
mn |
|
|
|
|
|
|
|
|
|
|
|
. |
|||||
|
|
8 02h3 |
|
|
m2 |
||||||||||||||
|
|
|
|
|
|
n2 |
|
|
|||||||||||
m2 . (11)
(12)
2.2. Молекулярные спектры
Спектры молекул совершенно не похожи на спектры входящих в их состав атомов. Спектры молекул обычно состоят из отдельных полос, один край из которых резок (он называется кантом полосы), другой – размыт.
Молекулярные спектры называются полосатыми. Каждая полоса состоит из отдельных очень близко
9
www.mitht.ru/e-library

отстоящих друг от друга линий, которые к канту сгущаются так, что эта часть полосы кажется сплошной.
Большая сложность молекулярных спектров указывает на существование в атомах, связанных в молекулы, большего числа энергетических уровней по сравнению с тем, что имеется в независимых отдельных атомах.
2.3. Сплошные спектры
Накалённые до высокой температуры твёрдые и жидкие тела, плотные газы и пары излучают свет, при разложении которого получается сплошной спектр, имеющий вид цветной полосы с непрерывным переходом из одного спектрального цвета в другой. Распределение энергии по длинам волн в сплошном спектре является функцией температуры тела излучателя.
2.4. Спектры поглощения
Если поместить поглощающее свет тело между источником света, дающим сплошной спектр, и щелью спектрального аппарата, с помощью которого наблюдается спектр, то в этом случае на фоне сплошного спектра будут видны тёмные области поглощения, соответствующие тем длинам волн, которые поглощаются данным веществом.
Образовавшийся в данном случае спектр называется
спектром поглощения, или абсорбционным спектром.
Вид спектра поглощения зависит от поглощающего вещества. Для разных веществ области поглощения
10
4. Вывод расчётной формулы
Основными характеристиками спектрального аппарата являются угловая и линейная дисперсии. Угловая дисперсия зависит только от диспергирующего элемента аппарата. Линейная дисперсия l определяется, кроме того, геометрическими условиями фокусировки спектра. Угловая дисперсия определяется как отношение разности углов отклонения d двух спектрально близких монохроматических пучков лучей к разности их длин волн d , т.е.
|
d |
. |
(13) |
|
|||
|
d |
|
|
Если угловому расстоянию d соответствует линейное расстояние dS в плоскости изображения 7 объектива зрительной трубы прибора, то линейная дисперсия
l dS . d
По величине угловой дисперсии можно получить значения линейной дисперсии. Действительно, если расстояние между двумя спектральными линиями, отличающимися по длине волны на d , равно dS в плоскости 7 (рис.3), то расстояние при малых углах связанно с углом d равенством
dS fd ,
где f - фокусное расстояние объектива зрительной трубы. Отсюда получим
l f d .
d |
|
Следовательно, |
(14) |
l f . |
|
15 |
|
www.mitht.ru/e-library
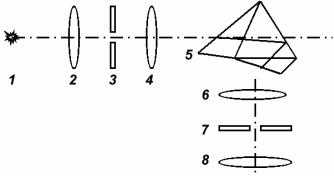
Рис. 3. Ход лучей в оптической системе монохроматора
ва коллиматора 4. Из объектива параллельный пучок лучей направляется на диспергирующую систему 5.
Если источник испускает немонохроматический свет, то вследствие того, что волны различных длин поразному преломляются в призмах из-за дисперсии показателя преломления, произойдёт разложение света на монохроматические составляющие, и из системы призм выйдут параллельные пучки лучей, соответствующие волнам определённой длины 1 , 2, 3……
Эти параллельные пучки лучей собираются в фокальной плоскости 7 объектива 6 зрительной трубы в виде спектрального изображения щели 3. Если источником света служит лампа низкого давления, содержащая инертный газ в атомарном состоянии, то спектральное изображение щели 3 будет иметь вид цветных полос, соответствующих атомному линейному спектру газа лампы. Спектр можно наблюдать через окуляр 8, при этом спектральные линии выводятся на выходную щель зрительной трубы, расположенную в плоскости 7.
14
получаются в различных спектральных областях и имеют различную ширину и интенсивность.
Различают следующие виды поглощения:
О бще е по гл ощ ен ие , когда ослабевает яркость всех областей сплошного спектра или значительной его части. Спектры поглощения таких веществ имеют вид широких полос.
И з би рат ел ьн ое п ог ло ще ни е , когда интенсивно поглощаются лучи в небольшом интервале длин волн. В этом случае спектр состоит из одной или нескольких тёмных полос на фоне сплошного спектра. Избирательное поглощение особенно резко выражено в спектрах поглощения газов.
Исследование спектров излучения и спектров поглощения является тонким методом качественного анализа. Исследование интенсивности спектральных линий позволяет применять этот метод для коли-чест- венного анализа.
3. Описание установки
Наблюдение спектральных линий и измерение их положения производится на монохроматоре УМ2 со стеклянной оптикой. Внешний вид установки представлен на рис. 2.
Монохроматор 12 укреплён на оптической скамье (рельсе), на которой размещены также конденсор 6 и источник света 7, закреплённые на штативах. Объектив коллиматора, система диспергирующих призм, а также объектив зрительной трубы находятся внутри корпуса монохроматора. Входная щель 5 регулируется по шири-
11
www.mitht.ru/e-library
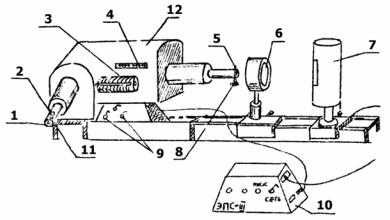
не микрометрическим винтом 8. Ширина щели уста-
новлена. Трогать микрометрический винт не рекомен-
дуется!!! Ртутная лампа включается блоком питания 10.
Рис.2. Внешний вид установки
Объектив коллиматора должен быть установлен таким образом, чтобы его щель находилась в фокусе объектива. Данный прибор настроен на зелёную линию ртути. На боковой стороне прибора расположена шкала с нониусом 4, показывающая положение объектива коллиматора. Подсветка шкалы включается тумблером 9.
В фокальной плоскости объектива зрительной трубы расположена выходная щель. Для установки положения спектральной линии в плоскости выходной щели имеется индекс в виде треугольника (зелёного цвета). Индекс наблюдается через окуляр 1. Ввод спектральной линии на индекс производится поворотом диспергирующих призм с помощью барабана 3. Индекс освещается лампочкой 2. Непосредственно под лампочкой расположен диск с набором светофильтров. Поворачивая диск,
12
можно осветить индекс жёлтым, красным, зелёным светом (в данном случае).
Окуляр 1 может устанавливаться на резкое для наблюдателя изображение индекса и спектральных линий вращением металлического кольца с нарезкой 11.
Отсчетным устройством прибора является барабан 3, который соединён с системой диспергирующих призм. При повороте барабана на одно деление (2°) система призм поворачивается на 20".
Монохроматор УМ2 является симметричной системой; фокусное расстояние его коллиматора равно фокусному расстоянию зрительной трубы (f = 28см).
Источником света в данной работе являются ртутная лампа и лампа накаливания. Ртутную лампу следует включать только в то время, когда ведутся наблюдения, т.к. от продолжительной работы интенсивность свечения понижается. Если ртутную лампу выключили, то повторное включение возможно только после её охлаждения.
Спектральные аппараты служат для пространственного разделения лучей различных длин волн.
Принципиальная схема монохроматора представлена на рис.3.
Схема состоит из трёх основных частей: коллиматора 2-4, служащего для получения параллельного потока лучей, диспергирующей системы 5 (призмы), разлагающей немонохроматический свет в спектр, и зрительной трубы 6-8 для наблюдения спектра.
Ход лучей в данной схеме следующий. Свет от источника 1 проходит через конденсор 2 и освещает щель 3, которая расположена в фокальной плоскости объекти-
13
www.mitht.ru/e-library
