
2_2000_zadachi
.pdfСтуденческий портал МИТХТ http://www.mitht.org
2.4. Задачи 2.1. Для реакции изомеризации -пинена в дипентен в газовой фазе
известны константы скорости: |
|
|
|
t, 0C |
184,5 |
197,9 |
217,9 |
k 105, с-1 |
3,66 |
14,3 |
88,5 |
Определите энергию активации и предэкспоненциальный множитель |
|||
уравнения Аррениуса. |
|
|
|
2.2. Константа скорости инверсии сахарозы изменяется с ростом
|
температуры следующим образом: |
|
|
|
|
|
t, 0C |
20 |
|
30 |
50 |
|
k 104, с-1 |
2,758 |
10,98 |
137,4 |
|
|
Определите среднюю энергию активации. |
|
|
||
2.3. |
Для реакции кислотного распада |
-аллилпалладийхлорида, |
|||
|
протекающей в концентрированном растворе соляной кислоты и |
||||
|
характеризующейся следующим стехиометрическим уравнением: |
||||
-С3Н5PdCl + HCl = C3H6 + PdCl2
экспериментально установлены константы скорости второго порядка:
|
|
|
|
Т, 0C |
20 |
30 |
41 |
47 |
60 |
|
10 |
6 |
, |
|
0.562 |
1.38 |
3.54 |
5.01 |
8.91 |
k2 |
|
л/моль сек |
|
|
|
|
|
Проверьте выполнимость уравнения Аррениуса и определите энергию активации EA и предэкспоненциальный множитель B.
2.4. Константа скорости омыления этилацетата щелочью изменяется с ростом температуры следующим образом:
t, o C |
0 |
20 |
25 |
k, л./(моль мин) |
1,17 |
5,08 |
6,56 |
Определите энергию активации реакции. |
|
|
|
2.5. Для реакции кислотного |
распада |
-аллилпалладийбромида, |
|
протекающей в концентрированном растворе бромистоводородной кислоты и характеризующейся следующим стехиометрическим уравнением:
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
-С3Н5PdBr + HBr = C3H6 + PdBr2
изучена температурная зависимость константы скорости второго порядка:
|
|
|
Т, 0C |
30 |
42 |
52 |
60 |
|
10 |
6 |
|
0.795 |
2.51 |
5.01 |
10.0 |
k2 |
|
, л./(моль с) |
|
|
|
|
Графическим методом определите энергию активации и предэкспоненциальный множитель B.
2.6. Для реакции H2 + I2 = 2HI константа скорости при температуре 2830С |
|
k1= 4,45 10-5 л/(моль с), а при температуре 3560С |
k2=2,52 10-3 |
л/(моль с). Рассчитайте энергию активации и предэкспоненциальный множитель уравнения Аррениуса.
2.7. Известно, что для многих жидкофазных реакций коэффициент ВантГоффа, показывающий, во сколько раз изменяется константа скорости реакции при повышении температуры на 100С, равен 2-3. Определите, какова энергия активации реакции, если коэффициент Вант-Гоффа равен 2 при температуре 200С и 800С.
2.8.Определите энергию активации реакции, если коэффициент ВантГоффа равен 3 при температуре 298 К (см. задачу 2.5.).
2.9.Константа скорости разложения пентоксида диазота (N2O5) равна
0,079 10-5с-1 при 00С и 12,9 10-4с-1 - при 350С. Рассчитайте энергию активации и величину предэкспоненциального множителя.
2.10. При прочих одинаковых условиях скорость реакции при температуре 300С, вдвое ниже, чем при 400С. Вычислите энергию активации.
2.11. Константа скорости при 300 К вдвое выше, чем при 200 К. Найдите энергию активации.
2.12.Реакция первого порядка прошла на 30% при 250С за 30 мин, а при 400С - за 5 мин. Определите энергию активации.
2.13.Константа скорости кислотного распада -аллилникельхлорида:
-С3Н5NiCl H2O + HCl = C3H6 + NiCl2 + H2O
изменяется с ростом температуры следующим образом:
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
|
|
|
t, 0C |
11 |
20 |
27 |
|
10 |
4 |
|
0.589 |
1.17 |
2.14 |
k2 |
|
, л/(моль с) |
|
|
|
Найдите константу скорости этой реакции при 15оС.
2.14.Константа омыления уксусно-этилового эфира едким натром при 90С 2,37 л/(моль мин), а при 140С - 3,204 л/(моль мин). При какой температуре константа скорости равна 4 л/(моль мин)?
2.15.Константа скорости реакции окисления -аллилпалладиййодида под действием йода:
[ -С3Н5PdI] + I2 = C3H5I + PdI2
изменяется с ростом температуры следующим образом:
t, 0C |
20 |
25 |
30 |
35 |
40 |
|
1.47 |
1.80 |
2.44 |
3.06 |
4.73 |
k2, л/(моль с) |
|
|
|
|
|
Определите константу скорости реакции при 15оС.
2.16.Энергия активации некоторой реакции равна 83,7 Дж/моль.
Рассчитайте отношение констант скоростей реакции при:
а) 200С и 300С; б) 400С и 500С.
2.17.Какой должна быть энергия активации, чтобы скорость реакции увеличилась в три раза при возрастании температуры: а) с 300 до 310 К;
б) с 1000 до 1010 К?
2.18.Константа скорости кислотного распада -аллилникельбромида:
-С3Н5NiBr H2O + HBr = C3H6 + NiBr2 + H2O
изменяется с ростом температуры следующим образом:
|
|
|
t, 0C |
6 |
11 |
20 |
27 |
|
10 |
2 |
|
2.12 |
3.46 |
5.55 |
9.25 |
k2 |
|
, л/(моль с) |
|
|
|
|
При какой температуре время полураспада комплекса составит 2 минуты, если начальная концентрация реагентов равна 0,1 М?
2.19. Реакцию окисления бромистого водорода, протекающую по уравнению HBr + O2 = HO2’+ Br’ исследовали при различных температурах. При этом наблюдалась следующая зависимость константы скорости от температуры:
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
Т, К |
700 |
762 |
800 |
k 103, л/(моль с) |
5,1 |
46,2 |
151,0 |
Рассчитайте энергию активации и предэкспоненциальный множитель.
2.20. Графическим методом определите величину энергии активации реакции разложения пентоксида диазота N2O5 в газовой фазе по следующим данным:
Т, 0C |
25 |
30 |
35 |
40 |
45 |
50 |
55 |
k 105, с-1 |
3,38 |
5,58 |
13,5 |
24,7 |
48,9 |
75,9 |
150 |
2.21. Реакция разложения диоксида азота на моноксид и кислород является реакцией второго порядка. Были получены следующие данные о температурной зависимости константы скорости:
Т, К |
592 |
603 |
627 |
652 |
656 |
k, л/(моль с) |
0,522 |
0,765 |
1,700 |
4,020 |
5,030 |
Графически определите энергию активации и рассчитайте величину предэкспонента уравнения Аррениуса.
2.22. Определите порядок реакции, энергию активации и предэкспоненциальный множитель из следующей зависимости времен полупревращения от температуры:
t, c |
529,5 |
538,5 |
550,5 |
560,5 |
569,0 |
1/2, с |
66,5 |
44,3 |
29,6 |
19,3 |
14,6 |
Начальное давление, |
203 |
205 |
199 |
200 |
201 |
ммрт.ст.
2.23.В реакции термического разложения циклопентана, подчиняющейся уравнению первого порядка, время превращения на 25% следующим образом зависело от температуры:
t, оС |
482,8 |
495,1 |
518,9 |
529,5 |
547,4 |
1/4, с |
44,3 |
23,7 |
7,03 |
4,53 |
1,89 |
Вычислите энергию активации и предэкспоненциальный множитель.
2.24. Для реакции термического разложения этана получены следующие значения константы скорости в зависимости от температуры:
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
Т, К |
823 |
833 |
843 |
853 |
863 |
873 |
883 |
893 |
903 |
k 105, с-1 |
2,5 |
4,7 |
8,2 |
12,3 |
23,1 |
35,3 |
57,6 |
92,4 |
141,5 |
Постройте график зависимости ln k от I/T. Рассчитайте энергию активации и предэкспоненциальный множитель.
2.25. Гидролиз некоторого алкилхлорида RCl в 80% этаноле протекает по первому порядку. Получены следующие значения константы скоростей:
t, 0С |
0 |
25 |
35 |
45 |
k, с-1 |
1,06 10-5 |
3,19 10-4 |
9,86 10-4 |
2,92 10-3 |
Постройте график зависимости lnk от I/T и определите энергию активации и предэкспоненциальный множитель.
2.26. Константы скорости реакции второго порядка при 328 и |
398 К |
соответственно равны 10-2 и 10-3 л/(моль мин). Вычислите скорость этой реакции при 343 К в начальный момент реакции, если начальные концентрации обоих веществ одинаковы и равны 0,01моль/л.
2.27. Были получены следующие значения для удельной скорости реакции разложения ацетондикарбоновой кислоты в водном растворе (реакция первого порядка):
t, 0С |
0 |
25 |
35 |
45 |
65 |
k 105, с-1 |
0,0787 |
3,46 |
13,5 |
49,8 |
487 |
Графическим методом определите энергию активации. Рассчитайте величину предэкспонента. Чему равно время полураспада при 550С?
2.28. Трихлорацетат-ион в ионизирующих растворителях, содержащих протоны Н+, разлагается на диоксид углерода и хлороформ:
Н+ + Cl3C-COO- = CO2 + HCCl3
Стадией, определяющей скорость реакции, является, вероятно, мономолекулярный разрыв связи С-С в трихлорацетат-ионе. Реакция идет по первому порядку и константы скорости имеют следующие значения:
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
t, 0С |
70 |
80 |
90 |
k 105, с-1 |
1,71 |
7,62 |
31,1 |
Рассчитайте энергию активации и константу скорости при 600С.
2.29. Для реакции пиридина с йодистым метилом в тетрахлорэтане
C5H5N + H3CI = C5H5NCH3+ + I-
определены константы скорости при разных температурах:
t, 0С |
19,9 |
29,9 |
39,9 |
50 |
k 102, л/(моль с) |
0,713 |
1,50 |
3,05 |
5,89 |
Графически рассчитайте |
энергию активации и |
величину |
||
предэкспоненциального множителя. К какому типу относится эта реакция (“нормальная”, “медленная” или “быстрая”)?
2.30. Для двух реакций одинакового порядка в аррениусовских координатах lnk = (1/T) пересекаются при значении аргумента 2,8 10-3К-1
Какой вывод вы можете сделать относительно констант скоростей этих реакций и значениях параметров уравнения Аррениуса для них?
2.31. Константа скорости окисления йодистоводородной кислоты пероксидом водорода H2O2 + 2HI = 2H2O + I2 изменяется с температурой следующим образом:
t, 0С |
20 |
30 |
k 102, л/(моль с) |
4,32 |
8,38 |
Вычислите энергию активации и константу скорости реакции при
400С.
2.32.Две реакции одинакового порядка имеют разные предэкспоненциальные множители, но их энергии активации различаются на 40 кДж/моль. Рассчитайте отношение их констант скоростей при 600 К.
2.33.Две реакции одинакового порядка имеют одинаковые предэкспоненциальные множители, но их энергии активации различаются на 50 кДж/моль. Рассчитайте отношение их констант скоростей при 500 К.
2.34.В исходном растворе находится 0,1 моля сложного эфира и 0,1 моля щелочи. Объем раствора 1 л. При 100С в течение 15 мин омыляется
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
10% эфира, а при 250С за тот же промежуток времени - 20%. Сколько эфира омылится в течение 5 мин при 400С и тех же исходных концентрациях реагентов?
2.35. Для реакции второго порядка А + В продукты время 90% конверсии при начальных концентрациях реагентов [A]0=[B]0= 0,1 моль/л и температуре 300 К равно 200 мин, а при температуре 320 К равно 40 мин. Вычислите время 99% конверсии при 330 К и [A]0=[B]0= 0,01 моль/л.
2.36. Каково время полураспада гидрида кремния SiH4 при 700 К по уравнению
SiH4 = Si + 2 H2 ,
если константа скорости первого порядка для этой реакции равна
2 1013. exp (- 216300/RT). [E] = Дж/моль.
2.37. Константа скорости реакции разложения ацетондикарбоновой кислоты
O=C(CH2COOH)2 O=C(CH3)2 +2CO2 при Т1 = 273,2 равна k1 = 2,46 10-5 мин-1
при Т2 = 313,2 равна k2 = 5,76 10-3 мин-1.
Вычислите время, в течение которого реакция пройдет на 70% при Т = 323,2 К.
2.38. Щелочное омыление этилового эфира уксусной кислоты характеризуется следующими значениями констант скорости при различных температурах:
Т, К |
273 |
293 |
298 |
k, л/(моль мин) |
1,17 |
5,08 |
6,56 |
Найти энергию активации и время прохождения половины реакции при 298 К, если взаимодействуют равные объемы растворов эфира и щелочи с концентрациями 0,0125 моль/л.
2.39.Разложение некоторого вещества является реакцией первого порядка с энергией активации 230120 Дж/моль. При 3000С разложение этого вещества происходит 95% в час. Вычислите температуру, при которой это вещество разлагается 0,1% в минуту.
2.40.Перборат натрия разлагается в соответствии с уравнением
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
NaBO3 + H2O NaH2BO3 + 1/2 О2
Процесс разложения является реакцией первого порядка. Константы скорости при 300С и 350С соответственно равны 2,2 10-3мин-1 и 4,1 10- 3мин-1. Вычислить энергию активации реакции и время, в течение которого при 400С разложится 99,99% пербората натрия.
2.41. Константа скорости первого порядка для суммарной реакции разложения N2O5 k = 4,3 1013 exp (-24700/RT) c-1; [EA] = кал/моль.
Рассчитать: а) время полураспада при -100С; б) время за которое реакция пройдет на 90% при 500С.
2.42. Изопропенилаллиловый эфир в первообразном состоянии изомеризуется в аллилацетон и скорость реакции подчиняется уравнению первого порядка. Зависимость скорости от температуры дается уравнением:
k = 1,86 1011 exp (-122500/RT), c-1; [E]= Дж/моль.
Сколько времени потребуется при 1500С, чтобы парциальное давление аллилацетона стало равным 300 мм, если реакция начинается при 760 мм. рт. ст. исходного эфира.
2.43. Некоторая реакция первого порядка имеет энергию активации 104,6 кДж/моль, а величина предэкспонента в уравнении Аррениуса равна 5 1013c-1. При какой температуре время полураспада для данной реакции будет равно: а) 1 мин, б) 30 дней.
2.44. Суммарная реакция термического разложения бромистого этила подчиняется уравнению первого порядка, и удельная скорость реакции дается выражением:
k = 3,8 1014 exp (-54800/RT), c-1; [E] = кал/моль.
Определить температуру при которой, при которой:
а) бромистый этил разлагается со скоростью 1% в секунду; б) за один час разлагается 70% вещества .
2.45.Определите длину свободного пробега молекулы водорода, имеющий диаметр 2,7 10-10м, при температуре 1000С и давлении 1 атм.
2.46.Рассчитайте длину свободного пробега молекул брома при температуре 298 К и концентрации 1 моль/л, =3,5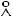 .
.
Студенческий портал МИТХТ http://www.mitht.org
Студенческий портал МИТХТ http://www.mitht.org
2.47. При каком давлении средняя длина свободного пробега атомов аргона ( = 2,9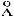 ) становится сравнимой с диаметром содержащего его пузырька объемом 1 см3?
) становится сравнимой с диаметром содержащего его пузырька объемом 1 см3?
2.48.Сколько соударений испытывает молекула азота ( = 0,32 нм) за одну секунду при температуре 2000С и давлении:
а) 1 атм,
б) 10 атм, в) 10-6 атм ?
2.49.Определите число двойных столкновений молекул кислорода О2, имеющих диаметр 3,56 10-10м, в 1 м3 за 1 с при давлении 1,33 103 Па, t 200С.
2.50.Рассчитайте число столкновений в 1 см3 воздуха, состоящего в основном из азота (79%) и кислорода (21%) при 298 К и общем давлении 1 атм:
а) между молекулами кислорода ( = 3,56 ); б) между молекулами кислорода и азота ( = 3,2
); б) между молекулами кислорода и азота ( = 3,2 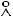 ).
).
2.51.Рассчитайте число столкновений молекул аммиака , имеющих диаметр
3 10-10 м, в 1 м3 за одну секунду при давлении 1 атм и температуре 250С. Как изменится это число при повышении температуры на 100С при постоянном объеме?
2.52.Рассчитайте число столкновений молекул диоксида углерода ( = 4,6 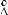 )
)
в1 см3 при давлении 1 атм? Как изменится эта величина, если давление увеличить вдвое? T =400 K.
2.53.Чему равна доля активных столкновений в реакциях с энергией активации 100 кДж/моль при температуре: а) 300 К; б) 500 К; в) 1000 К?
2.54.Рассчитайте константу скорости реакции между йодом и водородом при
температуре 5000С, если средний диаметр столкновений составляет 2 10- 10 м, а энергия активации 167 кДж/моль.
2.55.Окисление оксида азота озоном являетс бимолекулярной реакцией с
энергией активации 9,6 кДж/моль:
NO + O3 = NO2 + O2.
Газокинетический диаметр молекулы азота равен 3 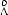 , а молекулы озона
, а молекулы озона
-4 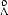 . Определите теоретическое число молекул, реагирующих в 1 м3
. Определите теоретическое число молекул, реагирующих в 1 м3
за 1 с |
при температуре 300 К и давлении 1 атм. Рассчитайте |
Студенческий портал МИТХТ http://www.mitht.org

Студенческий портал МИТХТ http://www.mitht.org
теоретическое значение предэкспонента уравнения Аррениуса для
этой реакции и срав- |
ните его с экспериментальным значением В = |
||||
1,1.109 л/(моль.с) - |
вычислите |
стерический |
множитель. |
Сделайте |
|
выводы о характере реакции |
на |
основании |
полученного |
значения |
|
стерического множителя. |
|
|
|
|
|
2.56. Определите стерический фактор реакции пара-орто-превращения водорода по реакции H + p-H2 = o-H2 + H, если константа скорости этой реакции при 270С равна 7,3 104 л/(моль с), а энергия активации – 34,3 кДж/моль. Газокинетический диаметр молекул водорода 2,7 , а атомов водорода - 1,35
, а атомов водорода - 1,35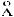 .
.
2.57. Для реакции разложения диоксида азота 2NO2 = 2NO + O2 предэкспоненциальный множитель уравнения Аррениуса равен 4 109 л/(моль с). Рассчитайте стерический фактор этой реакции, если газокинетический диаметр молекулы диоксида азота равен 3,6  , а температура 500 К.
, а температура 500 К.
2.58.Диаметр метильного радикала равен 3,8 10-10. Какова максимальная константа скорости реакции второго порядка для рекомбинации радикалов при комнатной температуре. Трансмиссионный коэффициент принять равным 1, а энергию активации - 0.
2.59.Димеризация бутадиена в газовой фазе является реакцией 2 -го порядка.
|
CH2 |
|
|
|
|
CH2 |
|
|
|
|
|
|
CH |
CH 2 |
|
|
|
|
|
|
|||
|
CH |
|
CH2 |
||||||||
|
+ |
|
|
|
|
|
|
|
|
|
|
CH |
|
CH |
|
CH |
|
CH |
|||||
|
CH 2 |
|
CH CH 2 |
|
CH2 |
|
CH |
|
|
CH2 |
|
|
|
|
|
|
|||||||
|
|
|
|
||||||||
Эффективный диаметр молекул бутадиена равен 5.10-10 м. В таблице даны значения констант скорости реакции димеризации бутадиена в зависимости от температуры:
Т, К |
503 |
513 |
527 |
540 |
578 |
622 |
k, 103, л/(моль с) |
0,531 |
0,715 |
1,40 |
2,43 |
9,85 |
44,5 |
Вычислите энергию активации и значение предэкспонента уравнения Аррениуса. Рассчитайте значение предэкспонента по теории столкновений и сопоставьте его с опытным значением. К какому типу (“нормальные“, “медленные“ или “быстрые“) относится рассматриваемая реакция?
Студенческий портал МИТХТ http://www.mitht.org
