
kulon
.pdf1. ОБЩАЯ ХАРАКТЕРИСТИКА и классификация кулонометрических методов анализа
Кулонометрические методы анализа основаны на измерении ко-
личества электричества, израсходованного на электропревращение определяемого вещества. «Титруйте электронами» - таким образом рекламировала одна из японских фирм установки для кулонометрического анализа, что, как нельзя лучше, отражает сущность этого способа анализа. Связь между массой вещества, подвергнувшегося электропревращению (электролизу), и затраченным при этом количеством электричества определяется законом Фарадея
m |
M Q |
, |
(1) |
|
z F |
||||
|
|
|
где m – масса вещества, г; М – молярная масса вещества, г/моль; Q
– количество электричества, Кл; z – число электронов, участвующих в электродной реакции; F – постоянная Фарадея (96500 Кл/моль).
Кулонометрические методы анализа обладают существенным преимуществом перед большинством других методов анализа. Это связано с тем, что в соответствии с уравнением (1) коэффициент пропорциональности между аналитическим сигналом (Q) и массой определяемого вещества (m) содержит только физические константы (табулированные величины). Поэтому при использовании кулонометрических определений не требуется проводить градуировку аналитического сигнала по стандартным образцам (растворы сравнения), что является необходимым условием для большинства современных физических и физикохимических методов анализа.
Кроме того, кулонометрические методы анализа обеспечивают получение результатов с лучшей воспроизводимостью, чем большинство других методов анализа при определении как малых, так и сравнительно больших содержаний; они более экспрессны и легко автоматизируются.
Взависимости от происходящих электродных процессов кулонометрические методы разделяются на прямую кулонометрию и кулонометрическое титрование (косвенную кулонометрию).
Вслучае прямой кулонометрии определяемое вещество непосредственно подвергается электролизу (электрохимическому превращению).
При кулонометрическом титровании электролизу подвергают вспомогательный реагент и в результате получают (генерируют) титрант, вступающий в химическую реакцию с определяемым веществом. Зная количество электричества, израсходованное на получение титранта, рассчитывают массу анализируемого компонента. При этом не имеет значения, проходит или не проходит электродная реакция определяемого вещества, т.е. является или не является электрохимически активным само определяемое вещество.
Кулонометрические определения можно осуществлять, задавая (контролируя) или потенциал рабочего электрода или величину тока
4
http://www.mitht.org/forum
электролиза. В соответствии с контролируемым параметром кулонометрические методы разделяют на две группы:
потенциостатические, в которых потенциал рабочего электрода остается неизменным в течение всего времени электролиза;
гальваностатические (амперостатические), в которых сила тока в течение всего времени электролиза поддерживается постоянной.
Закон Фарадея позволяет оценить, сколь низкие содержания веществ можно определить кулонометрическим методом анализа. Так, ес-
ли подвергать электролизу вещество с молярной массой эквивалента, равной 100 г/моль в течение 20 минут при силе тока 10-6 А, т.е. затратить около 10-3 Кл электричества, то можно определить 1 мкг (10-6 г) этого
вещества. Современная аппаратура позволяет надежно измерять и более слабые токи, например 10-8 А и ниже, а также значительно меньшие количества электричества (10-4 – 10-6 Кл). В связи с этим кулонометриче-
ские методы можно использовать для определения нанограммовых количеств вещества (10-9 г).
Во всех разновидностях кулонометрического метода анализа необходимо выполнение определенных условий.
Прежде всего, электролиз должен осуществляться со 100 % выходом по току. Следовательно, количество электричества полностью расходуется на основную электродную реакцию.
Выход по току менее 100 % может быть обусловлен затратами электричества на такие побочные электродные процессы, как электролиз растворителя, восстановление или окисление примесей или реакции с участием материала электрода, а также на протекание вторичных электродных реакций окисления или восстановления первоначально полученных продуктов электролиза.
Выбор условий кулонометрических определений осуществляется по вольтамперным кривым компонентов. На основе этих кривых выбираются условия, обеспечивающие 100 % выход по току, материал и потенциал рабочего электрода, значение рН раствора.
Кроме 100 % выхода по току для осуществления анализа необходимо определить окончание электродной реакции в прямой кулонометрии и химической реакции в кулонометрическом титровании, а также точно измерить количество электричества, затраченного на проведение электродной реакции.
2. Прямая кулонометрия
2.1. Потенциостатическая кулонометрия
Эта разновидность прямой кулонометрии используется для определения растворенных веществ и основана на проведении электродной реакции определяемого вещества при постоянном потенциале рабочего электрода. Для выполнения определения используют ячейку с тремя электродами (трехэлектродная ячейка): рабочим электродом, на кото-
5
http://www.mitht.org/forum
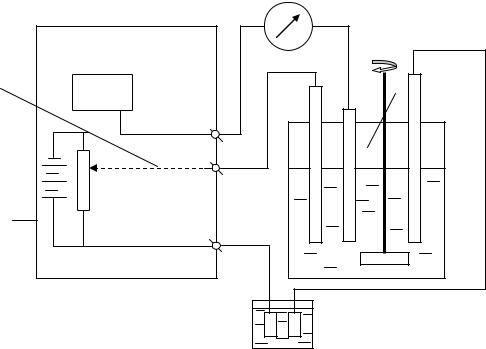
ром протекает электрохимическая реакция, вспомогательным электродом и электродом сравнения (для измерения потенциала рабочего электрода). Принципиальная схема установки для кулонометрического анализа при контролируемом потенциале приведена на рис. 1.
7
6 |
4 |
|
5 |
8 |
3 |
1 |
|
2 |
|
Рис.1. Принципиальная схема установки для потенциостатической кулонометрии: 1 - потенциостат; 2 - кулонометр; 3 - ячейка; 4 - рабочий электрод; 5 - вспомогательный электрод; 6 - электрод сравнения; 7 - миллиамперметр; 8 - потенциометр.
Постоянное значение потенциала рабочего электрода поддерживается автоматически потенциостатом. Напряжение, обеспечивающее заданное значение потенциала рабочего электрода, подается на ячейку от одного из блоков потенциостата. Потенциал рабочего электрода измеряется по отношению к электроду сравнения потенциометром, являющимся другим блоком потенциостата, и сравнивается с заданным значением. За счет обратной связи между этими блоками подаваемое на ячейку напряжение поддерживается на необходимом уровне.
Рассмотрим, каким образом в потенциостатической кулонометрии выбирают потенциал рабочего электрода, определяется окончание электродной реакции и проводится измерение количества электричества, израсходованного на проведение процесса.
Выбор потенциала рабочего электрода осуществляют на основании кривых ток-потенциал (I-E) для определяемого вещества, т.е. по
вольтамперным или поляризационным кривым.
Предположим, что в анализируемом растворе находятся два компонента А и В, каждый из которых электроактивен. Причем, компонент А способен на электроде восстанавливаться (А + nе В), а компонент В –
6
http://www.mitht.org/forum
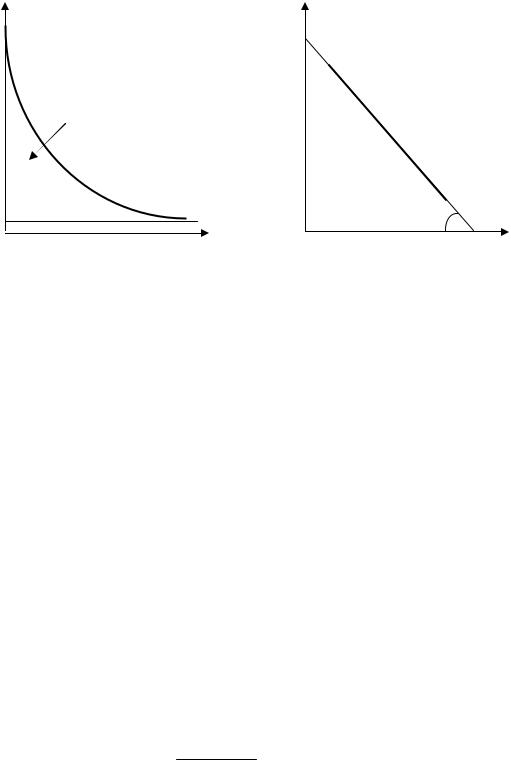
окисляться (В - nе А). Схемы вольтамперных кривых этих компонентов приведены на рис.2. В соответствии с приведенными кривыми можно выбрать условия для определения каждого компонента в растворе.
При потенциале рабочего электрода в области предельного тока восстановления компонента А (например, Е1) соответствующая электродная реакция будет А + nе В. Следовательно, потенциал в области предельного тока восстановления А соответствует протеканию электродной реакции, необходимой для определения компонента А. При потенциалах в области предельного тока окисления компонента В (например, Е2) будет происходить электродная реакция В - nе А, соответствующая электропревращению компонента В.
кат.
1
А  В
В
Е1
Е2 |
-Е |
А В
В
2
ан.
Рис.2. Схемы вольтамперных кривых: 1- восстановления компонента А; 2 – окисления компонента В
Подчеркнем, что потенциал рабочего электрода выбирают в области предельного тока. В этих условиях наблюдается не только 100 % выход по току, но и максимально возможная скорость электродной реакции.
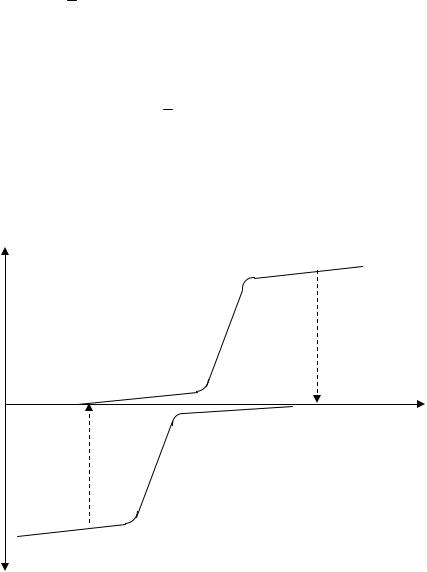
Поскольку концентрация определяемого вещества в процессе электролиза снижается, то сила тока в цепи также непрерывно уменьшается. Экспериментальная зависимость силы тока от времени электролиза в перемешиваемом растворе выражается экспоненциальной кривой (рис. 3,а) и описывается уравнением
t 0 e kt |
0 e |
D S |
t , |
|
V |
(2) |
где t – сила тока в любой момент времени; 0 – сила тока в начальный момент электролиза; D – коэффициент диффузии определяе-
7
http://www.mitht.org/forum
мого вещества; S – площадь электрода; V – объем анализируемого раствора; t – время электролиза; - толщина диффузионного слоя.
|
а) |
|
lg |
б) |
|
|
|
lg 0 |
|
|
t |
|
|
tg = 2,303.k |
|
Q |
dt |
|
|
|
0 |
|
|
|
ост. |
t |
0 |
|
0 |
t |
Рис. 3. Изменение тока электролиза во времени в потенциостатической кулонометрии
Теоретически окончание электролиза ( =0 и концентрация определяемого компонента равна нулю) достигается при t= . На практике задаются погрешностью определения и за окончание процесса принимают момент, когда t=0,01. 0 соответствующую величине погрешности 1% илиt=0,001. 0 (погрешность 0,1%). Затраченное на электропревращение определяемого вещества количество электричества можно определить различными способами. Одним из способов является интегрирование. В этом случае записывают силу тока как функцию времени (рис. 3, а), а затем интегрируют, используя либо расчетные способы, либо инструментальные для получения величины площади под зарегистрированной кривой, которая пропорциональна количеству электричества:
t |
|
|
Q |
dt |
(3) |
0 |
|
|
Расчет количества электричества (Q) несколько упрощается, если использовать зависимость lg t – t. Из уравнения (2) следует, что
lg t = lg 0 – 2,303.k.t, (4)
где 2,303 – коэффициент перехода от натурального логарифма к десятичному. После подстановки уравнения (4) в (3) получим:
Q = |
0 |
(5) |
2,303 к. |
Значения 0 и k находят графически (рис.3, б).
Для более точного измерения количества электричества используются специальные устройства – кулонометры и интеграторы, - включенные в цепь установки для кулонометрического анализа.
Электрохимические кулонометры включаются в цепь последовательно с кулонометрической ячейкой (рис. 1). Они представляют собой
8
http://www.mitht.org/forum
электролизеры, в которых происходит электролиз со 100 % выходом по току. По окончании электролиза определяют количество продукта анодной, катодной или суммарной реакции в кулонометре, а затем вычисляют, на основании закона Фарадея, количество электричества. Уравнение электрохимической реакции, естественно, должно быть известно.
По принципу определения количества вещества различают кулонометры различных типов: электрогравиметрические, титриметрические, газовые и др.
Работа электрогравиметрических кулонометров основана на осаждении при электролизе плотного осадка металла с относительно большой эквивалентной массой и определении массы этого осадка. Чаще других используются серебряный и медный кулонометры. В первом из них используется выделение металлического серебра на платиновом катоде из раствора нитрата серебра; в качестве анода в этом случае применяется серебряная пластина. Легко вычислить, что при прохождении 1 Кл электричества осаждается 1,118 мг серебра в серебряном кулонометре и 0,329 мг меди в медном кулонометре.
В титриметрических кулонометрах происходит образование растворимых продуктов электродного окисления или восстановления, которые затем титруют соответствующими рабочими растворами. Например, в иодном кулонометре иод, получающийся за счет окисления иодида на
платиновом аноде (2 - - 2е 2) титруют стандартным раствором тио-
сульфата натрия ( 2 + 2Na2S2O3 = 2Na + Na2S4O6).
Газовые кулонометры позволяют измерить количество электричества по объему газов, выделившихся в результате электрохимической реакции. Простейший из них – водяной кулонометр, в котором происходит электролиз воды. При этом на аноде получается кислород, на катоде – водород. Объем смеси измеряют, приводят к нормальным условиям и вычисляют израсходованное количество электричества.
Для определения количества электричества применяют также интеграторы. В настоящее время предпочтение отдают электронным аналоговым интеграторам. Принцип их действия основан на накоплении заряда (пропорционального току) на конденсаторе в процессе электролиза с последующим определением напряжения на этом конденсаторе. Такие электронные интеграторы тока работают в совокупности с пересчетным устройством, что позволяет производить цифровой отсчет в кулонах или массовых долях определяемого вещества. Одним из основных достоинств интеграторов является высокая точность определения малых количеств электричества (до 0,01 %).
Потенциостатическая кулонометрия отличается высокой избирательностью определения, что обеспечивается выбором потенциала рабочего электрода, при котором осуществляют необходимую электродную реакцию.
В качестве рабочих электродов чаще всего используют платиновые или ртутные электроды с большой поверхностью. Ртуть в виде слоя на
9
http://www.mitht.org/forum
дне электролизера применяют преимущественно для процессов восстановления, платину – для электродного окисления (т.е. в анодной области).
Для выбора потенциала рабочего электрода можно воспользоваться данными по потенциалам полуволн, имеющимся в справочной литературе по вольтамперометрии (полярографии). При использовании электродного восстановления потенциал рабочего электрода должен быть на 0,2-0,3 В более отрицательным, чем потенциал полуволны электроактивного вещества; в случае анодной реакции – на такую же величину более положительным. Потенциостатические кулонометрические определения не вызывают затруднений при анализе простых по составу растворов, не содержащих других компонентов, кроме определяемых. Наличие в анализируемом растворе посторонних веществ требует дополнительной информации.
Для этого в общем случае следует не только знать, какие посторонние вещества содержатся в анализируемом объекте, но и получить их вольтамперные кривые. Если посторонние компоненты электроактивны, то их следует удалить из раствора или изменить условия электролиза (ввести комплексообразователь, изменить рН) таким образом, чтобы посторонние компоненты стали электрохимически неактивны. Удаление примесей, разряжающихся легче, чем определяемое вещество, часто осуществляют предварительным электролизом (предэлектролизом) при потенциале предельного тока мешающего компонента.
Потенциометрическая кулонометрия широко используется при анализе веществ высокой чистоты для определения как основных компонентов, так и примесей. Особый интерес представляет анализ благородных металлов и сплавов на их основе. Особенно актуальна потенциостатическая кулонометрия для определения содержания основного вещества с большой точностью (Sr = 0,002-0,005). С применением катодного восстановления разработаны методики определения меди, висмута, кобальта, никеля, свинца и др. (восстановление до металла), хрома (VI), железа (III) (восстановление до более низких степеней окисления), нитро- и галоидопроизводных органических соединений. Анодное окисление на платине и серебре положено в основу методик определения галогенидов, тиоциана, мышьяка (III), железа (II), хрома (II) и др.
Нижняя граница определяемых концентраций этого метода составляет 10-6 моль/л и обусловлена величиной остаточного тока. Поскольку для анализа можно применять малые объемы проб, то абсолютные количества определяемых компонентов в микрокулонометрическом варианте составляют 10-7 – 10-8 г.
Погрешность прямых кулонометрических определений при контролируемом потенциале зависит от способа определения количества электричества. Относительная погрешность обычно составляет 0,001 – 0,05.
10
http://www.mitht.org/forum
2.2. Гальваностатическая (амперостатическая) кулонометрия
Разновидность этой прямой кулонометрии основана на проведении электиролиза определяемого вещества при постоянной силе тока и находит применение только для определения веществ, находящихся на поверхности рабочего электрода в твердом состоянии (например, металлов, малорастворимых солей, оксидов).
Рассмотрим, почему гальваностатическую кулонометрию нельзя использовать для определения растворенных веществ. Предположим, что в водном растворе содержится в небольшой концентрации вещество
А, способное окисляться на платиновом электроде (А + nе В). Для этого электроактивного вещества может быть получена вольтамперная кривая с площадкой предельного тока (рис.4.).
Допустим, что выбрана постоянная сила тока электролиза ( э ), величина которой больше предельного тока компонента А ( пр. ). Тогда в соответствии с вольтамперной кривой (рис.4., кривая 1) потенциал рабочего электрода будет соответствовать значению Е1. При этом потен-
циале на электроде будут проходить две реакции: основная А - nе В и
побочная 4Н2О - 4е О2 + 4Н+. Протекание побочной реакции приведет к тому, что выход по току будет менее 100 %.
ок. |
1 2 |
э
Н2О О2
О2
пр.
А  В
В
эпр.
Е2 Е3 Е1 +Е Рис. 4. Схемы вольтамперных кривых окисления вещества А на
платиновом электроде: 1 - в начальный момент времени; 2 - по истечении некоторого времени электролиза.
Если задать величину тока электролиза ( э ) меньше предельного тока вещества А ( пр. ), то потенциал электрода сначала принимает зна-
11
http://www.mitht.org/forum
чение Е2 и на электроде некоторое время реагирует только вещество А.
Протекание реакции А - nе В приведет к уменьшению концентрации вещества А в растворе и снижение предельного тока. Когда концентрация вещества А понизится настолько, что ток электролиза ( э ) будет превышать величину предельного тока ( э пр. ), то будут наблюдаться явления, аналогичные описанным выше. В соответствии с новым расположением вольтамперной кривой (рис.4, кривая 2) для сохранения тока электролиза на заданном уровне произойдет изменение потенциала электрода до значения Е2, что вызовет протекание побочной реакции на электроде. Таким образом, для растворенного электроактивного вещества невозможно обеспечить 100 % выход по току при проведении электролиза в амперостатическом режиме.
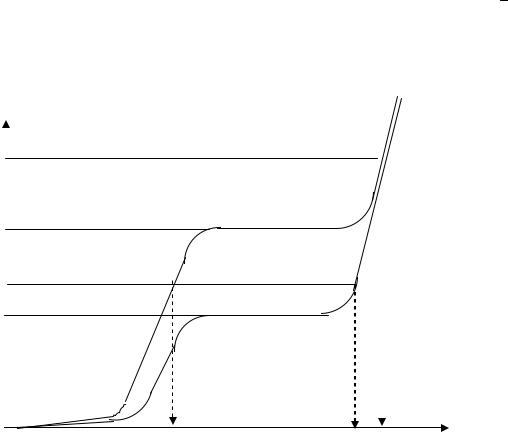
В отличие от растворов твердые электроактивные вещества дают вольтамперные кривые без площадок предельного тока. Например, если на поверхности электрода находится металл, способный электрохимически окисляться, то анодную вольтамперную кривую растворения можно представить так, как показано на рис.5.
ан.
1 2 3 |
4 |
э
М М+n
М+n
Н2О  О2
О2
М |
М+n Е1Е2Е3 |
Е4 |
+Е |
кат.
Рис. 5. Вольтамперные кривые анодного окисления металла М: 1 - в начальный момент электролиза; 2,3 – по истечении некоторого времени электролиза; 4 – кривая окисления воды
Предположим, что проводят анодное окисление металла М при постоянной силе тока электролиза ( э). В соответствии с кривой 1 (рис.5.) потенциал электрода принимает значение Е1 и на нем протекает только
основная электродная реакция (М - nе М+n). По окончании этой реакции, когда окислится весь металл М с поверхности электрода, для протекания тока заданной величины произойдет изменение потенциала электрода, что вызовет новую электродную реакцию. Это может быть реакция окисления другой твердой фазы (если она имеется на электро-
12
http://www.mitht.org/forum
де), самого материала электрода или окисление растворителя, напри-
мер, воды (2Н2О - 4е О2 + 4Н+).
В процессе анодного окисления металла М потенциал электрода меняется сравнительно мало и близок к значению Е1 (рис. 5). По окончании основного электродного процесса на электроде начнет протекать новая электродная реакция, что сопровождается скачком потенциала тем большим, чем больше разность стандартных (точнее, реальных) потенциалов редокс-пар, участвующих в электродных процессах. Следовательно, за окончание электролиза принимается момент резкого изменения потенциала рабочего электрода. По кривой зависимости потенциала рабочего электрода от времени электролиза находят время окончания процесса, а затем вычисляют количество электричества (Q = э.t).
Для анализа используют и процессы катодного восстановления, например, при определении оксидов металлов. При наличии на поверхности электрода нескольких электроактивных твердых фаз возможно их раздельное определение, если потенциалы окисления (восстановления) отличаются не менее, чем на 0,3 В.
Амперостатическую кулонометрию применяют для определения толщины металлических покрытий, оксидных пленок, пленок солей (например, хлорида серебра). Метод можно использовать в инверсионном варианте. Для этого предварительно осаждают определяемое вещество из раствора на электроде, а затем проводят анодный или катодный процесс с выделенным продуктом электрохимической реакции.
Нижняя граница определяемых содержаний прямой амперостатической кулонометрии составляет около 10-8 г.
3. Кулонометрическое титрование
Эта разновидность кулонометрического анализа относится к косвенной кулонометрии и используется для определения растворенных веществ. Этот метод основан на взаимодействии определяемого вещества с титрантом, который получают электролизом. Титрант в этом слу-
чае называют электрогенерированным.
В кулонометрическом титровании могут применяться два способа генерирования титранта: внутренний и внешний. В первом из них титрант получают в том же растворе, который содержит анализируемый компонент. Реже используют генерирование титранта в отдельной электролитической ячейке с последующим введением его в раствор анализируемого вещества (внешняя генерация).
Кулонометрическое титрование можно применять для определения как неэлектроактивных, так и электроактивных веществ. Тогда в первом случае электродная реакция используется только для получения титранта, во втором случае и само определяемое вещество может принимать участие в реакции на рабочем (генераторном) электроде. Наибо-
13
http://www.mitht.org/forum
