
- •Содержание
- •Химера - организм-мозаик, сочетающий клетки, ткани, органы различных организмов.
- •Гибридизация животных клеток
- •Культуры растительных клеток
- •Клеточная селекция
- •Мозаичные растения и растения-химеры
- •Мозаичные животные и животные-химеры
- •Эмбрион млекопитающих: дифференцировка клеток
- •Литература
Гибридизация животных клеток
История метода
Предположение о том, что соматические клетки могут сливаться друг с другом, было высказано еще в начале ХIX века в связи с открытие многоядерных клеток. В историческом аспекте представляет интерес то обстоятельство, что открытие поликарионов как бы подтверждало ошибочное представление Шлейдена, который считал, что новые клетки зарождаются в виде пузырьков внутри цитоплазматической мембраны родительских клеток. Разделявший эту точку зрения Рудольф Вирхов представил в 1851 г. рисунок многоядерной опухолевой клетки в полной уверенности, что ядра являются эндогенными зачатками новых клеток. Кроме того, открытие поликарионов подлило масла в огонь борьбы с клеточной теорией. Противники ее выдвинули гипотезу, согласно которой организм представляет собой единую тканевую массу с непрерывной цитоплазмой, а существование поликарионов рассматривали как подтверждение этой гипотезы. Со временем восторжествовала клеточная теория, а существование поликарионов отнесли к разряду интересных исключений.
Гибриды соматических клеток были открыты лишь в 60-х годах нашего столетия. В 1960 г. Барский с сотрудниками сообщили о выделении линии гибридных клеток. Гибридные клетки были получены путем смешения двух линий, выделенных ранее из 1 клетки мышиной саркомы. Исходные линии отличались по числу и морфологии хромосом, а также по способности к образованию опухоли при введении их мышам. Гибридные клетки содержали число хромосом, отличное от исходных клеточных линий, а также содержали поверхностные антигены клеток обеих родительских линий. Далее было установлено, что клеточные гибриды можно получить, используя клетки различных видов животных. В качестве агента, индуцирующего слияние выступал инактивированный вирус HVJ, называемый также вирусом Сендай. С этих пор вирус Сендай стал широко использоваться в экспериментах по слиянию клеток.
При изучении межвидовых гибридных клеток, способных к пролиферации были сделаны два очень важных наблюдения:
- в гибридах могут проявиться оба генома;
- в долгоживущих межвидовых гибридах элиминируются хромосомы одного вида.
Слияние клеток не обязательно должно быть чем-то стимулировано. Как in vivo, так и in vitro оно может проходить и без добавления специальных агентов. Несмотря на то, что все слияния такого рода можно считать спонтанными, некоторые из них постоянно происходят в процессе онтогенеза, а следовательно, эволюционно запрограммированы. До сих пор нерешенной остается одна из труднейших загадок биологии, состоящая в том, что мембраны, находящиеся внутри клетки сливаются часто, тогда как мембраны, разграничивающие клетки, сливаются редко. Например, пузырьки аппарата Гольджи сливаются друг с другом, образуя клеточные пластинки при цитокинезе у растений, мембраны ЭР - с элементами АГ при переносе вновь синтезированных белков и т.д.
В то же время нормальные клетки в естественных условиях крайне редко сливаются друг с другом. Исключение составляет процесс оплодотворения. Кроме того, в качестве подобного рода исключения выступает процесс плазмогамии у высших грибов, когда одноядерные гаплоидные клетки сливаются, образуя двуядерные (дикарионы). Такие клетки размножаются митотически, оставаясь двуядерными, и в результате образуют всем хорошо известные плодовые тела.
В естественных условиях слияние клеток происходит и у млекопитающих. Например, клетки могут сливаться при формировании мышечных трубочек. Еще в XIX веке было показано, что миофибриллы поперечно-полосатых мышц образуются в поликарионах - крупных удлиненных многоядерных клетках. Поликарионы - продукт слияния одноядерных миобластов. Слияние опухолевых клеток - довольно обычное явление, при этом опухолевые клетки in vivo иногда сливаются и с нормальными. Эксперименты по спонтанному слиянию клеток проводились и in vitro. При проведении подобных экспериментов получают так называемых "химерных" или аллофеных мышей - животных, в тканях которых содержатся клетки различных генотипов (рис. 1).

Рис. 1. Получение аллофенных мышей
Методы создания химер
1. Агрегационный- был предложен практически одновременно и независимо друг от друга Тарковским в Варшаве и Минц в Филадельфии (1961-1962 гг.).
Из матки беременных самок-докторов извлекают зародыши, достигшие стадии 8 бластомеров. Бластомеры, полученные от двух животных с различными генотипами (например, от мышей с белой черной окраской шерсти) помещают в условия, способствующие их агрегации и образованию 16-ти клеточного зародыша. Такие составные зародыши развиваются in vitro до стадии бластоцисты, после чего их вводят в матку приемной матери, у которой предварительно вызывают ложную беременность путем введения соответствующих гормонов. В результате получаются аллофенные мышата. Когда у мышонка появляется шерсть, окраска у него оказывается не белой или черной, как у родителей, а смешанной, с чередующимися черными и белыми пятнами или полосами. Это доказывает, что ткани животных-химер мозаичны, т.е. состоят из "белых" и "черных" клеток.
Внутренние ткани таких животных, естественно, также мозаичны, хотя это проявляется не так очевидно, как в случае окраски шерсти. Различия могут касаться белков, выполняющих ферментативную функцию: они могут катализировать одни и те же реакции у мышей-родителей, нуждаться в одних и тех же кофакторах, но при этом быть не идентичными, хотя и сходными. Такие белки называются изоферментами, и их можно разделить с помощью электрофореза. Агрегационные химеры можно получать не только между двумя эмбрионами, но и между различным числом изолированных бластомеров или отдельными частями эмбрионов. Масса химерных эмбрионов не больше обычной и подвержена действию механизмов эмбриональной регуляции. Преимущество метода - не требует вмешательства микрохирургической техники, поэтому широко используется в эмбриогенетике.
2. Инъекционный- был разработан Р. Гарднером в 1968 г.
Используются эмбрионы на стадии бластоцисты. Бластоцисту фиксируют и, используя микроманипуляторы, вводят путем инъекции клетки внутриклеточной массы бластоцисты доноров в бластоцель эмбриона - рецепиента. Этим методом можно инъецировать не только внутриклеточную массу ранних эмбрионов, но и более дифференцированные клетки.
Инъекционный метод нашел применение при получении межвидовых химер. Первые межвидовые химеры были получены между двумя ближайшими видами мышей, которые обычно не скрещиваются: M. muskulus и M. caroli. Причем было отмечено, что химерные эмбрионы, полученные инъекционным методом, нормально развивались только при пересадке их в матку того вида, чья бластоциста была использована в качестве рецепиента. Например, в бластоцисту M. muskulus вводили внутриклеточную массу эмбриона M. caroli. Полученные химеры имплантировались в матку M. muskulus и благополучно развивались там, а в организме M. caroli погибали спустя две недели.
Межвидовые химерные зародыши между мышью и крысой путем агрегации были получены только в 70-х годах. Первые химерные животные были получены только в 1973 году Р. Гарднером и М. Джонсоном. Успех этих экспериментов позволил приступить в 80-х годах к созданию химерных сельскохозяйственных животных. Выяснилось, что агрегационный метод неприемлем для получения химер крупного рогатого скота. Химер телят Bos indicus + Bos taurus удалось получить только инъекционным методом.
В 1984 году были получены межвидовые химеры между овцой и козой - овцекозы, причем практически одновременно в Англии и ФРГ. Использовались оба метода. Половым путем овцы и козы не скрещиваются, так как имеют разный набор хромосом: коза 2n = 60, овца 2n = 54. В ФРГ в 1985 году были получены химерные телята после агрегации половинок 32-клеточных эмбрионов от коров швицкой (бурой) и голштино - фризской пород. В фенотипе химер сочетались обе масти - бурая и черно - пестрая.
Химерные животные не передают потомкам генетическую мозаичность. У них происходит расщепление, как у гетерозигот, поэтому ценные генетические комбинации нарушаются. Но на протяжении 1 поколения хозяйственно ценные признаки поддерживаются, поэтому можно, например, сочетать как молочную, так и мясную продуктивность.
Химерность довольно часто встречается и у растений. Как правило, она существует в скрытом виде, не проявляясь фенотипически. Однако пластидные мутации позволяют увидеть ее непосредственно на растении. Чаще всего спонтанная химерность наблюдается у гетерозиготных растений. Различные клеточные типы четко разделены в пространстве, образуя отдельные слои при делении апикальных меристем. Примером видимой мутации хлоропластов и образования химерного растения является пестролистность или появление секторов ткани другого цвета.
Механизм слияния клеток
Для индукции слияния клеток используются вещества различной природы. Ионы Са2+, полиэтиленгликоль, лизолецитин, моноолеат глицерина, вирус Сендай. Лизолецитин - поверхностно-активное вещество липидной природы, продукт деградации лецитина путем обработки последнего фосфолипазой А. Лизолецитин повреждает мембраны и токсичен для живых систем. Цитотоксический эффект этого вещества можно уменьшить снижая его концентрацию или добавляя во время обработки альбумин. Моноолеат глицерина также соединение липидной природы, но его повреждающее действие менее выражено, а частота слияния клеток при применении этого вещества возрастает в 4-7 раз по сравнению со спонтанным процессом. К другим агглютинирующим агентам, способность которых вызывать слияние клеток, была исследована специально, относятся лектины растений и антитела. Преимущество вируса Сендай как сливающего агента заключается в полном отсутствии цитотоксического эффекта. Вирус перед употреблением инактивируют, облучая ультрафиолетовой лампой в течение 5 минут, при этом он теряет способность к размножению, но сохраняет способность сливать клетки. Вирус Сендей имеет два недостатка: - необходимость наращивать, титровать, концентрировать и инактивировать вирус; - клетки растений и грибов не имеют рецепторов к этому вирусу, поэтому он неприменим для их гибридизации. Первый этап слияния (рис. 2) - сближение мембран соседних клеток и установление между ними тесного контакта. Мембраны должны быть приближены друг к другу на расстояние в несколько ангстрем так, чтобы между ними стали возможны взаимодействия, подобные гидрофобным связям. Вызывают подобное сближение агенты, индуцирующие агглютинацию клеток. Миксовирусы, например, вирус Сендай, наряду с другими вирусами, которые не обусловливают слияния, прежде всего вызывают агглютинацию клеток, т.е. достаточно тесное их сближение, необходимое для успешного последующего слияния. Полиэтиленгликоль также вызывает агрегацию клеток, хотя механизм действия его неизвестен. Возможно, благодаря тому, что в водном растворе ПЭГ несет небольшой отрицательный заряд, молекулы этого размера достаточно велики, чтобы между клетками возникали электростатические связи. Подтверждением этой гипотезы является усиление агглютинации клеток, вызываемой ПЭГ: двухвалентные ионы, по-видимому, образуют мостики между ПЭГ и отрицательно заряженными углеводами, находящимися на клеточной поверхности. Согласно другой гипотезе, протопласты сливаются в результате дегидратации. Поглощение воды индуцирует образование пор на поверхности мембраны и происходит перетекание внутриклеточного материала. После слияния участки с порами сохраняются некоторое время. Существует два предположения, объясняющие возникновение пор : 1. При высокой концентрации ПЭГ (20 - 30%) вся свободная вода поглощается им, вызывая разрывы в мембране; 2. ПЭГ уменьшает полярность воды, что вызывает перераспределение полярных и гидрофобных компонентов мембраны, стабилизирующих липидные слои. С особым успехом для этих целей используется ПЭГ с молекулярным весом от 1500 до 7500.
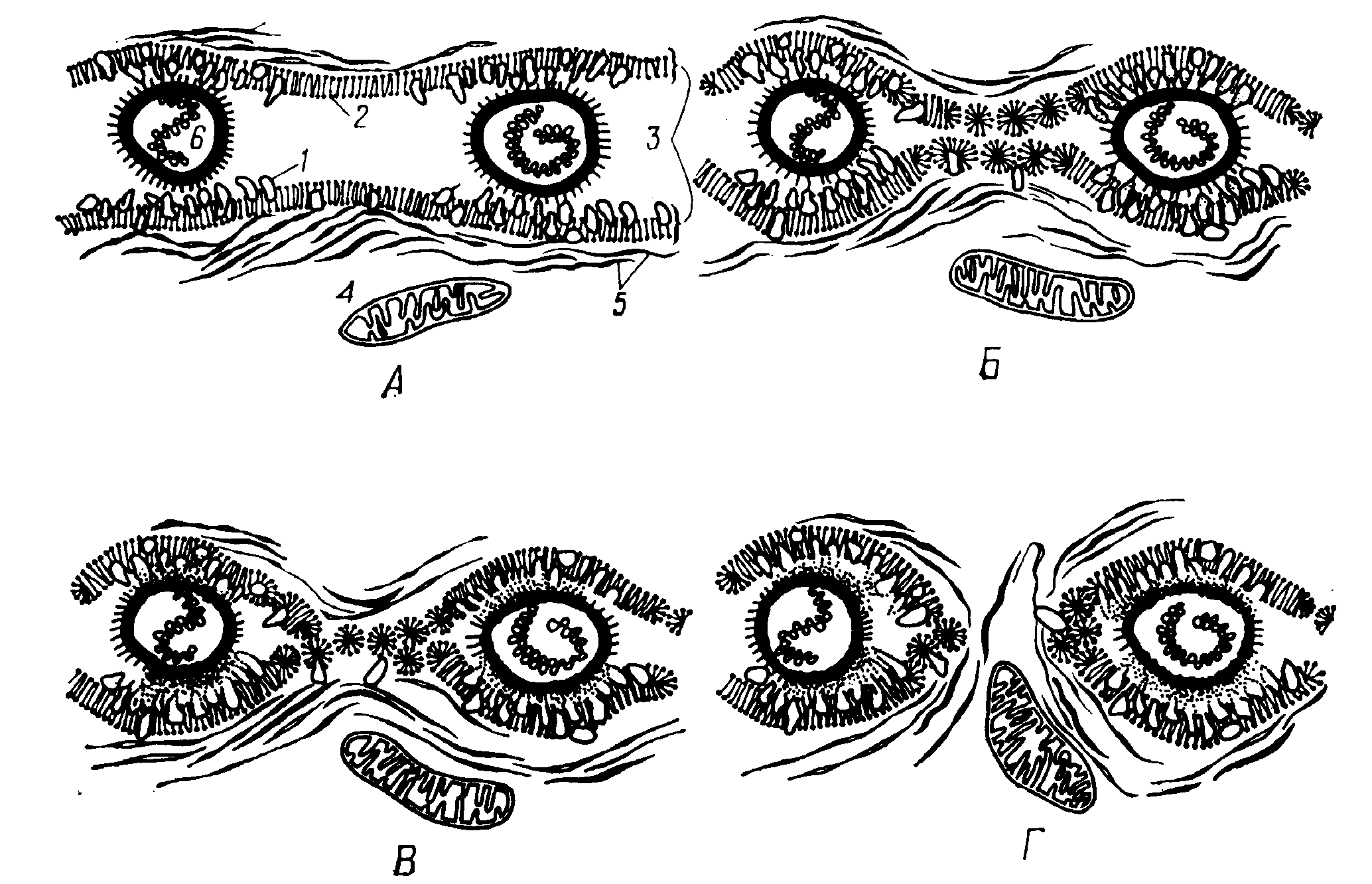
Рис. 2. Этапы слияния клеток (по Н. Рингертцу, Р. Сэвиджу, 1979):
А - 1-й этап, сближение цитоплазматических мембран: 1- гликопротеиды, 2 – липиды, 3 – плазматические мембраны, 4 – митохондрии, 5 – микрофиламенты, 6 – частицы вируса Сендай; Б - 2-й этап, выход гликопротеидов и обнажение липидных слоев мембраны; В - 3-й этап, образование мицелл; Г - начало 4-го этапа, слияние мембран, образование цитоплазматических мостиков.
Лектины и антитела - двух- или поливалентные соединения, и их агглютинирующая функция связана со способностью одной молекулы какого-либо из этих соединений взаимодействовать с рецепторами, находящимися на поверхности двух клеток, что и приводит к образованию связи между клетками. Достаточное количество таких молекулярных связей может удерживать клетки вместе, препятствуя их расхождению либо в результате броуновского движения, либо в результате электростатического отталкивания, либо в результате активной миграции клеток. На втором этапе гликопротеиды, расположенные на поверхности, начинают высвобождаться из участков мембраны, лежащих между вирионами, и притягиваются к местам прикрепления вирусных частиц. Углеводные компоненты - наименее изученная часть клеточной поверхности. В мембранах они встречаются в виде нейтральных сахаров, а также ковалентно связываются с липидами или белками. Именно в таком виде они активно участвуют во многих биологических процессах. Установлено, что гликопротеиды определяют антигенную специфичность клеток, несут отрицательный заряд, характерный для клеток при физиологически нейтральных рН, принимают участие в распознавании и адгезии клеток, определяют рецепторные участки для вирусов, бактерий, агглютинирующих агентов, принимают участие в процессе регуляции проницаемости мембран для ионов. Эти свойства и определяют их участие в слиянии клеток. Углеводы препятствуют слиянию клеток, так как разделяют липидные слои мембран, не давая им соприкасаться, так как на поверхности нормальной клетки рецепторные участки расположены редко или поодиночке. В результате трансформации вирусом происходит их объединение в группы. Гликопротеиды мигрируют в мембране к месту адсорбции вируса, оставляя свободными соседние участки, где и происходит слияние клеток. В некоторых случаях в удалении углеводных групп, препятствующих слиянию клеток, принимают участие лизосомные ферменты. При этом происходит соединение лизосом или пузырьков АГ с плазматической мембраной, и локальное высвобождение гликозидаз. Такая лизосомная активность может быть запрограммирована (в гаметах, миобластах, макрофагах, т.е. клетках, сливающихся в естественных условиях) или вызвана экспериментально при индуцированном слиянии клеток. Третий этап - мицелизация обнажившихся липидов двух противолежащих мембран. Мицеллы - липидные капли, где молекулы липидов гидрофильными головками обращены к воде, а гидрофобные “хвосты” жирных кислот спрятаны внутрь. Этот процесс усиливается при высоких значениях рН и высокой концентрации ионов кальция. В обеих клетках начинается эндоцитоз вирусных частиц. Четвертый этап - слияние мембран. Благодаря мостикам, образуемым Са2+, размер мицелл уменьшается. Под действием АТФ и Са2+, активизируются микрофиламенты. Возникший цитоплазматический мостик стабилизируется и расширяется благодаря функционированию микрофиламентов. На последних этапах слияния клеток важную роль играет наличие АТФ. АТФ образуется благодаря деятельности митохондрий. Поликарионы, образующиеся при слиянии двух или трех клеток, представляют собой не бесформенные раздутые или двулопастные шары цитоплазмы, а принимают форму, характерную для одной из родительских клеток или промежуточную между ними. Форму клетки определяют микротрубочки и микрофиламенты. В процессе слияния клеток микрофиламенты актиномиозинового типа, расположенные под цитоплазматической мембраной, принимают непосредственное участие, так как обеспечивают объединение цитоплазм слившихся клеток и стабилизацию вновь образованной системы. Однако, формирование цитоскелета - энергозависимый процесс, требующий большого количества АТФ. Видимо, этим обусловлено присутствие митохондрий в местах слияния клеточных мембран.
