
RUBEZhNOE_4
.doc
РУБЕЖНОЕ ТЕСТИРОВАНИЕ №2 вар.0
1. Рассчитайте молярность и моляльность 25% раствора хлорида кальция, плотность которого 1,19 г/мл.
МОЛЯ́РНОСТЬ раствора, концентрация раствора, характеризуемая числом молей растворенного вещества в 1 л раствора.
Берем 1 л такого раствора. Его масса равна 1000*1.19=1190 г. В нем содержится 25% СаCl2 т.е.
1190*0.25 =298 г СаCl2. Молекулярная масса СаCl2 = 40+35.5*2=111 Делим 298 на 111 и получаем 3
Молярность раствора = 3. Молярность - 3 моль/литр или 3 М
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется в молях на кг.
![]() ,
,
где:
-
ν — количество растворённого вещества, моль;
-
m2 — масса растворителя, кг.
Берем 1 л такого раствора. Его масса равна 1000*1.19=1190 г. В нем содержится 25% СаCl2 т.е.
1190*0.25 =298 г СаCl2. Молекулярная масса СаCl2 = 40+35.5*2=111 Делим 298 на 111 и получаем 3
То есть в литре такого раствора содержится 3 моля растворенного вещества СаCl2 а воды (растворителя) 1190 г-298 г=892 г воды.
3 моль СаCl2 - 892 г растворителя
Х моль СаCl2 - 1000 г растворителя
Х = 1000*3/892 =4 m Моляльность равна 4 m
2. Какой объем 3н раствора карбоната натрия надо взять для приготовления 2 л 0,25 М раствора?
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора. Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода. Эоснования = Моснования / число замещаемых в реакции гидроксильных групп Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд
МОЛЯ́РНОСТЬ раствора, концентрация раствора, характеризуемая числом молей растворенного вещества в 1 л раствора.
Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе (Например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации. Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором. Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации. Для пересчета из одной концентрации в другую можно использовать формулы:
M = (N · Э) / m N = (M · m) / Э
Молекулярная масса Na2CO3 = 23*2+12+16*3=106
Э Na2CO3 = 106/2*1=53
2 – число катионов Na+
1 – это заряд
Молярная концентрация 3 н. Na2CO3
M = (3· 53) / 106 = 2 M.
2 л 0,25 М раствора содержат 106*0,25*2= 53 г Na2CO3
2 М раствор Na2CO3 содержит 106*2=212 г Na2CO3 в 1 литре раствора
53 г Na2CO3 содержатся в Х литре 2 М раствора
Х=53*1/212= 0,25 л
То есть, для приготовления 2 л 0,25 М нужно взять 250 мл 3 н. раствора Na2CO3
3. Какова энтальпия образования PbO, если при взаимодействии 6,21 г Pb
с кислородом выделяется 6,57 кДж.
Pb
+ ½ О2
= PbО
![]() =х
=х
![]()
![]()
Молекулярная масса Pb = 207
Если при взаимодействии 6,21 г Pb с кислородом выделяется 6,57 кДж, то энтальпия образования PbО будет равна х= 6,57*207/6,21= 219 кДж/моль
Pb
+ ½ О2
= PbО
![]() =
- 219 кДж/моль
=
- 219 кДж/моль



4. Не производя вычислений, установите знак S следующих процессов:
а) 2 NH3(г) N2(г) + 3 H2(г) б) CO2(г) CO2 (тв)


а) 2 NH3(г) N2(г) + 3 H2(г) S>0 б) CO2(г) CO2 (тв)S<0
5. Напишите уравнения для определения скоростей следующих реакций
а) А(г) + 2В(г) АВ2 б) А(тв) + 2В(г) АВ2
Как изменятся скорости этих реакций при увеличении давления в 3 раза?


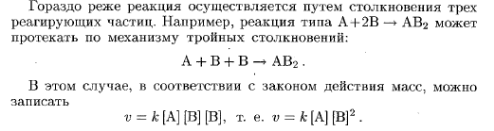
а)
А(г)
+ 2В(г)
АВ2
ОТВЕТ:
![]()
б)
А(тв)
+ 2В(г)
АВ2 ОТВЕТ:
![]() *
*
![]() ,
так как А – твердое вещество и скорость
реакции будет зависеть только от
концентрации В
,
так как А – твердое вещество и скорость
реакции будет зависеть только от
концентрации В
При увеличении давления в 3 раза концентрация реагирующих веществ возрастет в 3 раза, следовательно
а)
до изменения объема скорость реакции
выражалась уравнением
![]() ,
вследствие уменьшения объема концентрация
каждого из реагирующих веществ возрастает
в 3 раза, Следовательно, теперь
,
вследствие уменьшения объема концентрация
каждого из реагирующих веществ возрастает
в 3 раза, Следовательно, теперь
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Сравнивая выражения
для
![]() находим,
что скорость реакции возрастет в 27
раз.
находим,
что скорость реакции возрастет в 27
раз.
б) В случае б) ύ = k (3[B])2 = 9 k [B]2 скорость возрастет в 9 раз.
6. Напишите выражения Кравн для реакций
2 H2O(г) ↔ 2 H2 + O2 Н0р > 0
CaO(тв) + H2O(ж) ↔ Ca(OH)2(ж) Н0р < 0
Укажите, куда сместится равновесие в вышеприведённых реакциях при:
а) увеличении давления б) охлаждении

В тексте опечатка перед словом ОТСЮДА должна быть еще буква D в квадратной скобке


-
2 H2O(г) ↔ 2 H2 + O2 Н0р > 0
Кравн = [H2]2*[O2]/ [H2 O]2
равновесие сместится при:
а) увеличении давления исходя из принципа Ле Шателье равновесие сместится
в сторону исходных веществ, потому что в исходном уравнении 2 молей газа, а в продуктах реакции три.
б) охлаждении
2 H2O(г) ↔ 2 H2 + O2 Н0р > 0 реакция идет с поглощением тепла
При охлаждении равновесие сместиться в сторону исходных веществ.
б) CaO(тв) + H2O(ж) ↔ Ca(OH)2(ж)
Кравн = [Ca(OH)2]/ [H2 O]2
равновесие сместится при:
а) увеличении давления исходя из принципа Ле Шателье система останется в равновесии, потому что и в левой и правой части реакции по 1 молю жид.веществ. Твердые во внимание не принимаются.
б) охлаждении
CaO(тв) + H2O(ж) ↔ Ca(OH)2(ж) Н0р < 0
реакция идет с выделением тепла
При охлаждении равновесие сместиться в сторону продуктов реакции.
7. Напишите в ионно-молекулярной форме уравнения реакций:
карбонат калия + соляная кислота
хлорид аммония + гидроксид кальция
сульфат цинка + избыток гидроксида калия
Укажите, какие из этих реакций протекают практически необратимо и почему.

Дата на фото странная. Фотик д. Ромы. Он торопится жить.
8. Не производя расчётов, ответьте на поставленный вопрос
Даны два раствора одинаковой молярной концентрации: селеноводородной и сероводородной кислот. рН этих растворов:
а) одинаковы б) рН(H2Se) > pH(H2S) в) рН(H2Se) < pH(H2S) Ответ обосновать.
Правильным является выражение в) рН(H2Se) < pH(H2S)
Сера и селен являются элементами главной подгруппы VI группы. У их атомов на внешнем энергетическом уровне находится по 6 электронов: ns2np4. Следовательно, в соединениях с водородом они проявляют степень окисления – 2. С ростом порядкового номера элемента увеличивается радиус атома, что обусловливает уменьшение прочности соединения с водородом,
увеличиваются кислотные свойства.
9. Рассчитайте рН 10-2М раствора HCl и 10-2М раствора NH4OH
Сначала рассчитаем рН 10-2 М раствора HCl Соляная кислота – это сильная кислота, степень диссоциации почти равна 1
рН= - lg (10-2)= - (-2)= 2 рН 10-2М раствора HCl равно 2.
Рассчитаем рН 10-2М раствора NH4OH

Запишем уравнение диссоциации гидроксида аммония:
NH4OH<=> NH4+ + OH –
Используя справочные данные константы диссоциации, найдем степень диссоциации
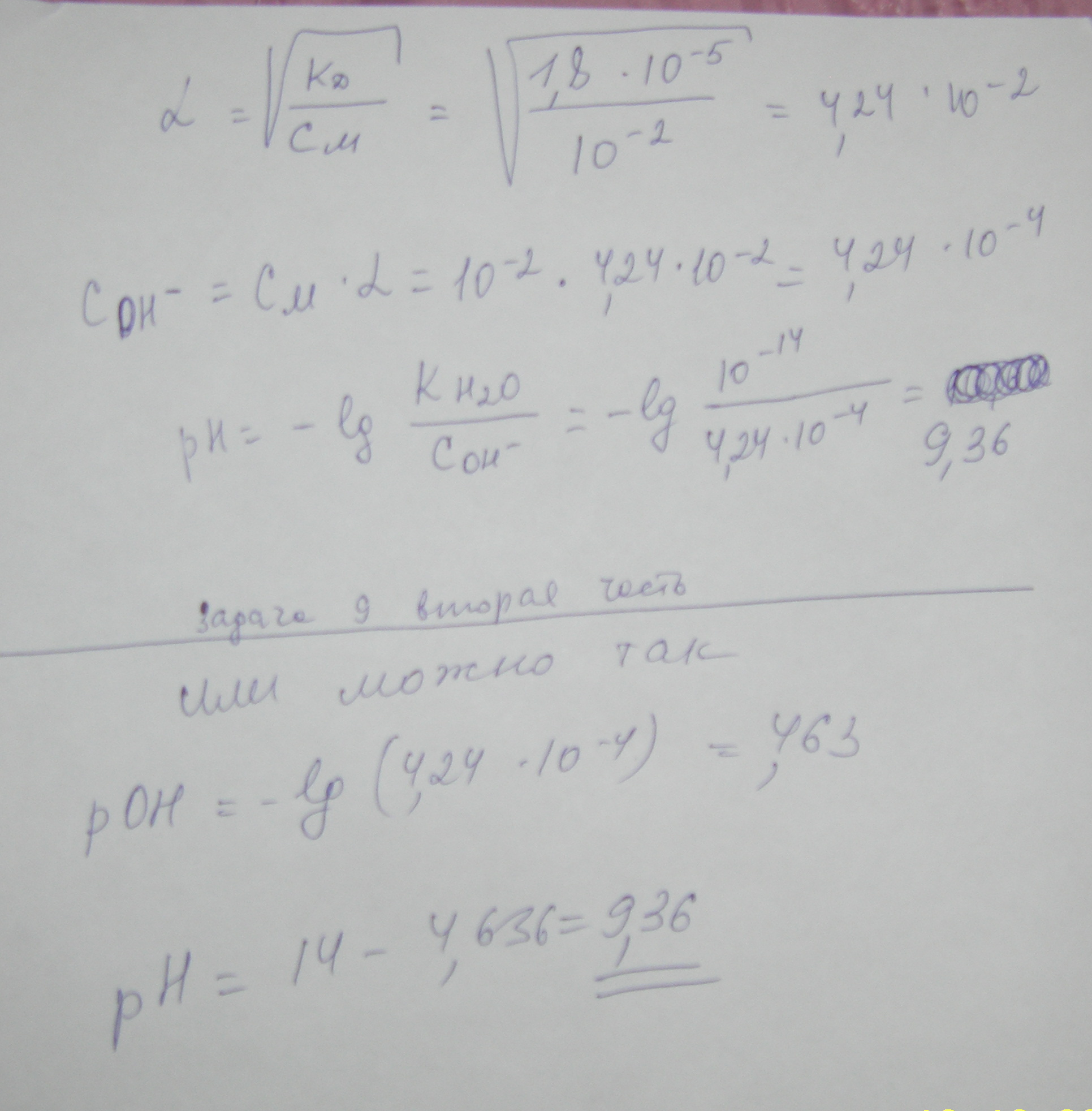
10. Какую среду имеют водные растворы сульфата натрия, сульфата железа (II), фосфата рубидия?
Ответ подтвердите ионно-молекулярными уравнениями гидролиза этих солей.
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Сульфат натрия Na2 SO4 – соль, образованная сильным основанием NaOH и сильной кислотой
H2 SO4. Такие соли гидролизу не подвергаются, рН водного раствора =7.
Сульфат железа (II) - соль, образованная слабым основанием и сильной кислотой (FeSO4) гидролизу подвергается катион:
2Fe SO4 + 2HOH =>[Fe(OH)] 2 SO4 + H2 SO4 2Fe2+ + 2SO4 2- + 2H+ + 2OH- => 2Fe(OH)+ + SO4 2- + 2Н+ + SO4 2-
2Fe2+ + 2H+ + 2OH- => 2FeOH+ + 2Н+
В результате гидролиза образуется слабый электролит, ион Н+ и другие ионы.
рН раствора < 7 ( раствор приобретает кислую реакцию).
1-ая ступень 2Fe SO4 + 2HOH =>[Fe(OH)] 2 SO4 + H2 SO4 2Fe2+ + 2SO4 2- + 2H+ + 2OH- => 2Fe(OH)+ + SO4 2- + 2Н+ + SO4 2-
2-ая ступень [Fe(OH)] 2 SO4 + HOH =>Fe(OH)2 + H2 SO4 2Fe(OH)+ + SO4 2- + H+ + OH- =>Fe(ОН)2 + 2Н+ + SO4 2-
В действительности по второй ступени реакция не пойдет из-за образующегося избытка ионов водорода сильной серной кислоты.
Фосфат рубидия - Rb3PO4 это соль сильного основания (щелочи) RbOH и средней кислоты (фосфорной) H3PO4. Гидролиз соли идет по анионному типу, т.к. катион Rb+, связываясь с гидроксил-анионом OH¯, образует сильный электролит RbOH, который диссоциирует на ионы. Фосфорная трехосновная кислота образует три вида солей: RbH2PO4 –первичный фосфат Rb, хорошо растворимый Rb2HPO4 – вторичный фосфат Rb, практически нерастворимый Rb3PO4- третичный фосфат Rb, практически нерастворимый. Из этого ясно, что при гидролизе Rb3PO4, т.е. реакции, идущей до образования слабодиссоциирующей (плохорастворимой) соли, будет образовываться вторичный фосфат натрия Rb2HPO4. 1 ступень Ионно-молекулярное уравнение PO4¯³ + H2O ↔ HPO4¯² + OH¯ Молекулярное уравнение: Rb3PO4 + H2O ↔ Rb2HPO4 + RbOH 2 ступень Ионно-молекулярное уравнение Rb2HPO4 + H2O↔ H2PO4¯² +OH¯ Молекулярное уравнение Rb2HPO4 + H2O↔ RbH2PO4 + RbOH 3 ступень Ионно-молекулярное уравнение H2PO4¯+ H2O = H3PO4 + OH¯ Молекулярное уравнение RbH2PO4 + H2O = H3PO4 + RbOH Обычно реакция идет по первой ступени, далее накапливаются гидроксильные ионы OH¯ и не дают реакции идти до конца. Так как образуется кислая соль и сильное основание (щелочь), реакция раствора будет щелочная, т.е. pH>7.
11. Напишите краткое ионно-молекулярное уравнение гидролиза сульфита натрия, рассчитайте степень гидролиза (в %) и определите рН 10-2 М раствора этой соли.
Na2SО3 – сульфит натрия соль, образованная сильным основанием NaOH и слабой кислотой H2SО3. Гидролиз протекает по анионному типу и включает две ступени:
1-ая ступень Nа2SО3 + HOH =>NаНSО3 + NаОН SО32- + 2Na+ + H+ + OH- =>НSО3- + ОН- + 2Na+
2-ая ступень NаНSО3 + Н2О =>NаОН + Н2SО3 НSО3- + Na+ + H+ + OH- =>Н2SО3 + ОН- + Na+
в сокращенной ионной форме уравнение
гидролиза запишется следующим
образом:
SО32-
+ Н2О
↔ НSО3-
+ ОН-
 Константа
гидролиза Кг рассчитывается с
использованием справочных данных по
формуле:
Константа
гидролиза Кг рассчитывается с
использованием справочных данных по
формуле:
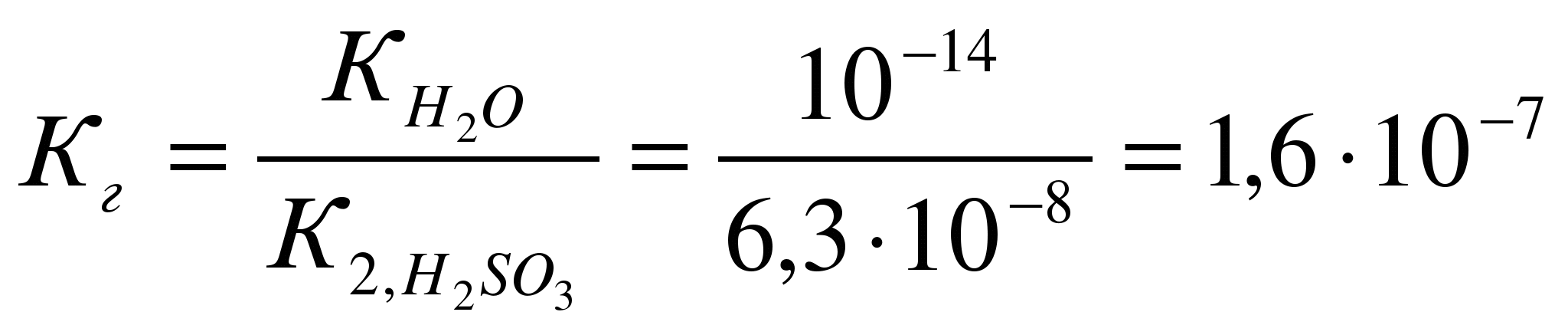 В
соответствии с уравнением реакции
В
соответствии с уравнением реакции
![]() можно
выразить через равновесные концентрации
ионов:
можно
выразить через равновесные концентрации
ионов:
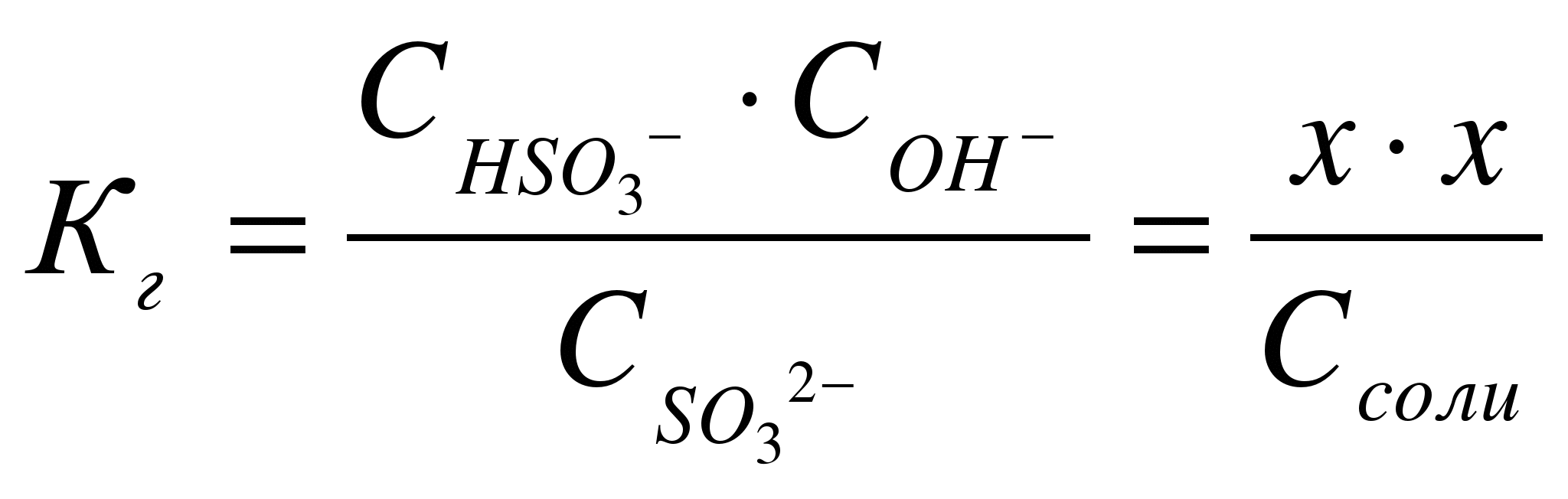 ;
отсюда
;
отсюда
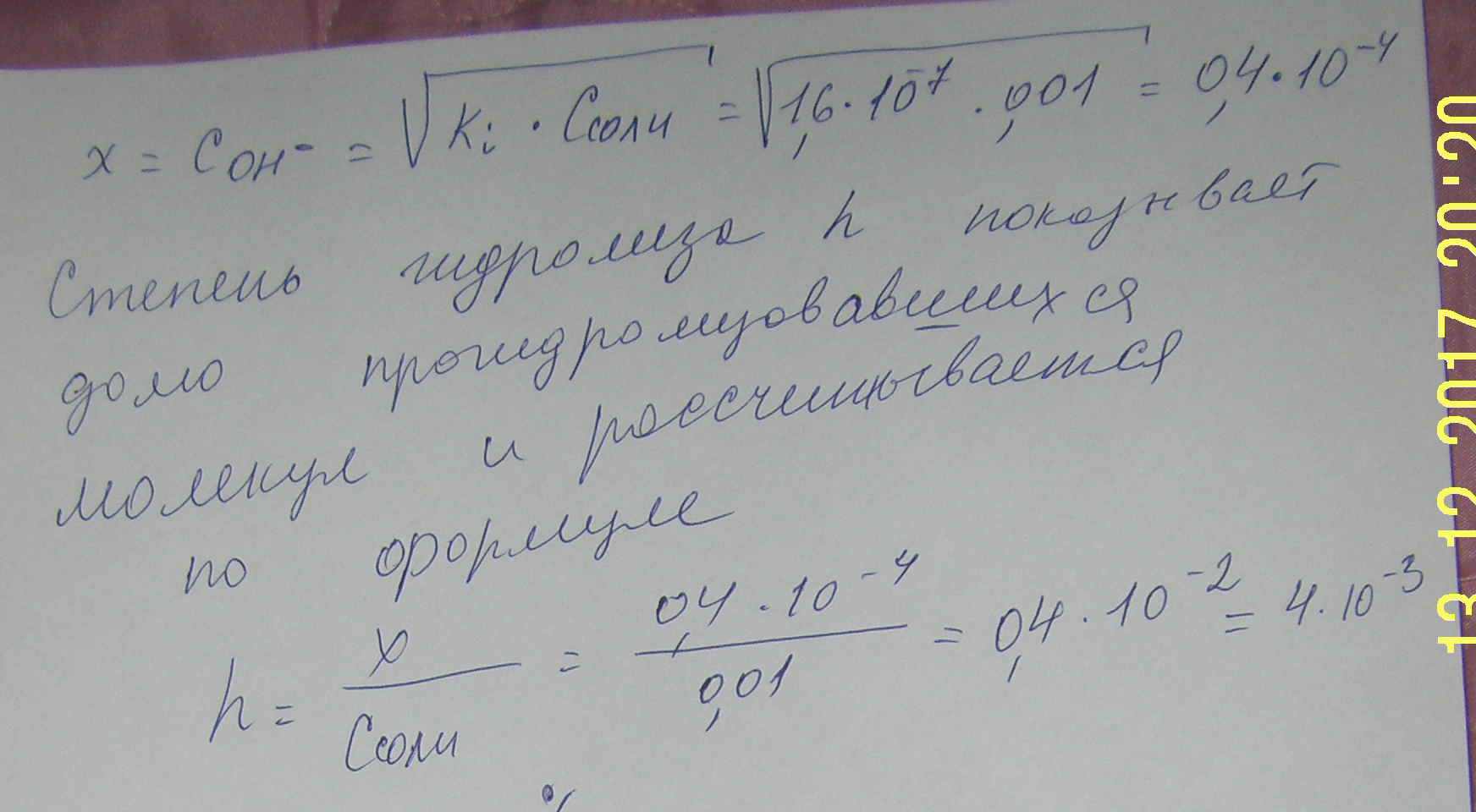
или 0,4% - степень гидролиза
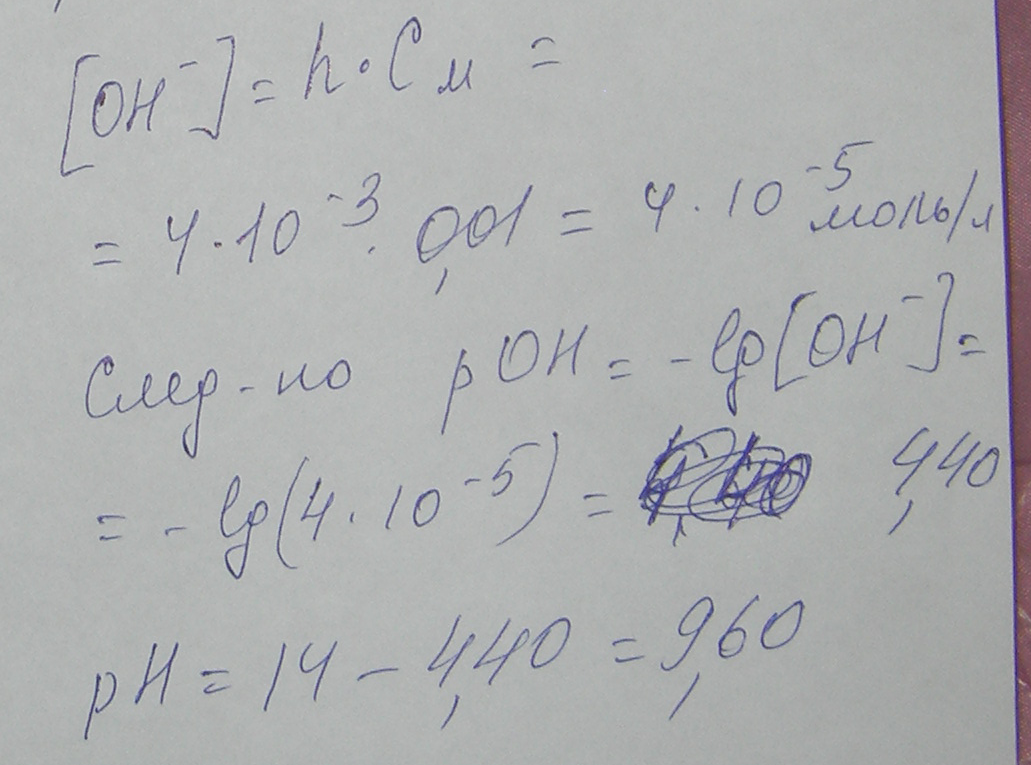
12. Выпадет ли осадок при сливании 700 мл 10-2 М раствора Pb(NO3)2 и 300 мл 10-4 М раствора KI? Ответ подтвердите расчетами.

Pb(NO3)2 + 2KI= Pb I2+ 2K NO3
Произведение растворимости иодида свинца = 8*10-9
Найдем молекулярную массу М (Pb(NO3)2 )= 207+14*2+16*3*2=331 г пренебречь
М (KI )= 39+127=166 г
Рассчитаем сколько Pb(NO3)2 находится в 700 мл 10-2 М раствора
Задача написана карандашом
13. Определите объем воды, необходимый для растворения при 250С 2 г сульфата бария.

Произведение растворимости сульфата бария = 1,1*10-10
То есть для растворения 1,1*10-10 требуется 100 г воды, а для растворения 2 г
2*100/1,1*10-10 =181,82*1010 г воды или 1,82 *109 кг. Так как плотность воды =1, то объем воды также равен 1,82 *109 литров.
14. При растворении 5,0 г неэлектролита в 200 г воды раствор замерзает при -1,453оС.
Ккр воды = 1,86. Рассчитайте молярную массу неэлектролита.

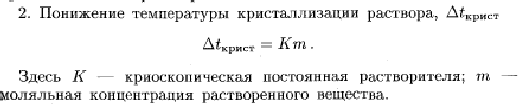
Из условия задачи
находим:
![]() =
00
С – (-1,4530
С) = 1,453
=
00
С – (-1,4530
С) = 1,453
Из уравнения
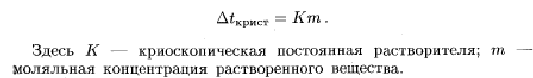
Определяем моляльность раствора:
1,453=1,86*m m=1,453/1,86=0,781 моль на 1000 г воды.
Из условия задачи следует, что 5,0 г неэлектролита растворено в 200 г воды.
Так как мы имеем растворителя в 5 раза меньше, количество молей будет равно
0,781/5=0,156 моль.
Масса 5 г соответствует 0,156 моль, мольную массу найдем из соотношения:
М = 5 / 0,156=32,05 г/моль
Молекулярная масса растворенного вещества равна 32
