
Malashonok_Neorganicheskaya_himia
.pdfУчреждение образования «БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ»
Кафедра общей и неорганической химии
И. Е. Малашонок
Неорганическая химия
Конспект лекций
по одноименному курсу для студентов специальностей
1 – 48 01 02 – Химическая технология органических веществ, материалови изделий, 1 – 48 01 04 – Технология электрохимических производств
ЛЕКЦИИ 1 - 3
Тема: р - Элементы VII группы (галогены) 1. Общая характеристика элементов
VIIA группа: F (фтор), Cl (хлор), Br (бром), I (иод) и At (астат - радиоактивный элемент). Групповое название - галогены.
Полные электронные формулы атомов элементов VIIA группа (подчеркнуты
валентные электроны):
9F: 1s22s22р5;
17Cl: 1s22s22р63s23р5;
35Br: 1s22s22р63s23р64s24р5;
53I: 1s22s22р63s23р63d104s24р64d105s25р5.
Сокращенная электронная конфигурация ns2np5.
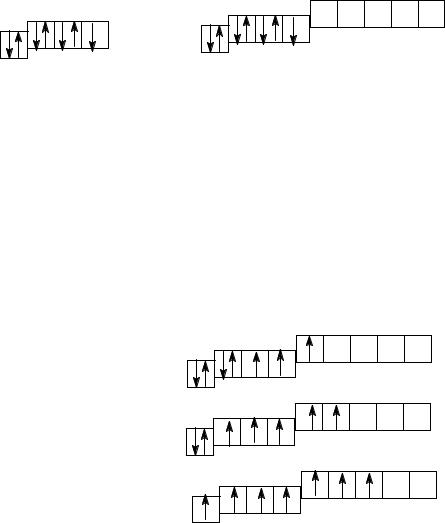
Электронно-графические схемы валентных электронов фтора и хлора в основном (невозбужденном) состоянии:
F |
|
Cl |
3d |
2s |
2p |
|
3p |
|
|
3s |
На внешнем электронном уровне атомов 7 электронов: три электронные пары и один неспаренный электрон.
Уфтора, элемента 2-го периода, нет d-подуровня. Поэтому отсутствует возможность распаривания электронных пар, находящихся на втором уровне. Характерная валентность для фтора: I. Так как фтор – самый электроотрицательный элемент, его степень окисления в соединениях c другими элементами может быть только -1.
Ухлора и других галогенов возможно возбуждение электронов и переход их на d-подуровни соответствующих энергетических уровней. Характерны нечетные валентности: I (в невозбужденном состоянии), III, V, VII (при распаривании электронных пар):
Валентность III |
Cl* |
3d |
|
|
3p |
|
|
3s |
Валентность V |
* |
3d |
Cl |
||
|
|
3p |
|
|
3s |
Валентность VII |
* |
3d |
Cl |
||
|
|
3p |
|
|
3s |
Основные характеристики галогенов представлены в таблицах 1, 2.
2

Таблица 1
Основные характеристики атомов галогенов
Характеристика |
F |
Cl |
Br |
I |
||
|
|
|
|
|
||
Электронная конфигурация |
…2 s22р5 |
…3 s23p5 |
…4 s24p5 |
…5 s25p5 |
||
|
|
|
|
|
||
Ковалентный радиус атома, нм |
0,064 |
0,099 |
0,114 |
0,133 |
||
|
|
|
|
|
|
|
|
|
|
|
увеличивается |
|
|
Первая |
энергия |
ионизации, |
1681 |
1251 |
1142 |
1008 |
кДж/моль |
|
|
|
|
|
|
|
|
|
уменьшается |
|
||
|
|
|
|
|
||
Сродство |
к |
электрону, |
|
|
|
|
кДж/моль |
|
|
–339,13 |
–355,88 |
–330,76 |
–301,67 |
Относительная электроотрица- |
4,0 |
3,1 |
2,9 |
2,6 |
||
тельность |
|
|
|
|
|
|
|
|
уменьшается, неметаллические свойства ос- |
||||
|
|
|
||||
|
|
|
|
лабляются |
|
|
При переходе от фтора к иоду значения радиусов увеличиваются, т.к. с увеличением числа электронных слоев увеличивается расстояние между электронами внешнего слоя и ядром атома.
Атомы галогенов расположены в периодической системе в конце каждого периода, являются самыми активными неметаллами в периоде, поэтому имеют большие значения энергии ионизации, сродства к электрону и электроотрицательности. Для фтора сродство к электрону меньше, чем для хлора. Это объясняется меньшими размерами атома фтора и большим межэлектронным расталкиванием в нем. При переходе сверху вниз неметаллические свойства галогенов ослабевают.
Наиболее резко увеличивается радиус и уменьшается энергия ионизации при переходе от фтора к хлору. Это связано с появлением на третьем энергетическом уровне d-подуровня.
|
|
|
|
|
Таблица 2 |
|
Сравнительная характеристика простых веществ |
|
|||||
|
|
|
|
|
|
|
Характеристика |
F2 |
|
Cl2 |
Br2 |
I2 |
|
Тип связи |
|
ковалентная неполярная |
|
|||
|
|
|
|
|
||
Тип кристаллической решетки |
|
|
молекулярная |
|
||
|
|
|
|
|
||
Агрегатное состояние |
|
газы |
жидкость |
твердое |
||
|
|
|
|
|
||
Длина связи в Г2, нм |
0,142 |
|
0,199 |
0,228 |
0,267 |
|
увеличивается, т.к. увеличивается радиус галогена |
||||||
|
||||||
|
|
|
|
|
|
|
Температура плавления, O С |
–220,6 |
|
–100,9 |
–7,2 |
113,5 |
|
|
|
увеличивается |
|
|||
|
|
|
|
|||
O |
–187,7 |
|
–34,2 |
58,8 |
184,5 |
|
Температура кипения, С |
|
|||||
|
|
увеличивается |
|
|||
|
|
|
|
|||
3
Атомы галогенов расположены в периодической системе в конце каждого периода и являются самыми активными неметаллами в периоде. Галогены имеют большие значения электроотрицательности. По группе с увеличением заряда ядра неметаллические свойства галогенов ослабевают.
Свойства простых веществ. Галогены — простые вещества состоят из
|
|
|
|
|
|
|
|
|
|
|
|
|
|
двухатомных молекул (Г2). В невозбужденном состоянии на |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
внешнем электронном уровне атомов присутствует по од- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
2p |
|
|
|
ному неспаренному электрону. Между атомами в молекуле |
||
|
|
2s |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
фтора оба атома предоставляют для образования ковалент- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
ной связи по одному неспаренному электрону (обменный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
механизм образования связи), и эти электроны становятся |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
общими для двух атомов фтора. Электронная пара, связываю- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
щая в молекуле два одинаковых атома, в равной мере принад- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лежит обоим атомам. В молекуле фтора образуется одна кова- |
|
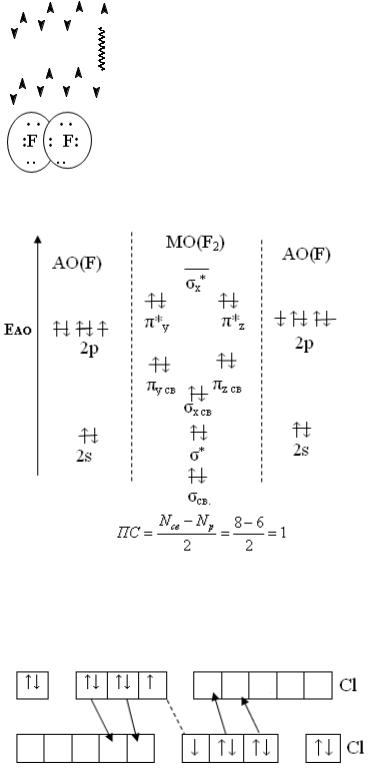
лентная неполярная связь. В соответствии с методом МО в молекуле фтора кратность связи также =1:
Строение молекулы F2 по ММО
В молекулах Cl2 , Br2 , I2 – образуется дополнительная дативная связь, за счёт спаренных p-электронов одного атома и вакантных d-орбиталей другого:
Самой прочной молекулой является молекула Cl2. Уменьшение энергии связи от Cl2 к I2 объясняется увеличением расстояний между атомами:
4

При обычных условиях F2 – зеленовато – жёлтый, трудно сжижаемый газ с резким запахом. Фтор крайне токсичен, при попадании а организм человека вызывает отёк лёгких, разрушение зубов, ногтей, ломкость кровеносных сосудов, повышает хрупкость костей.
Cl2 – также газ желто – зеленого цвета, но сжижается легко; Br2 – краснокоричневая густая жидкость со зловонным запахом, ядовит (единственный жидкий при обычных условиях неметалл). I2 – фиолетовые кристаллы. Для человека смертельная доза 2-3 г йода, но в форме иодид - ионов безвреден.
Увеличение tплавл. связано с тем, что с увеличением размера атома возрастает поляризуемость молекул и усиливается способность к межмолекулярному взаимодействию, а чем более прочная связь между молекулами, тем более высокая tплавл..
Между молекулами галогенов осуществляется слабое ван-дер-ваальсово взаимодействие, поэтому у простых веществ низкие температуры плавления и кипения. Внешние электронные оболочки атомов фтора и хлора находятся на более коротком расстоянии от ядра, чем внешние электронные оболочки атомов брома и иода. Чем ближе к ядру находится внешняя электронная оболочка, тем она более жесткая и менее склонна к деформации. Молекулы более тяжелых галогенов имеют более рыхлые электронные оболочки, которые в меньшей степени взаимодействуют с ядром. По этой причине между молекулами брома и иода межмолекулярное взаимодействие более сильное, чем между молекулами фтора и хлора.
Для твердого состояния галогенов характерна мо-
лекулярная кристаллическая решетка. Например, в уз-
лах кристаллической решетки иода находятся молеку-
лы I2 (рис.1).
При переходе от фтора к иоду значения радиусов
атомов увеличиваются, т.к. увеличивается число элек-
тронных слоев. Наиболее резкое увеличение радиусов
наблюдается при переходе от фтора к хлору. Это связано с появлением на третьем энергетическом
уровне d-подуровня.
Особые свойства фтора. Из всех галогенов у не-
го наименьший радиус. Относительная электроотрицательность равна 4, это самый электроотрицательный элемент, во всех соединениях имеет степень окисления – 1, остальные галогены от – 1 до + 7.
5
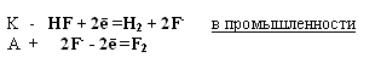
Исключительная химическая активность фтора обусловлена. с одной стороны, большой прочностью образуемых им связей, так, например, энергия связи H - F 566 кДж/моль, с другой стороны - низкой энергией связи в молекуле F2
– 151 кДж/моль. Большая энергия связей Э – F является следствием значительной электроотрицательности фтора и малого размера его атома.
Низкое значение энергии связи в молекуле F2, объясняется сильным отталкиванием электронных пар, находящихся на р- орбиталях, обусловленным малой длиной связи F – F. Благодаря малой энергии связи молекулы фтора легко диссоциируют на атомы, и энергия активации реакций с элементарным фтором
обычно невелика, поэтому процессы с участием F2 протекают очень быстро.
Нахождение в природе
F CaF2 - плавиковый шпат
Na3[AlF6] – криолит
Ca+25(PO4)-33F - фтораппатит
Cl NaCl - поваренная (каменная соль) KCl·NaClсильвинит
KCl·MgCl2·6H2O- карналит
Br в нефтяных скважинах I в морской воде
Способы получения
В промышленности F2 получаю только электролизом расплавов солей (в смеси с HF) KF·HF
Электроды из Ni, либо сплавов Ni с Fe, Mn, Cu, т. к. F2 очень активен и реагирует почти со всеми элементами. Ni устойчив в атмосфере фтора за счёт образования плёнки NiF2. Поэтому F2 хранят в баллонах, выполненных на ос-
нове сплавов никеля.
В лаборатории разложением фторидов:
CoF = CoF + ½F
3 2 2
Окислительная способность галогенов с увеличением заряда ядра уменьшается. Галогены, расположенные выше в подгруппе, вытесняют из галогенидов расположенные ниже галогены. Бром и иод получают из бромидов и иодидов вытеснением хлором:
2KBr + Cl2 → 2KCl + Br2;
2KI + Br2 → 2KBr + I2.
Получение хлора
Способы получения |
Реакции |
6

В промышленности |
|
|
|
|
|
|
|
|
|
|||
1) |
Электролиз |
раствора |
|
|
|
|
|
|
|
|
|
|
2NaCl + 2H2O 2NaOH + H2- + Cl2- |
||||||||||||
хлорида натрия |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||
2) |
Электролиз |
расплава |
|
|
|
|
|
|
|
|
|
|
2NaCl 2Na + Cl2- |
||||||||||||
хлорида натрия |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||
В лаборатории |
|
|
|
|
|
|
|
|
|
|
||
Действие концентрированной |
16HCl + 2KMnO4 ® 5Cl2 + 2MnCl2 + 2KCl + 8H2O |
|||||||||||
соляной кислоты на окислите- |
4HCl + MnO2 ® Cl2 + MnCl2 + 2H2O |
|||||||||||
ли (KMnO4, MnO2, PbO2) |
||||||||||||
PbO2 + 4HCl → PbCl2 + Cl2 + 2H2O |
||||||||||||
|
|
|
||||||||||
|
|
|
2AuCl3 → 2Au + 3Cl2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Химические свойства хлора
Реагенты. Характерные реакции |
Примеры реакций |
|
С простыми веществами |
|
|
Cl2 – сильный окислитель. Окисляет металлы и |
|
|
неметаллы, превращаясь в устойчивый анион Cl-. |
|
|
1) С металлами |
t |
|
2Fe + 3Cl2 ¾® 2FeCl3 |
||
|
t |
|
2) С неметаллами. Хлор непосредственно не |
2P + 3Cl2(недост.) ¾® 2PCl3 |
|
t |
||
реагирует только с O2, N2, С |
2P + 5Cl2(изб.) ¾® 2PCl5 |
|
hν |
||
|
Н2 + Сl2 ¾¾® 2НCl |
|
3) С водородом реакция протекает на свету |
|
|
Со сложными веществами |
Cl2 + Н2О НClО + НCl |
|
1. С водой (реакция диспропорционирования) |
||
2. Со щелочами (реакция диспропорциониро- |
3Cl2 + 3Н2О НClО3 + 5НCl |
|
вания) |
Сl2 + 2KОН → KСlО + KСl + Н2О |
|
|
||
|
t |
|
|
3Сl2 + 6KОН ¾® KСlО3 + 5KСl |
|
3. С бромидами, иодидами |
+ 3Н2О |
|
Cl2 + 2KBr ® 2KCl + Br2 |
||
|
||
|
Cl2 + 2KI ® 2KCl + I2 |
При взаимодействии щелочи с I2 не образуется NaIO, образуется NaIO3:
6I2 + 12NaOH → 10NaI + 2NaIO3 + 6H2O
В ряду Cl2 – Br 2 – I 2 – металлические свойства усиливаются, что связано с увеличением размера атома. Поэтому I2, реагируя с концентрированной HNO3, образует катион I+, или присутствует в кислотном остатке в виде IO3-.
I2 + AgNO3 → AgI + INO3
I2 + 10HNO3 конц.→ 2HIO3 + 10NO2 + 4H2O
7
Фтор в реакциях проявляет только окислительные свойства. Фтор реа-
гирует со взрывом со всеми металлами и неметаллами, кроме O2, N2, Г2, при этом во всех соединениях с фтором элементы находятся в высшей степени окисления.
Например:
SiO2 + 2F2 → Si+4F4 + O2 (во фторе горит SiO2, H2O)
t = 0º – 90º Н2O + 2F2 → 2Н+F + O+2F2 (H2O + F2=HF + O2 (O3))
Фтор реагирует с металлами, неметаллами, щелочами, некоторыми сложными веществами:
2Au + 3F2 = 2AuF3
5P + 5F2 = 2PF5
3F2 + S → SF6
2NH3 + 3F2 = 6HF + N2
2F2 + 2NaOHP → 2NaF + OF2 + H2O
2F2 + 4NaOHК → 4NaF + O2 + 2H2O (O3)
F2 + Xe → XeF4
|
Галогеноводороды |
|||
Получение галогеноводородов. HF |
H2 + F2 – не проводится, т.к. про- |
|||
текает со взрывом. Получают реакцией замещения из фторидов |
||||
1)СaF2 + H2SO4 → CaSO4↓ + 2HF↑ |
||||
|
|
|
летуча |
|
|
|
t |
|
|
|
2)KHF2 → KF + HF |
|||
Получение хлороводорода |
||||
|
|
|
|
|
Способы получения |
|
|
Реакции |
|
В промышленности |
|
|
Н2 + Сl2 ¾¾® 2НCl |
|
1) Синтез из простых веществ |
|
|
|
|
|
|
|
hν |
|
2) Хлорирование углеводородов. НСl об- |
CH4 |
+ Cl2 ¾¾® CH3Cl + НСl |
|
|
|
|
|
hν |
|
разуется как побочный продукт |
|
|
|
|
В лаборатории |
|
|
|
|
1) Действие концентрированной серной |
NaCl(тверд.) + Н2SO4 (конц.) → NaНSO4 +НСl |
|
||
кислоты на твердые хлориды при нагрева- |
|
|||
нии |
|
BCl3 + H2O → H3BO3 + HCl↑ |
|
|
2)Гидролиз кислотных галогенидов |
|
|
||
|
|
|
|
|
В отличие от получения хлороводорода, HI и HBr нельзя получить реакциями обменного взаимодействия с концентрированной серной кислотой, поскольку восстановительные свойства бромоводорода и иодоводорода более яр-
8
ко выражены, протекает окислительно-восстановительная реакция. Окисли- |
|||||||
тельно-восстановительная реакция (ОВР) приводит к образованию различных |
|||||||
продуктов: |
|
|
|
|
|
|
|
|
2NaBr + 2H2SO4 → Br2 + SO2 + Na2SO4 + 2H2O |
|
|||||
|
8NaI + 5H2SO4 → 4I2 + H2S + 4Na2SO4 + 4H2O |
|
|||||
Поэтому HBr и HI получают гидролизом галогенидов фосфора. |
|
||||||
|
|
PBr5 + 4H2O → H3PO4 + 5HBr- |
|
||||
|
|
PBr3 + 3H2O → 3HBr↑+ H3PO3- |
|
||||
|
|
PI3 + 3H2O → H3PO3 + 3HI |
|
||||
При стандартных условиях галогеноводороды - газообразные вещества с |
|||||||
резким запахом, хорошо растворимые в воде. Водные растворы галогеноводо- |
|||||||
родов являются кислотами. |
|
|
|
|
|||
HF |
|
HCl |
|
HBr |
HI |
|
|
|
|
увеличивается длина связи |
|
|
|||
|
|
уменьшается энергия связи |
|
|
|||
|
|
возрастает сила кислот |
|
|
|||
В молекулах галогеноводородов образуется ковалентная полярная связь. |
|||||||
Общая электронная пара, за счет которой осуществляется связь, сильно смеще- |
|||||||
t, oC |
|
|
|
на в сторону галогена. Особенно |
|||
|
|
|
сильно |
происходит |
поляризация |
||
20 |
|
|
|
||||
|
|
|
связи в HF, что обусловлено самой |
||||
|
|
|
|
||||
-20 |
|
|
|
высокой |
электроотрицательностью |
||
-60 |
|
|
|
фтора. Вследствие этого между мо- |
|||
|
|
|
лекулами HF образуются прочные |
||||
|
|
|
|
||||
-100 |
|
|
|
водородные связи. Наличие водо- |
|||
-140 |
|
|
|
родных связей объясняет аномально |
|||
|
|
|
высокие температуры плавления и |
||||
HF |
HCl |
HBr |
HI |
||||
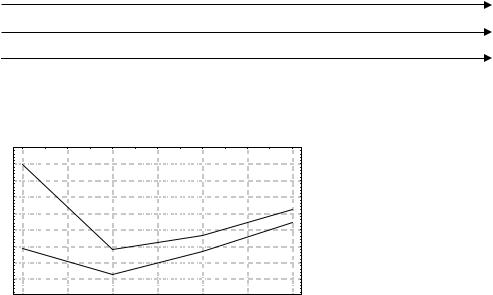
кипения фтороводорода (рис. 2). От |
|||||||
Рис. 2. Температуры плавления и ки- |
|||||||
НСl к HBr и HI температуры плав- |
|||||||
|
пения галогеноводородов |
|
ления и кипения монотонно увели- |
||||
|
|
|
|
||||
чиваются, так как с ростом массы и размеров молекул усиливается межмолеку- |
|||||||
лярное взаимодействие. |
|
|
|
|
|||
Безводный HF неэлектролит, а в жидком HF возможны процессы иониза- |
|||||||
ции.
2HF → H+ + HF2-
3HF → HF2- + H2F+
Жидкий HF образует целые цепочки, состоящие из молекул HF:- (HF)4, (HF)6, (HF)8, только при t = 3500ºС возможен разрыв связи H – F.
Вследствие наличия сильной водородной связи даже в парах молекулы HF ассоциированы. HF может смешиваться с Н2О в неограниченном количестве,
9

образуя слабую плавиковую кислоту, при этом между молекулами HF и Н2О также возникают водородные связи.
HF хранят в сосудах из платины или полиэтилена. В стеклянном сосуде хранить нельзя т. к. в стекле есть SiO2, а плавиковая кислота разрушает стекло.
SiO2 + 4HF = SiF4 + 2H2O – реакция травления стекла
В избытке плавиковой кислоты образуется гексафторокремниевая кислота.
SiF4 + 2HF = H2[SiF6]
Для HF характерны обычные свойства кислот
Zn + 2HF = ZnF2 +H2
3HF + Al(OH)3 = AlF3 +3H2O
2HF + KOH = KHF2 + H2O
NH3 +2HF = NH4HF2
Фториды – в основном нерастворимые соединения. Как и другие бинарные соединения они бывают различной природы.
Основные - галогениды металлов. Амфотерные - с амфотерными элементами. Кислотные - с неметаллами.
Галогениды могут реагировать между собой по кислотно-основному типу взаимодействия.
|
2KF +SiF4 → K2[SiF6] |
||
3NaF + AlF3 → Na3[AlF6] |
2KF + BeF2→ K2[BeF4] |
||
Oсн |
Kисл |
|
Oсн Kисл |
|
3SiF4 + 2AlF3 → Al2[SiF6]3 |
||
|
Kисл |
Oсн |
|
2KI + HgI 2→ K2[HgI4] |
KBr + AlBr3 → K[AlBr4] |
||
Кисл |
Осн |
|
|
Для элементов 2-го периода |
К.ч. = 4 |
|
|
|
3-го периода |
К.ч. = 6 |
|
Основные фториды гидролизуются, если они растворимы в воде:
10
