
Malashonok_Neorganicheskaya_himia
.pdfДва неспаренных электрона на π - разрыхляющих орбиталях обуславливают парамагнетизм молекулы кислорода.
O2 + 2 |
|
= O2−2 |
O2 + |
|
= O2− |
|
|||||||
e |
e |
|
|||||||||||
|
|
|
6 − 4 |
|
ПСO2− |
= |
|
6 − 3 |
= 1.5 |
|
|||
ПС −2 = |
= 1 |
|
|
|
|
||||||||
2 |
|
|
|||||||||||
|
|
|
|
|
|||||||||
O2 |
2 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
6 −1 |
|
|
|
|||||
|
|
|
|
|
ПС + |
= |
= 2.5 |
|
|||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
O2 |
|
2 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||||
Для молекулярных ионов: |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
О2+, |
О20, |
|
|
|
|
О2-, |
О2-2 |
||
ПС (кратность связи) 2,5 |
2 |
|
1,5 |
1 |
|||||||||
т.е. положительный молекулярный ион О2+ - самый прочный
При заполнении одной π·2pу орбитали образуются надпероксиды со свя-
зью, имеющей кратность 1,5.
О2 + ē → О2-
Na + O2 → Na+O2- надпероксид натрия
При заполнении обеих π*2p орбиталей происходит образование пероксидов с одинарной слабой связью О22-
2Na + O2 → Na2+O22- – пероксид натрия
После заполнения 2х π*2p и σ*2p орбиталей четырьмя электронами связи молекулы О2 разрываются и образуются оксиды со степенями окисления-2:
О2 + 4Na → 2Na2O оксид.
Химические свойства кислорода. Так как в молекуле кислорода довольно прочная двойная связь О=О, при обычных условиях кислород относительно неактивен. Активность его резко возрастает при повышении температуры. При нагревании кислород реагирует с большинством простых веществ. Исключение
– инертные газы, галогены, благородные металлы (Ag, Au, Pt).
Реакции с кислородом обычно сопровождаются выделением большого количества тепла и света. . Кислород во всех реакциях выполняет функцию окислителя. Горение – быстро протекающая химическая реакция, при которой происходит окисление веществ с выделением тепла и света. Вещества могут гореть не только в атмосфере кислорода, но и в хлоре, фторе и др.
В природе протекают также процессы медленного окисления веществ кислородом. К таким процессам относятся ржавление металлов, гниение, дыха-
ние.
Наиболее характерные реакции для кислорода:
Тип реакции |
Пример |
21
Тип реакции |
Пример |
|
Окисление всех металлов, кроме Ag, |
4Al + 3O2 = 2Al2O3; |
|
Au, Pt. Наиболее активные металлы об- |
3Fe + 2O2 = Fe3O4; |
|
разуют пероксиды (Na), смесь перокси- |
||
2Na + O2 = Na2O2; |
||
дов и надпероксидов (K, Rb, Cs) |
||
|
K + O2 = KO2 |
|
|
|
|
Окисление неметаллов, кроме галоге- |
S + O2 = SO2; |
|
нов и благородных газов |
4Р + 5О2 = 2Р2О5; |
|
|
||
|
С + О2 = СО2; |
|
|
2Н2 + О2 = 2Н2О. |
|
Окисление водородных соединений |
4NН3 + 3О2 = 2N2 + 6Н2О; |
|
металлов и неметаллов |
2Н2S + 3О2 = 2SО2 + 2Н2О |
|
|
||
|
СН4 + 2О2 = СО2 + 2Н2О. |
|
Окисление низших оксидов и гидро- |
4FeO + О2 = 2Fe2О3; |
|
ксидов поливалентных металлов и не- |
4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3 |
|
металлов |
||
4NO2 + О2 + 2Н2О = 4HNО3 |
||
|
||
Окисление сульфидов металлов |
2CuS + 3O2 = 2CuO + 2SO2; |
|
|
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 |
|
|
|
Озон – сильнейший окислитель, окислительная способность обусловлена нестойкостью его молекул, которые при обычной температуре распадаются с образованием атомарного кислорода, который активнее молекулы кислорода
О2, на этом и основано окислительное действие его.
O3 ↔ O2 + O H=-142 кДж/моль
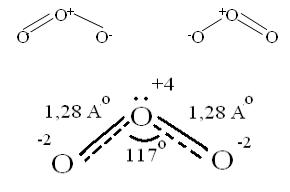
Окисляет почти все металлы, действуют на неметаллы, обесцвечивает красители, убивает микробы. При высоких концентрациях – яд. (Один кислород имеет с.о. равную +4).Молекула имеет угловое строение, существует в нескольких таутомерных формах. Наиболее распространенная форма указана ниже.
Связь трехцентровая ( центральный атом О+4 находится в sp2- гибридизации, связи его с двумя крайними атомами кислорода неравноценны, одна двойная, одна одинарная).
Две sp2- гибридные орбитали образуют σ-связи, а 3-я гибридная орбиталь расположена перпендикулярно плоскости молекулы, образуя 3х-центровую 2хэлектронную связь с крайними атомами кислорода. Предполагается что один из
22

aтомов кислорода находится в возбужденном состоянии и по донорноакцепторному механизму пара электронов помещается на пустую орбиталь.
Качественная реакция на озон, крахмальная бумага, смоченная раствором KI синеет в присутствии озона в результате выделения I2 ,озон более сильный
окислитель, чем О2 с ним эта реакция не протекает.
2KI- + O3 + H2O = I02 + O2 + 2KOH-2
2I- -2e = I2
O03 + 2e = O02
Земля окружена слоем озона, располагающегося на высоте 25 км от её поверхности. Он образуется за счёт поглощения кислородом ультрафиолетового излучения Солнца. Озоновый слой ограничивает поток ультрафиолетового излучения, падающего на землю. Увеличение интенсивности ультрафиолетового излучения, достигающего Землю, могло бы привести к возрастанию заболеваний раком кожи. Вызывает беспокойство возможное разрушение озонового слоя выхлопными газами реактивных самолётов. Сейчас этот вопрос актуален и
широко освещается в печати.
Химичесие свойства О3
Как сильнейший растворитель, реагирует с большим количеством веществ
достаточно энергично. |
4Al + 4O3 → 2Al2O3 + 3O2 |
1. С металлами |
|
2. Со сложными веществами |
PbS + 2O3 → PbSO4 + O2 |
3. Со щелочами |
2 KOH + 7/3 O3 → O2 + 2KO3 + H2O |
|
озонид калия |
Кроме степени окисления +4, кислород может проявлять степень окисле-
ния +2 в соединении со фтором O+2F2 и +1 О2+1F2
2 F2 + 2 NaOH → 2NaF + O+2F2 + H2O-2
Чем сильнее выражены основные свойства, тем меньше значение энергии Гиббса для реакции с H2O
Na2O + H2O = 2 NaOH |
∆G0 |
= -147 кДж/моль |
MgO + H2O = Mg(OH)2 |
∆G0 |
= - 17 кДж/моль |
Al2O3 + H2O = Al(OH)3 |
∆G0 = - 7 кДж/моль |
|
23
|
|
|
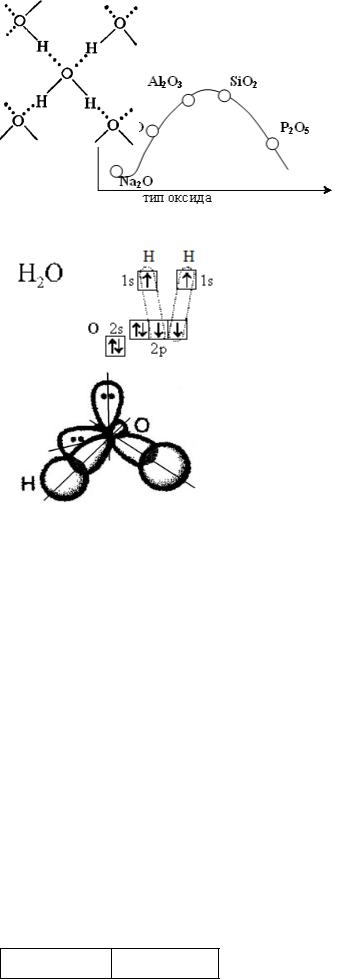
Вода (H2O) – самое распространенное вещест- |
|
|
|
во на Земле. Строение молекулы воды установлено |
|
|
|
экспериментально с большой точностью. Молекула |
|
|
|
воды имеет угловое строение в виде равнобедрен- |
|
|
|
ного треугольника с атомом кислорода в вершине. |
|
|
|
Угол НОН = 104,5°. Для объяснения строения воды |
|
|
|
используют концепцию sp3-гибридизации орбита- |
|
|
|
лей атома кислорода (рис.3.1). Электронная конфи- |
|
|
|
гурация валентной оболочки атома кислорода |
|
|
|
2s22р4. На внешнем электронном уровне у него на- |
|
|
|
ходятся две неподеленные электронные пары и два |
|
|
|
неспаренных электрона. При образовании химиче- |
|
|
|
ских связей гибридизации подвергаются все четыре |
|
Рис.3.1. Строение воды |
атомные орбитали кислорода. Атом кислорода рас- |
|
|
|
|
положен в центре неправильного тетраэдра, две не- |
|
|
|
|
|
|
поделенные электронные пары кислорода занимают две |
|
|
|
вершины тетраэдра, а две другие заняты атомами водоро- |
|
|
|
да, что приводит к угловому строению молекулы воды. Ва- |
|
|
|
лентный угол HОН 104,5° близок к теоретическому значе- |
|
|
|
нию 109°28´. Меньшее значение валентного угла объясня- |
|
|
|
ется расталкиванием между собой неподеленных пар элек- |
|
|
|
тронов. |
|
Рис.3. Образование |
|
Связи Н-О сильно поляризованы, электроны связи Н-О |
|
водородных связей |
смещены к более электроотрицательному атому кислорода. |
||
(…) в воде |
Поэтому атомы О приобретают избыточный отрицатель- |
||
|
|
ный заряд, атомы Н – избыточные положительные заряды. |
|
Молекула воды полярна, поэтому H2O является хорошим растворителем ионных и полярных веществ. Наличие избыточных зарядов на Н и О, а также неподеленных электронных пар у атома кислорода обусловливает образование между молекулами воды водородных связей (Рис.3).
24
Соединение tкип, ˚С

H2O |
+100 |
Физические свойства воды. При обычных |
|||
|
|
условиях вода - жидкость без вкуса и запаха. В тон- |
|||
H2S |
–60 |
||||
ком слое она бесцветна. При толщине более 2м вода |
|||||
|
|
||||
H2Se |
–41 |
приобретает голубоватый оттенок. Температура |
|||
|
|
плавления 0° С, температура кипения +100° С, что |
|||
H2Te |
–2 |
||||
|
|
значительно выше, чем у H S, |
H Se, |
H Te. Ано- |
|
|
|
2 |
2 |
2 |
|
мально высокие температуры плавления и кипения воды объясняются существованием водородных связей между молекулами.
У воды проявляется еще одна аномалия – аномалия плотности. Как правило, вещество в твердом агрегатном состоянии имеет большую плотность, чем в жидком. Вода в твердом агрегатном состоянии (лед) имеет меньшую плотность, чем жидкая вода.
При образовании водородных связей (рис.3) в алмазоподобной структуре льда образуются пустоты. Этим объясняется меньшая плотность льда. Плавление льда сопровождается частичным разрушением водродных связей и заполнением пустот молекулами воды. Плотность жидкой воды при Р = 1,013·105 Па имеет максимальное значение 1 г/см3 при +4° С. Выше этой температуры плотность воды опять начинает уменьшаться. Однако это уменьшение незначитель-
но, при химических расчетах плотность жидкой воды принимается равной
1 г/см3.
Чистая вода имеет незначительную электропроводность, которую можно объяснить самоионизацией воды:
Н2О Н+ + ОН- или 2Н2О Н3О+ + ОН- .
(Ион гидроксония)
В чистой воде при стандартной температуре концентрации ионов водорода и гидроксид-ионов:
С(Н+) = С(ОН-) = 10-7моль/л;
рН чистой воды при 25° С = 7.
Химические свойства воды
Тип реакции |
Пример |
|
Взаимодействие cо щелочными и |
Ca + 2H2O = Ca(OH)2 +H2; |
|
щелочноземельными металлами |
|
|
При высокой температуре с некото- |
t o |
|
Mg + 2H2O ¾¾® Mg(OH)2 +H2 |
||
рыми другими металлами (Mg, Fe, |
t o |
|
Zn) |
||
3Fe+ 4H2O ¾¾® Fe3O4 +4H2 |
||
С Al и Zn в присутствии щелочей |
2Al + 6H2O + 2NaOH = 2Na[Al(OH)4] +3H2 |
|
|
|
|
С некоторыми неметаллами |
Cl2 + Н2О НClО + НCl; |
|
|
||
|
2F2 + 2Н2О = 4НF + O2; |
|
|
t o |
|
|
C + Н2О ¾¾® CO + H2 |
25
С Si в присутствии щелочей |
|
Si + 2H2O + 2NaOH = Na2SiO3 +2H2 |
|
||
|
|
|
|
||
Со сложными веществами |
|
CaO + H2O = Ca(OH)2 |
|
||
|
|
P2O5 + 3H2O = 2H3PO4 |
|
||
|
|
KH + Н2О = KOH + H2 |
|
||
|
|
Na2CO3 + H2O NaНCO3 + NaОН |
|
||
|
|
Ca3P2 + H2O = Ca(OH)2 + 2PH3 |
|
||
|
|
Ca2Si + H2O = Ca(OH)2 + SiH4 |
|
||
|
|
|
|||
Окислительно-восстановительная двойственность пероксида водорода |
|||||
|
|
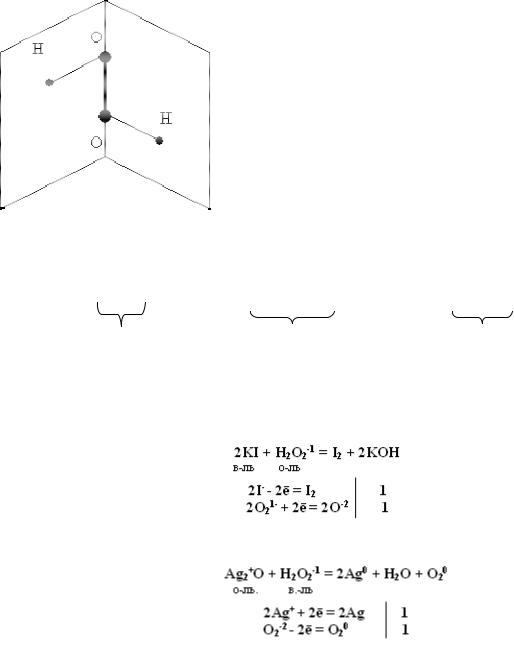
Строение перекиси водорода Н2О2 показано |
|||
|
на рис.5. Молекула H2O2 неплоская, имеет строение |
||||
|
H−O−O−H с σ-связью O−O на ребре и σ-связями H-O |
||||
|
на плоскостях двугранного угла. Степень окисления |
||||
|
кислорода равна −I, |
валентность атома O равна 2. |
|||
|
Группу -O-O- называют пероксогруппой. |
||||
|
|
Пероксид водорода H2O2 - бесцветная жидкость, |
|||
|
неограниченно смешивается с водой. На свету и под |
||||
|
действием катализаторов (MnO2) легко разлагается |
||||
|
(при нагревании - со взрывом): |
||||
Рис.5. Строение пероксида |
|
2H2O2 = 2H2O + O2↑ |
|||
Степень окисления кислорода -1 - промежуточное |
|||||
водорода |
|||||
значение между степенью окисления кислорода в |
|||||
|
|||||
Н2О (-2) и в молекуле кислорода (0) |
|||||
Н2О-2 , |
|
Н2О2-1, |
О2, О+2F2- |
||
восстановитель |
|
двойственность |
окислитель |
||
т.е. Н2О2 проявляет свойства и окислителя и восстановителя. С сильными восстановителями выступает в роли окислителя, при этом восстанавливается
до воды. В приведенных ниже реакциях перекись водорода выступает в двойственной функции
26
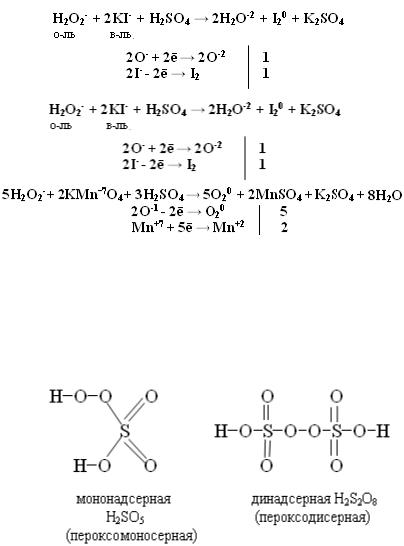
С сильными окислителями перекись водорода – восстановитель, окисля-
ется до свободного кислорода.
Производные Н2О2 надкислоты и надоснования (пероксосоединения). Обязательно наличие пероксидной цепочки (− О – О−). Надкислоты получаются при замещении водорода в молекуле Н2О2 на кислотные радикалы.
При замене одного атома водорода на металл получаем надоснования К− О− ОН, можно рассматривать как кислые соли пероксида водорода называют гидропероксидами. КО2Н.
Важнейшее применение Na2O2 и К2О2 основано на реакции регенерации кислорода, чаще всего в замкнутых помещениях (подводные лодки, летатель-
ные аппараты, батискафы):
2Э2О2 + 2СО2 = 2Э2СО3 + О2
Сера
Сера – типичный неметалл, неметаллические свойства серы выражены слабее, чем у кислорода. При стандартных условиях простое вещество сера представляет
собой порошок или кристаллы желтого цвета.
Аллотропные модификации серы. Существование аллотропных модификаций серы связано с её способностью образовывать устойчивые гомоцепи – S
– S –. Устойчивость цепей объясняется тем, что связи – S – S – оказываются прочнее, чем связь S=S в молекуле S2. Гомоцепи серы имеют зигзагообразную форму, поскольку в их образовании принимают участие электроны взаимно перпендикулярных р-орбиталей.
27
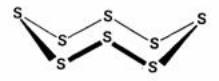
Рис.4. Строение молекулы ромбической
Существует три аллотропные модификации серы:
ромбическая, моноклинная и пластическая. Ромби-
ческая и моноклинная модификации построены из циклических молекул S8. При ком
натной температуре устойчива ромбическая сера. Молекула S8 имеет форму короны (рис.4).
Химические свойства серы
Тип реакции |
Пример |
|
Взаимодействие |
2K + S = K2S |
|
c металлами |
||
Cu + S = CuS |
||
|
||
|
Hg + S = HgS (комнатная температура) |
|
С неметаллами |
C + 2S = CS2 |
|
|
2P + 5S = P2S5 |
|
|
S + 3F2 = SF6 |
|
С водородом |
H2 + S = H2S |
|
|
||
С кислородом |
S + O2 = SO2 |
|
|
||
Со сложными веществами |
S + 2HNO3 = 2NO + H2SO4 |
|
|
||
|
S + 2H2SO4( конц.) = 3SO2 + 2H2O |
|
|
t o |
|
|
S + K2Сr2O7 ¾¾® K2SO4 + Cr2O3 |
|
|
3S + 6KOH = K2S+4O3 + 2K2S-2 + 3H2O |
|
|
|
В промышленности серу в основном получают выплавкой ее из самородных месторождений. Менее используются способы, основанные на окислении промышленных газов, содержащих сероводород:
2H2S + O2 = 2S + 2H2O; |
H2S + SO2 = 2H2O + 3S. |
Сероводород H2S – ковалентное соединение. В отличие от воды молекулы сероводорода не образуют между собой водородных связей. Атом серы менее электроотрицательный, чем атом кислорода, имеет больший размер и, как следствие, меньшую плотность заряда. Валентный угол HSH составляет 92°, что
свидетельствует об отсутствии гибридизации орбиталей атомов серы. Физические свойства. При обычных условиях сероводород – бесцветный
газ, с сильным характерным запахом тухлых яиц. tпл = -86° С, tкип = -60° С, плохо растворим в воде. Очень ядовит. В природе выделяется в составе вулканических газов, образуется при гниении растительных и животных организмов. H2S хорошо растворим в спирте, несколько хуже в воде, придавая раствору слабокислый характер. При растворении в воде образует слабую двухосновную сероводородную кислоту. Диссоциация сероводородной кислоты протекает обратимо и ступенчато:
I ступень
28
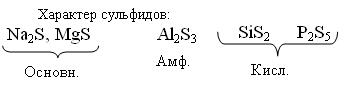
II ступень |
- |
+ |
2- |
; К2=1·10 |
-14 |
|
HS |
H + S |
|
|
Образует средние (сульфиды) и кислые (гидросульфиды) соли. Сероводородной кислоте присущи все свойства слабых кислот. Как двух-
основная, кислота образует два типа солей – сульфиды (Na2S, CuS) и гидросульфиды (NaHS). Гидросульфиды, сульфиды щелочных и щелочно-земельных металлов хорошо растворимы в воде, сульфиды тяжелых металлов практически нерастворимы.
Получение H2S и сульфидов
H2S в промышленности прямым |
H2 + S = H2S |
|
синтезом |
|
|
H2S в лаборатории |
FeS + 2HCl(конц.) = FeCl2 + H2S |
|
|
|
4Ca + 5H2SO4( конц.) = 4CaSO4 + 4H2O + H2S |
|
|
|
Сульфиды: |
взаимодействие |
Fe + S = FeS |
простых веществ |
|
|
|
|
|
Из растворов солей по реакции |
Pb(NO3)2 + (NH4)2S = PbS↓ + 2NH4NO3 |
|
ионного обмена |
|
|
|
|
|
|
|
|
На примере элементов III периода показан характер сульфидов - кислотные, основные, амфотерные.
Различно реагируют с Н2О. Основные соли гидролизуются
Основн. Na2S + H2O → NaHS + NaOH (гидролиз)
Амф. Al2S3 + 6H2O → Al(OH)3 + H2S↑
Кисл. SiS2 + 3H2O → H2SiO3↓ + 2H2S↑
1. Большинство сульфидов малорастворимы в воде, растворимы в кисло-
тах:
FeS + 2HCl → FeCl2 + H2S
2. Некоторые нерастворимы в разбавленных кислотах, но реагируют с окислителями:
CuS + 8HNO3 → CuSO4 + 8NO2 + 4H2O
вост. ок.
3. Растворяются в растворах сульфидов щелочных металлов
As2S3 + 3Na2S = 2Na3AsS3
4. Сплавление различных по природе сульфидов также приводит к растворению.
Na2S + CS2 → Na2CS3 – тиокарбонат натрия
29

Сероводород
H2S и сульфиды могут окислятся до S, SO2, SO42-
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr
3H2S + H2SO4 → 4S + 4H2O
2H2S + O2 → 2S + 2H2O
2H2S + 3O2 → 2SO2 + 2H2O
H2S-2 + I2 → 2HI- + S0
H2S + 2HNO3конц → S0↓ + 2NO2 + 2H2O
Сульфаны (полисульфиды водорода)
Т. к. связь S−S прочна, то существуют полисульфиды водорода (сульфаны): H2S2, H2S3, H2S4 и т. д. В воде сульфаны проявляют свойства более сильных кислот, чем H2S, поэтому гидролизуются меньше. А их соли полисульфиды используются, как пестициды.
H2SX X=1÷8
Na2S+S=Na2S2
Na2S+2S=Na2S3
Они имеют зигзагообразные цепи. Сульфаны – это жёлтые, вязкие жидкости с резким запахом, растворимые в растворах щелочей с образованием полисульфидов щелочных металлов.
Сульфиды щелочных и щелочноземельных металлов не окрашены, сульфиды других металлов имеют характерную окраску, например, сульфиды меди (II), никеля и свинца – черные, кадмия, индия, олова – желтые, сурьмы – оран-
жевый. Осаждение из раствора характерно окрашенных сульфидов металлов с очень малой растворимостью используют как качественные реакции.
Сероводород и сульфиды - типичные восстановители. Химические свойства H2S и сульфидов:
Тип реакции |
Пример |
Разлагается при нагревании |
t o |
H2S ¾¾® S + H2 |
|
С неметаллами |
H2S + I2 = S↓ + 2HI |
Со щелочами |
H2S + 2KOH = K2S + 2H2O |
|
|
|
H2S + KOH = KHS + H2O |
С кислородом |
2H2S + 3O2 = 2SO2 + 2H2O |
|
2H2S + O2(недостаток) = 2S + 2H2O |
|
2ZnS + O2(недостаток) = 2ZnO + S |
Со сложными веществами |
H2S + 2HNO3(конц.) = S↓ + 2NO2↑ + 2H2O |
|
|
30
