
1. Основные понятия химии 2012
.pdf21
тым системам. Например, закрытый сосуд с водой, длительное время находящийся в помещении.
Процессы в системе и их классификация. Если какой-
либо параметр состояния системы изменяется, то это означает протекание процесса в системе. Например, при охлаждении разо- гретой воды в чайнике уменьшается ее температура.
Удобна классификация процессов по признаку сохранения постоянным какого-либо ее параметра состояния. Изобарный процесс протекает при постоянном давлении, изохорный – при постоянном объеме, изотермический – при постоянной темпера- туре, адиабатический – при отсутствии теплообмена с окружаю- щей средой (или при неизменной энтропии), политропический – при неизменной теплоемкости системы.
Другой признак классификации – необходимость участия окружающей среды для осуществления процесса. Самопроиз- вольный процесс протекает без участия окружающей среды. На- пример, теплопередача от тела с более высокой температурой к телу с более низкой температурой, смешивание газообразных или жидких компонентов раствора. Несамопроизвольный процесс протекает только за счет воздействия окружающей среды, на- пример, разделение компонентов раствора перегонкой, охлажде- ние морозильной камеры холодильника.
Если система изолированная, то в ней возможны только са- мопроизвольные процессы. Их результатом явится установление в системе стационарного состояния.
© 1993 – 2012 А.А.Сибиркин

22
Понятие компонента. Условие материального баланса
Понятие компонента. Под компонентом (составляющим веществом системы) понимают индивидуальное вещество, яв- ляющееся частью системы. Для характеристики состава много- компонентных систем применяют понятие концентрации. В на- стоящее время наибольшее распространение получили следую- щие способы выражения состава смесей.
Способы выражения состава смесей. Массовой долей компонента в смеси называется отношение массы этого компо- нента к массе смеси. Эта величина безразмерна и изменяется в пределах от 0 до 1.
ω = |
m |
или ω = |
m |
×100 % . |
mр |
|
|||
|
|
mр |
||
Молярной долей компонента в смеси называется отношение количества вещества этого компонента к количеству вещества смеси. Эта величина также безразмерна и изменяется в пределах от 0 до 1.
x = |
|
ν |
или x = |
|
ν |
×100 % . |
||
|
|
|
|
|
|
|||
ν |
р |
ν |
р |
|||||
|
|
|
|
|
|
|
||
Молярной концентрацией, или молярностью, называется отношение количества вещества растворенного вещества к объе- му раствора. Молярность раствора имеет размерность моль/л (обычно обозначается М) или иную, производимую от нее.
C = ν . Vр
Моляльной (мольно-массовой) концентрацией, или моляль- ностью, называется отношение количества вещества растворен- ного вещества к массе растворителя. Моляльность раствора име- ет размерность моль/кг или иную, производимую от нее.
© 1993 – 2012 А.А.Сибиркин

|
23 |
|
|
Cμ = |
|
ν |
. |
|
|
||
|
|
mр−ля |
|
Титром называется отношение массы растворенного веще- ства к объему раствора. Титр раствора имеет размерность г/л или иную, производимую от нее.
T = m . Vр
Содержание вещества в насыщенном растворе выражают растворимостью, которая равна массе вещества, приходящейся на 100 г растворителя в насыщенном растворе. Рассмотрим s + 100 г раствора. Тогда масса вещества в нем равна s, а значит,
массовая доля вещества составляет
ω = s . s + 100
Другие способы выражения концентрации (объемная доля, эквивалентная концентрация) рассматриваются в следующих разделах курса.
Условие материального баланса. Представим физический или физико-химический процесс как превращение одной сово- купности систем (или подсистем) в другую. Условие материаль-
ного баланса отражает утверждение о равенстве масс каждого из компонентов (составляющих веществ) в исходной и конечной совокупностях систем (или подсистем). Теоретической основой
условия материального баланса является закон сохранения массы веществ (М.В.Ломоносов, 1741, Россия, A.L.Lavoisier, 1792,
Франция).
Для практического применения условия материального ба- ланса необходимо выразить массы составляющих веществ в каж- дой из систем (подсистем), основываясь на содержании конкрет- ной задачи. Так, если система (подсистема) представлена инди- видуальным веществом, то массу можно выразить одним из сле- дующих способов:
© 1993 – 2012 А.А.Сибиркин

|
24 |
|
m = n M = |
N |
M = ρ V = m N . |
|
||
|
0 |
|
|
N A |
|
Для растворенного вещества выбор способа выражения мас- сы определяется способом выражения его концентрации:
m = ω m = ω ρ V = x n M = C V M = Cμ mр−ля M = T V = |
s |
m. |
|
s + 100 |
|||
|
|
Массу растворителя в растворе следует выразить через те же переменные:
m = (1−ω) m = (1− ω) ρ V = (1− x)n M =
= ρ V − C V M = mр−ля = ρ V −T V = s +100100 m.
В результате применения условия материального баланса появляется система уравнений. Число уравнений в ней равно числу веществ в системе. Решение такой системы уравнений по- зволяет вычислить значения такого же числа неизвестных, сколь- ко уравнений было в системе.
Пример 1. Получите математическое выражение, связы- вающее молярную концентрацию и массовую долю компонента.
Решение.
Рассмотрим одинаковые количества двух растворов, имею- щих равные концентрации, выраженные различными способами.
Масса растворенного вещества в них равны. Поэтому
ω ρ V = C V M ,
откуда после сокращения на объем раствора
© 1993 – 2012 А.А.Сибиркин
25
ω = CρM .
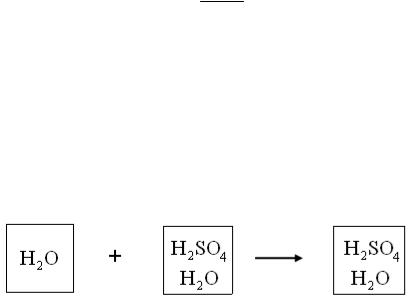
Пример 2. К 250 г воды добавлено 50 мл 48 % (масс.) рас- твора серной кислоты плотностью 1.38 г/мл. Рассчитайте массо- вую долю серной кислоты в полученном растворе.
Решение. Пусть 1 – исходная вода, 2 – исходный раствор серной кислоты, 3 – полученный раствор серной кислоты. Пред- ставим графически исходную и конечную совокупности систем:
Условие материального баланса приводит к системе из двух уравнений:
H2SO4 |
ω2 ρ2 V2 = |
ω3 m3 |
H2O |
m1 + (1-ω2 ) ρ2 V2 = |
(1- ω3 )m3 |
Эта система уравнений содержит два неизвестных – ω3 и m3. Ее решение существует, причем первое из неизвестных является искомой величиной в задаче. Почленное деление второго уравне- ния на первое позволяет исключить переменную m3 и получить уравнение с одной неизвестной ω3:
m1 + (1-ω2 ) ρ2 V2 |
= |
1−ω3 |
. |
|||||
|
||||||||
ω |
2 |
ρ |
2 |
V |
|
ω |
3 |
|
|
|
2 |
|
|
|
|||
После подстановки данных условия и выполнения тожде-
ственных преобразований получаем
|
1−ω3 |
= |
250 г + (1- 0.48)×1.38 г / мл × 50 мл |
= 8.63, |
|||||
ω3 |
0.48×1.38 г / мл ×50 мл |
||||||||
|
|
|
|||||||
|
|
|
1- ω3 = 8.63ω3 , |
|
|||||
|
|
|
ω3 = |
|
|
1 |
= 0.104. |
|
|
|
|
|
1 |
+ 8.63 |
|
||||
|
|
|
|
|
|
||||
© 1993 – 2012 А.А.Сибиркин
26
Ответ: 10.4 %.
В дальнейшем уравнения материального баланса будут до- полнены другими способами выражения массы, что даст воз- можность применить этот прием для решения новых классов за- дач.
Интенсивные и экстенсивные параметры состояния.
Интенсивные параметры состояния не зависят от числа частиц в системе, они остаются неизменными при рассмотрении части системы. К ним относятся температура, давление, плотность, вязкость, показатель преломления, электрическое напряжение, все виды концентраций, все удельные и молярные величины (удельная теплоемкость, молярный объем и т. д.).
Экстенсивные величины пропорциональны числу частиц в системе, они уменьшаются пропорционально рассматриваемой части (доле) системы. К ним относятся количество вещества, масса, объем, сила, импульс, энергия, работа, количество тепло- ты, теплоемкость, энтропия, электрический заряд и т. д.
Интенсивные величины мультипликативны, т.е. их произве- дение (частное) определено, имеет физический смысл и является интенсивной величиной. Множество интенсивных величин замк- нуто относительно операции умножения (деления), например,
Vm = Mρ .
Экстенсивные величины аддитивны, т.е. их сумма (раз- ность) определена, имеет физический смысл и является экстен- сивной величиной. Множество экстенсивных величин замкнуто относительно операции сложения (вычитания), например,
m = m1 + m2 .
Произведение (частное) одной или более интенсивных ве- личин на экстенсивную является экстенсивной величиной, на- пример,
m = ωρV .
© 1993 – 2012 А.А.Сибиркин

27
Отношение экстенсивных величин является интенсивной величиной, например,
ρ = Vm .
Произведение экстенсивных величин не имеет смысла. Та- кое произведение может в ряде случаев оказаться частью матема- тического выражения. Например, в выражении кинетической энергии через импульс квадрат импульса делится на массу, что
позволяет сократить вторую степень экстенсивной величины в числителе:
E = mv2 = m2v2 = p2 . 2 2m 2m
Сумма интенсивных величин может иметь смысл и являться интенсивной величиной, если удается представить интенсивную величину отношением экстенсивных. Это иллюстрируется выво- дом зависимости молярной массы смеси от ее состава:
M = |
m |
= |
m1 + m2 |
= |
n1M1 + n2M 2 |
= x M |
+ x |
M |
. |
(3) |
|
|
|
|
|||||||||
|
n |
|
n |
|
n |
1 |
1 |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|||
Экстенсивная величина может являться однородной функ- цией первого порядка относительно экстенсивных величин, на- пример,
m = ω1ρ1V1 + m2 .
Расчет интенсивных величин может быть выполнен не толь- ко при наличии, но и при отсутствии экстенсивных величин. При
необходимости для нахождения интенсивной величины только из набора интенсивных можно произвольно ограничить экстенсив- ное свойство, что создает удобства в рассуждениях без ущерба для их строгости. Так, расчет молярного объема воды можно вы- полнить по приведенной выше формуле, разделив молярную мас- су на плотность. Логично также рассмотреть 1 моль воды и за- ключить, что такое количество имеет массу 18 г и занимает объ- ем 18 мл.
© 1993 – 2012 А.А.Сибиркин
28
Расчет экстенсивной величины требует обязательного зна- ния какой-либо другой экстенсивной величины. Так, невозможно ответить на вопрос, сколько граммов соли содержится в 10 % растворе, даже указав дополнительно его плотность или темпера- туру.
В литературных и справочных данных обычно приводятся интенсивные величины, которые могут быть определены незави- симо от конкретной ситуации. Так, в справочниках нельзя при- вести сведения о массе или объеме произвольных веществ, хотя в них представлены сведения об удельной теплоемкости, плотно-
сти и других интенсивных свойствах и их зависимости друг от друга, например, давления пара от температуры.
© 1993 – 2012 А.А.Сибиркин
29
Вариантность системы. Правило фаз
Понятие независимого компонента. В том случае если в системе протекает химическая реакция, то для образования всех
фаз достаточно ввести в систему первоначально меньшее число веществ, чем их окажется в результате реакции. Наименьшее чис- ло веществ, достаточное для образования всех фаз системы в их произвольном количестве, называется числом независимых ком- понентов системы.
Пример. В системе
CaCO3 CaO + CO2
число независимых компонентов К = 2. В систему достаточно поместить попарно CaCO3, CaO и CO2, чтобы образовался третий компонент. Он окажется зависимым.
Понятие вариантности системы. Вариантность системы определяется числом параметров состояния, которые можно из-
менять непрерывно в некотором интервале при сохранении прежнего числа компонентов и прежнего числа фаз. Вариант- ность иначе называют числом степеней свободы С и рассчиты-
вают из правила фаз
С + Ф = К + П,
где Ф – число фаз, К – число независимых компонентов, П - чис- ло параметров состояния, воздействие которых на систему мы рассматриваем в данном рассуждении. Если это температура и давление, то П = 2. Если только температура, то П = 1.
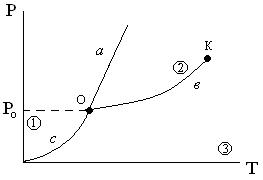
Диаграмма состояния индивидуального вещества. Диа-
граммой состояния называется совокупность точек плоскости,
координаты которых соответствуют определенному состоянию системы. Такие точки называются фигуративными.
Рассмотрим простейшую диаграмму состояния – диаграм- му состояния индивидуального вещества, не претерпевающего химического изменения. Применим к ней правила фаз.
Во всех точках диаграммы К = 1.
© 1993 – 2012 А.А.Сибиркин
30
Эта диаграмма представляет собой рисунок в координатах давление – температура, так что число параметров состояния П = 2.
Фигуративные точки объединяются в три части плоскости и три линии.
Область 1 отвечает твердому состоянию, область 2 - жид- кому состоянию, область 3 – газообразному. В каждой из этих областей Ф = 1 и, согласно правилу фаз, С = 2. Это означает, что можно изменять одновременно не более двух параметров состоя- ния, так чтобы сохранить прежние компоненты и фазы. Этими параметрами состояния являются температура и давление.
Кривая a отделяет области твердого и жидкого состояния и отвечает их взаимному переходу (плавлению и кристаллизации). Кривая b, отделяя жидкую и газовую фазы, отражает процессы испарения и конденсации. Кривая c соответствует процессам воз- гонки и десублимации, являясь границей между кристаллической и газовой фазами. На всех этих кривых Ф = 2 и, следовательно, С = 1. Это означает, что только один параметр состояния (темпе- ратуру или давление) можно изменять произвольно. Второй па-
раметр нужно изменить в строгом соответствии с изменением первого, с тем, чтобы снова оказаться на линиях a, b или c и обеспечить Ф = 2.
Точка O, являющаяся общей для трех кривых и трех полей диаграммы, называется тройной. В этой точке (при строго задан- ных температуре и давлении) в системе одновременно присутст- вуют все три фазы. При Ф = 3 будет выполняться С = 0. Это оз- начает, что ни один параметр состояния (ни температуру, ни дав- ление) нельзя изменить так, чтобы сохранить все три фазы.
© 1993 – 2012 А.А.Сибиркин
